
Alport综合征(AS)是慢性肾脏病和终末期肾脏病(ESRD)的重要病因之一,是继常染色体显性遗传性多囊肾后第二常见的遗传性肾脏疾病。常染色体显性遗传是AS中非常少见的遗传方式,既往报道常染色体显性遗传AS(ADAS)患者进展至ESRD年龄较晚。本文报道1例因发现尿检异常4年于2019-09-05就诊于河南中医药大学第一附属医院儿科肾脏病区确诊为ADAS患者的临床资料及基因检测结果并复习相关文献。报道了COL4A4基因新发变异c.3506-3528del(p.G1169Efs*13)所致ADAS家系(该家系中1名成员在31岁时已进展至ESRD)的临床、肾脏病理及基因突变情况,并总结了中国ADAS的文献报道,对该病的基因和临床表型、预后之间的关系做了较全面地分析。由于ADAS发病率低,此家系报道扩展了AS的基因突变谱,有助于提高临床医生对罕见发病的ADAS的认识和及时诊治。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
Alport综合征(Alport syndrome,AS)是一种以血尿、蛋白尿和进行性肾衰竭为特征的遗传性肾小球疾病[1],发病率为1/10 000~1/5 000[2],约占成人新发终末期肾脏病(end-stage renal disease,ESRD)的0.5%[3]、儿童的12.9%和接受肾脏替代疗法患者的2%[4]。约85%的AS患者为COL4A5或COL4A5和COL4A6两个基因突变导致的X连锁AS(X-linked Alport syndrome,XLAS),其余为COL4A3/COL4A4基因突变导致的常染色体隐性遗传AS(autosomal recessive Alport syndrome,ARAS)和常染色体显性遗传AS(autosomal dominant Alport syndrome,ADAS)[5]。既往报道ADAS占AS的1%~5%,最近有研究发现ADAS发生率可能高达18.9%[6]。相比XLAS(男性)和ARAS,ADAS临床表型相对较轻,进展至ESRD时间较晚。本文报道了1例COL4A4基因新发变异c.3506-3528del(p.G1169Efs*13)所致ADAS家系(该家系中1名成员在31岁时已进展至ESRD)的临床、病理及基因突变情况,并总结了文献报道的中国ADAS患者临床表型,扩展了AS的基因突变谱,有助于提高临床医生对ADAS的认识和诊治。
先证者(Ⅱ-4),女,30岁,因发现尿检异常4年于2019-09-05就诊于河南中医药大学第一附属医院儿科肾脏病区。患者4年前体检发现镜下血尿、蛋白尿和高血压(1级),此后,间歇性服用缬沙坦、氯沙坦或中药等治疗,病情无好转。家族史:先证者父亲(Ⅰ-1)有镜下血尿和高血压(2级);先证者两个女儿(Ⅲ-3,Ⅲ-4)和儿子(Ⅲ-5)均出现镜下血尿;先证者姐姐(Ⅱ-2)在31岁时被诊断为ESRD、肾萎缩、高血压(2级),儿子(Ⅲ-1)有镜下血尿,女儿(Ⅲ-2)未见异常表现;先证者妹妹(Ⅱ-6)及其两个儿子(Ⅲ-6,Ⅲ-7)未见异常表现。该家系成员生长发育均正常,肾功能诊断标准参照2012年改善全球肾脏病预后组织(KDIGO)《慢性肾脏病临床实践指南》[7],并对慢性肾脏病(CKD)进行分期。家系谱见图1,家系成员主要临床表型见表1。
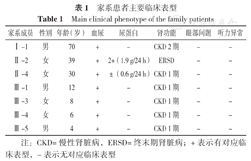
家系患者主要临床表型
Main clinical phenotype of the family patients
家系患者主要临床表型
Main clinical phenotype of the family patients
| 家系成员 | 性别 | 年龄(岁) | 血尿 | 尿蛋白 | 肾功能 | 眼部问题 | 听力异常 |
|---|---|---|---|---|---|---|---|
| Ⅰ-1 | 男 | 70 | + | - | CKD 2期 | - | - |
| Ⅱ-2 | 女 | 39 | + | 2+(1.9 g/24 h) | ERSD | - | - |
| Ⅱ-4 | 女 | 30 | + | ±(0.6 g/24 h) | CKD 1期 | - | - |
| Ⅲ-1 | 男 | 12 | + | - | CKD 1期 | - | - |
| Ⅲ-3 | 女 | 8 | + | - | CKD 1期 | - | - |
| Ⅲ-4 | 女 | 6 | + | - | CKD 1期 | - | - |
| Ⅲ-5 | 男 | 4 | + | - | CKD 1期 | - | - |
注:CKD=慢性肾脏病,ERSD=终末期肾脏病;+表示有对应临床表型,-表示无对应临床表型

先证者入院后查尿常规:尿蛋白±,隐血3+,红细胞284.1/μl(参考范围:0~25.0/μl);24 h尿蛋白定量600 mg/24 h(参考范围:0~150 mg/24 h);肾功能(血清肌酐78 μmol/L)、抗核抗体、抗中性粒细胞胞浆抗体、抗双链DNA抗体、红细胞沉降率、补体C3和C4均正常。眼科检查:无前圆锥形晶状体、黄斑周围点状和斑点状视网膜病变等特征性改变。听力检查:无双侧高频感音神经性听力损失。超声检查:未见肾脏、输尿管及膀胱异常。
肾脏病理:光镜见1条皮质和1条皮髓交界组织,共22个肾小球,其中3个肾小球缺血废弃,余肾小球系膜偶见节段轻度增生;少数肾小管腔内见蛋白管型;小灶性和散在肾小管萎缩、间质纤维增生。免疫荧光,常规标记免疫球蛋白(Ig)G、IgA、IgM、C3、C4、C1q、Fibrinogen均为阴性;基底膜Ⅳ型胶原α3、α5链表达正常。电镜下肾小球系膜细胞和基质轻度节段增生,基底膜变薄(100~250 mm),节段厚薄不均伴致密层分层状改变,上皮足突大部分融合,未见电子致密物沉积。病理诊断:早期AS可能性大,见图2。
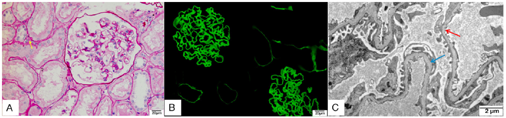

注:A为小灶性肾小管基底膜增厚、间质少量纤维增生(PAS染色),B为免疫荧光Ⅳ型胶原α3表达正常,C为电镜示基底膜变薄(红色箭头所示)、小节段分层(蓝色箭头所示)
采集先证者及其他家系成员(先证者父母,先证者丈夫及其子女,先证者姐姐及其丈夫和子女)外周血标本2 ml送至北京迈基诺医学检验所,进行二代测序分析先证者致病基因,用Sanger测序方法在家系其他成员对所发现的致病基因变异及父母来源进行验证。结果显示,先证者COL4A4基因有1个杂合移码突变:COL4A4基因编码区第3 506~3 528位碱基缺失,导致第1 169位氨基酸甘氨酸变为谷氨酸,即p.G1169Efs*13,并终止于第1 181位(图3)。与野生型COL4A4蛋白相比,突变的COL4A4改变了蛋白结构。蛋白结构域信息参考EMBL-EBI数据库[8],蛋白三维结构图见图4。对照正常人群数据库(dbSNP、千人基因组、ESP6500、EXAC),该位点变异分布频率为-,为低频变异。检索HGMD数据库未有该位点的相关报道,ClinVar数据库无该位点致病性分析结果。根据美国医学遗传学与基因组学会(ACMG)《ACMG遗传变异分类标准与指南》[9],该变异被解释为"疑似致病性变异"〔PVS1+PM2:PVS1,该变异为零效变异(移码变异,可能导致基因功能丧失);PM2,在正常人群数据库中的频率为-,为低频变异〕。进一步Sanger测序证实,先证者父亲,先证者两个女儿、儿子,先证者姐姐及其儿子,chr2-227898174-227898210显示c.3506-3528del杂合突变,其他家系成员chr2-227898174-227898210未显示突变。经家系验证分析,该变异来自先证者父亲。先证者临床诊断达到AS诊断标准[5],遗传模式符合常染色体显性遗传,基因诊断为COL4A4杂合突变,符合ADAS诊断标准[10],故诊断为ADAS。
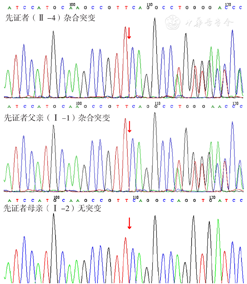

注:先证者及先证者父亲存在c.3506-3528del杂合突变
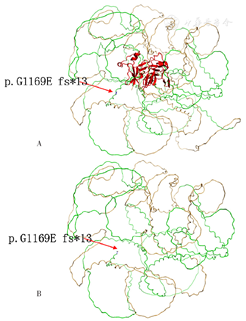

注:A为野生型,B为本研究突变型;结构域:绿色表示Collagen triple helix repeat,红色表示C-terminal tandem repeated domain in type 4 procollagen
先证者(Ⅱ-4)给予贝那普利(10 mg,1次/d,口服)治疗,随访2年。2021-12-16复查尿常规:尿蛋白-,隐血3+,红细胞274.6 /μl;24 h尿蛋白定量0.5 g/24 h;肾功能:血清肌酐69 μmol/L(CKD 1期)。先证者姐姐(Ⅱ-2)仍在进行透析治疗。其余家系成员仍仅表现为镜下血尿,未见其他异常。
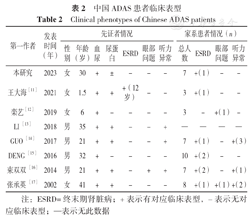
目前,有关ADAS表型的数据相对稀少,检索中国知网、维普网、万方数据知识服务平台、PubMed等数据库共获取7篇中国人ADAS的文献报道[11,12,13,14,15,16,17],其中中文4篇[11,12,16,17],外文3篇[13,14,15]。本研究ADAS患者与文献报道的中国ADAS患者临床表型见表2。
中国ADAS患者临床表型
Clinical phenotypes of Chinese ADAS patients
中国ADAS患者临床表型
Clinical phenotypes of Chinese ADAS patients
| 第一作者 | 发表时间(年) | 先证者情况 | 家系患者情况(n) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 性别 | 年龄(岁) | 血尿 | 尿蛋白 | ESRD | 眼部问题 | 听力异常 | 总人数 | ESRD | 眼部问题 | 听力异常 | ||
| 本研究 | 2023 | 女 | 30 | + | ± | - | - | - | 7 | +(1) | - | - |
| 王大海[11] | 2021 | 女 | 1.5 | + | + | +(12岁) | - | - | 3 | +(1) | - | - |
| 栾艺[12] | 2019 | 女 | 6 | + | - | - | - | - | 3 | - | +(1) | - |
| LI [13] | 2018 | 男 | 35 | + | + | - | - | + | — | — | — | — |
| GUO [14] | 2017 | 男 | 21 | + | + | - | - | + | 7 | +(1) | - | +(3) |
| DENG [15] | 2016 | 男 | 32 | + | - | - | - | - | 10 | +(2) | - | - |
| 束双双[16] | 2014 | 男 | 21 | + | + | - | + | + | 7 | +(2) | - | +(1) |
| 张承英[17] | 2002 | 女 | 41 | + | + | - | - | - | 8 | +(1) | +(1) | +(2) |
注:ESRD=终末期肾脏病;+表示有对应临床表型,-表示无对应临床表型;—表示无此数据
ADAS由JEFFERSON等[18]于1997年首次报道,提出COL4A3和COL4A4基因突变可引起一系列肾小球基底膜疾病,包括ARAS、ADAS和家族性良性血尿。2004年,PESCUCCI等[19]调查了4个ADAS家系,证实了ADAS是由COL4A4或COL4A3基因突变引起,并发现受影响的22例患者表现出了从非进行性孤立性镜下血尿到ESRD(50岁)的严重程度不同的广泛表型;另有3个杂合子个体(分别为90、22、11岁)完全无临床症状。本文报道了1例COL4A4基因突变所致ADAS患者,该家系7例患者均有镜下血尿,其中2例伴有蛋白尿,1例发展至ESRD,患者均未见眼部特异性损害和听力异常。通过总结文献报道的7个中国ADAS家系发现,血尿为ADAS最常见的临床表型,血尿以外的临床表型具有高度可变性,蛋白尿为第二常见表型,12.5%~33.3%的ADAS进展为ESRD,ADAS患者眼部和听力问题发生率较低。国外3项有关ADAS的研究发现,50.0%~65.2%的患者出现蛋白尿,12.0%~24.3%的患者进入ESRD,2.4%~4.0%的患者41岁前发展至ESRD,中位肾脏存活时间为70年,3.0%~8.4%的患者有感音神经性耳聋,约2.7%的患者有眼部特异性损害[20,21,22],本研究与其大致相符。
ADAS的主要发病机制与位于2号染色体上的COL4A3、COL4A4基因突变有关。COL4A3或COL4A4基因发生突变,其所编码的Ⅳ型胶原的α3或α4链结构异常,影响肾小球、耳蜗和晶状体等基底膜的Ⅳ型胶原网络稳定性,导致本病的发生。ADAS中发现的COL4A3或COL4A4基因突变无明显热点区域。本研究发现COL4A4基因编码区第3 506~3 528位碱基缺失,导致第1 169位氨基酸甘氨酸变为谷氨酸,即p.G1169Efs*13,并终止于第1 181位,该变异导致COL4A4蛋白结构发生改变。目前该变异在PubMed数据库未检出,该研究发现的COL4A4基因新突变丰富了ADAS的基因突变谱,有助于ADAS的进一步临床研究。
ADAS诊断主要依据临床表现、家族史、肾活检组织电镜检查、组织基底膜Ⅳ型胶原α链免疫荧光学检查,以及Ⅳ型胶原基因分析。诊断该疾病要求临床符合AS诊断标准,遗传模式符合常染色体显性遗传,致病基因为COL4A3或COL4A4杂合突变[10]。由于40%薄基底膜肾病(TBMN)患者可被检出COL4A3或COL4A4突变,对于不典型ADAS,应注意与TBMN鉴别。TBMN伴有显著蛋白尿及发展至ESRD很罕见,肾脏病理是区分二者的重要依据,肾小球基底膜弥漫性变薄是TBMN诊断的"金标准",而电镜下见肾小球基底膜致密层不规则变薄、增厚、撕裂分层是AS特征性的肾脏病理改变[23]。本研究家系7例患者,临床表现为血尿、蛋白尿,1例患者于31岁进展至ESRD,先证者肾脏病理提示肾小球基底膜节段厚薄不均伴致密层分层状改变,基因检测示COL4A4基因杂合突变,结合家系调查结果,ADAS诊断明确。近年来发现COL4A3、COL4A4基因突变亦为局灶性节段性肾小球硬化(FSGS)的致病基因,ADAS、TBMN、FSGS具有重叠的病理和基因突变,亦有学者提议将三者视为Ⅳ型胶原相关肾病的亚型,代表疾病进展的不同阶段,但目前尚未达成共识[24]。
本病迄今尚无根治方法,药物干预旨在减少蛋白尿,延缓疾病进展,一旦进展至ESRD的患者,则行肾脏替代治疗[25]。2020年国外发布的《儿童、青少年和年轻成人Alport综合征诊断和管理的临床实践建议-2020年更新》[26]建议:(1)血管紧张素转化酶抑制剂(ACEI)依然是AS患者的一线治疗方案,血管紧张素受体阻滞剂(ARB)和醛固酮抑制剂为二线治疗方案;(2)仅有孤立性血尿的ADAS患者暂不开始ACEI治疗,但应密切监测尿微量白蛋白/肌酐、尿蛋白和肾功能;(3)对于ADAS患者,建议当排除感染的情况下重复出现微量白蛋白尿时(定义为尿微量白蛋白/肌酐>30 mg/g)给予治疗。本研究中,先证者表现为血尿和蛋白尿,应用ACEI类药物治疗,目前病情未见进展,但仍需长期随访,观察远期预后情况;该家系中儿童和青少年成员,应密切随访尿微量白蛋白/肌酐、尿蛋白和肾功能等情况,出现微量白蛋白尿时即要考虑开始ACEI类药物治疗。
ADAS肾病进展缓慢,患者进展至ESRD的时间较晚。尽管双基因或复合遗传被认为是严重表型的原因之一,但在FURLANO等[21]研究中41岁之前需要肾脏替代治疗的患者中并没有显示出双基因或复合遗传,临床表型及预后的显著差异提示了遗传修饰因素或环境因素的作用。此外,在CKD中有相当比例的患者发现COL4A3或COL4A4致病变异[27,28],提示异常的Ⅳ型胶原三螺旋结构可能对患者造成严重损害,但不能排除COL4A3或者COL4A4致病变异是其他肾脏病,如高血压或糖尿病肾病的有害因素[21]。本研究家系中1例患者于31岁时进展至ESRD,考虑与以下因素有关:(1)该患者仅进行了Sanger测序,是否存在其他基因突变尚不知晓;(2)患者可能存在影响肾脏预后的其他因素,高血压增加了患者进展至ESRD的风险;(3)确诊时间较晚,未及时进行药物干预治疗。
综上,ADAS在我国报道甚少,本文报道了COL4A4基因c.3506-3528del突变导致的ADAS,并通过文献复习较为全面地分析了该病的基因和临床表型、预后之间的关系,有助于扩充AS基因突变谱,提高临床医生对该病的认识和及时诊治。ADAS患病率较低,一些患者缺乏特异性表现以及环境或基因修饰物的突出作用等,导致其诊断较为罕见,而提高对ADAS的认识将促进其诊断并减少ESRD的发生。
郭婷,张建,丁樱,等. COL4A4基因新突变致常染色体显性遗传Alport综合征一例并文献复习[J].中国全科医学,2023,26(18):2306-2310.[www.chinagp.net]
GUO T,ZHANG J,DING Y,et al. Autosomal dominant Alport syndrome caused by a novel COL4A4 gene mutation:a case report and literature review[J]. Chinese General Practice,2023,26(18):2306-2310.
本文无利益冲突。



























