
随着老龄化进程的加快,痴呆的发病率正逐年增高,但目前尚无有效治愈手段且预后差。主观认知下降(SCD)作为痴呆的临床前期阶段,认知功能仍有可塑性,探讨其患病率及影响因素对痴呆的防控管理具有重大意义。
明确内蒙古包头地区60岁及以上人群SCD、轻度认知障碍(MCI)和痴呆的患病率及相关危险因素。
于2021年6月—2022年9月,采用多阶段抽样、整群抽样、随机抽样相结合的方法,选择内蒙古自治区包头市的3个旗县区(昆都仑区、九原区、固阳县)随机抽取21个居委会、17个村委会的1 120例研究对象开展横断面调查。采用问卷调查法收集研究对象的一般资料并进行认知功能评估。依据认知功能将研究对象划分为正常组(n=206)、SCD组(n=491)、MCI组(n=320)、痴呆组(n=103)。采用多因素Logistic回归分析探究研究对象认知功能状况的影响因素。
研究对象中位年龄68.0(63.0,73.0)岁,中位受教育年限9.0(5.0,11.4)年。无配偶〔OR=2.542,95%CI(1.139,5.674),P=0.023〕、肥胖〔OR=6.058,95%CI(2.281,16.093),P<0.001〕、以素食为主〔OR=3.037,95%CI(1.868,4.936),P<0.001〕、每晚睡眠时长<6 h〔OR=1.662,95%CI(1.099,2.516),P=0.016〕、吸烟史〔OR=1.971,95%CI(1.231,3.157),P=0.005〕、糖尿病史〔OR=1.975,95%CI(1.140,3.422),P=0.015〕、冠心病史〔OR=3.501,95%CI(1.016,12.062),P=0.047〕及视力下降史〔OR=2.454,95%CI(1.638,3.677),P<0.001〕是≥60岁人群SCD患病的危险因素。居住农村〔OR=2.636,95%CI(1.231,5.641),P=0.013〕、无配偶〔OR=2.843,95%CI(1.228,6.582),P=0.015〕、肥胖〔OR=5.626,95%CI(2.046,15.475),P=0.001〕、以素食为主〔OR=3.832,95%CI(2.212,6.640),P<0.001〕、以肉食为主〔OR=2.619,95%CI(1.536,4.465),P<0.001〕、吸烟史〔OR=1.912,95%CI(1.133,3.227),P=0.015〕、糖尿病史〔OR=2.544,95%CI(1.378,4.697),P=0.003〕、冠心病史〔OR=3.945,95%CI(1.110,14.016),P=0.034〕及视力下降史〔OR=2.846,95%CI(1.780,4.551),P<0.001〕是≥60岁人群MCI患病的危险因素。受教育程度初中〔OR=0.180,95%CI(0.103,0.314),P<0.001〕、高中及以上〔OR=0.075,95%CI(0.041,0.136),P<0.001〕是≥60岁人群MCI患病的保护因素。居住农村〔OR=5.511,95%CI(2.306,13.170),P<0.001〕、无配偶〔OR=2.987,95%CI(1.152,7.746),P=0.024〕、肥胖〔OR=7.303,95%CI(2.436,21.890),P<0.001〕、以素食为主〔OR=7.025,95%CI(3.626,13.609),P<0.001〕、以肉食为主〔OR=2.255,95%CI(1.102,4.616),P=0.026〕、每晚睡眠时长<6 h〔OR=2.164,95%CI(1.206,3.883),P=0.010〕、吸烟史〔OR=2.661,95%CI(1.415,5.004),P=0.002〕、糖尿病史〔OR=2.186,95%CI(1.033,4.624),P=0.041〕、冠心病史〔OR=6.830,95%CI(1.809,25.783),P=0.005〕及视力下降史〔OR=3.267,95%CI(1.785,5.979),P<0.001〕是≥60岁人群痴呆患病的危险因素。60~69岁〔OR=0.211,95%CI(0.074,0.597),P=0.003〕、70~79岁〔OR=0.218,95%CI(0.077,0.620),P=0.004〕、受教育程度初中〔OR=0.473,95%CI(0.229,0.977),P=0.043〕、高中及以上〔OR=0.227,95%CI(0.105,0.493),P<0.001〕是≥60岁人群痴呆患病的保护因素。
内蒙古自治区包头市≥60岁老年人的SCD、MCI、痴呆患病率处于全国较高水平,居住农村、高龄、无配偶、低受教育水平、肥胖、单纯以素食或肉食为主饮食、每晚睡眠时间<6 h、吸烟、糖尿病、冠心病、视力下降是该地区老年人SCD、MCI、痴呆患病的主要危险因素。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
随着中国人口老龄化进程的加快,痴呆的发病率正逐年增高,阿尔茨海默病(AD)是引起痴呆常见的病因之一,预计到2050年,我国由AD引起的痴呆患者将达到2 800万,给家庭和社会带来极大的负担[1]。鉴于目前痴呆尚无有效治愈手段且预后差,针对痴呆前期即轻度认知障碍(MCI)阶段尚无有效的药物治疗方法,因此越来越多的研究者把目光放在更早期阶段—痴呆临床前期[2]。主观认知下降(SCD)被认为是痴呆临床前期的指征[3],针对该阶段进行干预可能维持和提高认知功能[4]。因此,本研究调查了内蒙古自治区包头市老年人认知现状,明确SCD、MCI、痴呆的影响因素,从而为制定老年人健康干预措施提供理论依据。
于2021年6月—2022年9月,采用多阶段抽样、整群抽样、随机抽样相结合的方法,选择内蒙古自治区包头市的3个旗县区(昆都仑区、九原区、固阳县)随机抽取21个居委会、17个村委会开展横断面调查。纳入对象为居(村)委会年龄≥60岁、知情并同意参与本研究的常住居民。排除存在严重听力、视力、精神障碍等影响测查的疾病的患者。研究显示SCD的患病率为12.3%~46.5%,我国≥60岁人群MCI和痴呆的总体患病率分别为19.0%、6.0%[5,6,7],根据样本量计算公式n=z2α p(1-p)/δ2及10%失访率得出所需最大样本量,共纳入1 175例研究对象,其中1 120例研究对象完成本次调查,应答率为95.3%。本研究已通过内蒙古科技大学包头医学院第一附属医院伦理审批〔临研伦理第(2023001)号〕。
采用问卷调查法收集研究对象资料。问卷内容包括(1)一般资料:社会人口学变量(居住地、性别、年龄、民族、婚姻状况、受教育程度、BMI)、生活习惯〔饮食习惯、每晚睡眠时长、吸烟史(每天至少吸1支香烟,持续1年以上)、饮酒史(每周饮酒≥1次,连续1年以上)〕和既往史(高血压、糖尿病、冠心病、听力下降、视力下降);其中婚姻状况分为有配偶(已婚)和无配偶(未婚、离异、丧偶),BMI分级为体质量偏轻(<18.5 kg/m2)、体质量正常(18.5~23.9 kg/m2)、超重(24.0~27.9 kg/m2)、肥胖(≥28.0 kg/m2);(2)认知评估标准及方法:受试者均完成主观认知下降问卷(SCD-Q9)[8]、简易精神状态检查(MMSE)[9]、蒙特利尔认知评估(MoCA)[10]。对MMSE分值小学以下<17分、小学<20分、初中及以上<24分者进行日常生活功能量表(ADL)评估。
在正式调查前对所有调查员进行统一规范化培训,通过小范围预调查进行调查员考核及问卷质量评估,在充分听取专家意见、结合实际情况的基础上对问卷进行修改、完善,调查问卷结束后进行复查检阅,以避免漏填或错填。所有调查数据进行双录入,经一致性检验后上传。
(1)SCD:与以前正常状态相比,自我感觉持续的认知能力下降,且与急性事件无关;经年龄、性别和受教育程度校正后,标准认知测试正常,未达到MCI诊断标准。除外MCI、AD或症状表现由其他原因或疾病引起的认知能力下降,如严重精神障碍疾病、药物滥用等[3,11]。(2)MCI诊断参考Petersen标准[12]:①患者、知情人和/或临床医生报告或发现其存在认知损害;②存在至少1个不限于记忆的认知功能域损害的客观证据,本研究主要依据MMSE和MoCA得分;③保留独立的功能性能力,工具性能力可能轻微受损(由ADL评估);④未被诊断为痴呆。(3)痴呆诊断参考《2018中国痴呆与认知障碍诊治指南(一):痴呆及其分类诊断标准》[13]:对于既往智能正常,之后出现获得性认知功能下降(记忆、执行、语言或视空间能力损害)或精神行为异常,影响工作能力或日常生活,且无法用谵妄或其他精神疾病来解释的患者,可拟诊为痴呆;认知功能或精神行为损害可通过病史采集或神经心理评估客观证实,且至少具备以下5项中的2项:①记忆及学习能力受损;②推理、判断及处理复杂任务等执行功能受损;③视空间能力受损;④语言功能(听、说、读、写)受损;⑤人格、行为或举止改变。
依据认知功能将研究对象划分为正常组(n=206)、SCD组(n=491)、MCI组(n=320)、痴呆组(n=103)。
采用SPSS 20.0统计软件进行数据分析。不符合正态分布的计量资料以M(P25,P75)表示;计数资料以相对数表示,组间比较采用χ2检验。采用多因素Logistic回归分析探究研究对象认知功能状况的影响因素。以P<0.05为差异有统计学意义。
研究对象中位年龄68.0(63.0,73.0)岁,中位受教育年限9.0(5.0,11.4)年。SCD组和正常组研究对象居住地、婚姻状况、BMI分级、饮食习惯、每晚睡眠时长、吸烟史、糖尿病史、冠心病史、视力下降史比例比较,差异有统计学意义(P<0.05);MCI组和正常组研究对象居住地、婚姻状况、受教育程度、BMI分级、饮食习惯、每晚睡眠时长、吸烟史、糖尿病史、冠心病史、听力下降史、视力下降史比例比较,差异有统计学意义(P<0.05);痴呆组和正常组研究对象居住地、年龄、婚姻状况、受教育程度、BMI分级、饮食习惯、每晚睡眠时长、吸烟史、糖尿病史、冠心病史、听力下降史、视力下降史比例比较,差异有统计学意义(P<0.05),见表1,表2,表3。
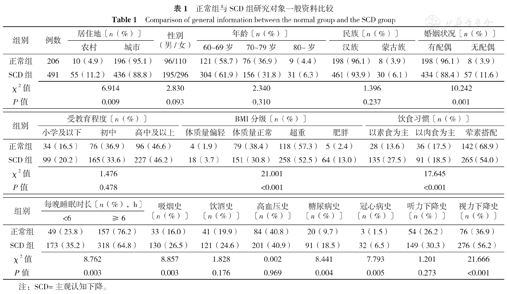
正常组与SCD组研究对象一般资料比较
Comparison of general information between the normal group and the SCD group
正常组与SCD组研究对象一般资料比较
Comparison of general information between the normal group and the SCD group
| 组别 | 例数 | 居住地〔n(%)〕 | 性别(男/女) | 年龄〔n(%)〕 | 民族〔n(%)〕 | 婚姻状况〔n(%)〕 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 农村 | 城市 | 60~69岁 | 70~79岁 | 80~岁 | 汉族 | 蒙古族 | 有配偶 | 无配偶 | |||
| 正常组 | 206 | 10(4.9) | 196(95.1) | 96/110 | 121(58.7) | 76(36.9) | 9(4.4) | 198(96.1) | 8(3.9) | 198(96.1) | 8(3.9) |
| SCD组 | 491 | 55(11.2) | 436(88.8) | 195/296 | 304(61.9) | 156(31.8) | 31(6.3) | 461(93.9) | 30(6.1) | 434(88.4) | 57(11.6) |
| χ2值 | 6.914 | 2.830 | 2.340 | 1.396 | 10.242 | ||||||
| P值 | 0.009 | 0.093 | 0.310 | 0.237 | 0.001 | ||||||
| 组别 | 受教育程度〔n(%)〕 | BMI分级〔n(%)〕 | 饮食习惯〔n(%)〕 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 小学及以下 | 初中 | 高中及以上 | 体质量偏轻 | 体质量正常 | 超重 | 肥胖 | 以素食为主 | 以肉食为主 | 荤素搭配 | |
| 正常组 | 34(16.5) | 76(36.9) | 96(46.6) | 4(1.9) | 79(38.4) | 118(57.3) | 5(2.4) | 28(13.6) | 36(17.5) | 142(68.9) |
| SCD组 | 99(20.2) | 165(33.6) | 227(46.2) | 18(3.7) | 151(30.8) | 258(52.5) | 64(13.0) | 135(27.5) | 91(18.5) | 265(54.0) |
| χ2值 | 1.476 | 21.001 | 17.645 | |||||||
| P值 | 0.478 | <0.001 | <0.001 | |||||||
| 组别 | 每晚睡眠时长〔n(%),h〕 | 吸烟史〔n(%)〕 | 饮酒史〔n(%)〕 | 高血压史〔n(%)〕 | 糖尿病史〔n(%)〕 | 冠心病史〔n(%)〕 | 听力下降史〔n(%)〕 | 视力下降史〔n(%)〕 | |
|---|---|---|---|---|---|---|---|---|---|
| <6 | ≥6 | ||||||||
| 正常组 | 49(23.8) | 157(76.2) | 33(16.0) | 41(19.9) | 84(40.8) | 20(9.7) | 3(1.5) | 54(26.2) | 76(36.9) |
| SCD组 | 173(35.2) | 318(64.8) | 130(26.5) | 121(24.6) | 201(40.9) | 91(18.5) | 32(6.5) | 149(30.3) | 276(56.2) |
| χ2值 | 8.762 | 8.857 | 1.828 | 0.002 | 8.441 | 7.793 | 1.201 | 21.666 | |
| P值 | 0.003 | 0.003 | 0.176 | 0.969 | 0.004 | 0.005 | 0.273 | <0.001 | |
注:SCD=主观认知下降。
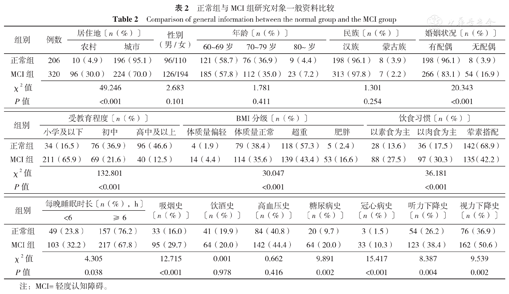
正常组与MCI组研究对象一般资料比较
Comparison of general information between the normal group and the MCI group
正常组与MCI组研究对象一般资料比较
Comparison of general information between the normal group and the MCI group
| 组别 | 例数 | 居住地〔n(%)〕 | 性别(男/女) | 年龄〔n(%)〕 | 民族〔n(%)〕 | 婚姻状况〔n(%)〕 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 农村 | 城市 | 60~69岁 | 70~79岁 | 80~岁 | 汉族 | 蒙古族 | 有配偶 | 无配偶 | |||
| 正常组 | 206 | 10(4.9) | 196(95.1) | 96/110 | 121(58.7) | 76(36.9) | 9(4.4) | 198(96.1) | 8(3.9) | 198(96.1) | 8(3.9) |
| MCI组 | 320 | 96(30.0) | 224(70.0) | 126/194 | 185(57.8) | 112(35.0) | 23(7.2) | 313(97.8) | 7(2.2) | 266(83.1) | 54(16.9) |
| χ2值 | 49.246 | 2.683 | 1.781 | 1.301 | 20.343 | ||||||
| P值 | <0.001 | 0.101 | 0.411 | 0.254 | <0.001 | ||||||
| 组别 | 受教育程度〔n(%)〕 | BMI分级〔n(%)〕 | 饮食习惯〔n(%)〕 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 小学及以下 | 初中 | 高中及以上 | 体质量偏轻 | 体质量正常 | 超重 | 肥胖 | 以素食为主 | 以肉食为主 | 荤素搭配 | |
| 正常组 | 34(16.5) | 76(36.9) | 96(46.6) | 4(1.9) | 79(38.4) | 118(57.3) | 5(2.4) | 28(13.6) | 36(17.5) | 142(68.9) |
| MCI组 | 211(65.9) | 69(21.6) | 40(12.5) | 14(4.4) | 114(35.6) | 139(43.4) | 53(16.6) | 88(27.5) | 97(30.3) | 135(42.2) |
| χ2值 | 132.801 | 30.047 | 36.181 | |||||||
| P值 | <0.001 | <0.001 | <0.001 | |||||||
| 组别 | 每晚睡眠时长〔n(%),h〕 | 吸烟史〔n(%)〕 | 饮酒史〔n(%)〕 | 高血压史〔n(%)〕 | 糖尿病史〔n(%)〕 | 冠心病史〔n(%)〕 | 听力下降史〔n(%)〕 | 视力下降史〔n(%)〕 | |
|---|---|---|---|---|---|---|---|---|---|
| <6 | ≥6 | ||||||||
| 正常组 | 49(23.8) | 157(76.2) | 33(16.0) | 41(19.9) | 84(40.8) | 20(9.7) | 3(1.5) | 54(26.2) | 76(36.9) |
| MCI组 | 103(32.2) | 217(67.8) | 95(29.7) | 64(20.0) | 142(44.4) | 64(20.0) | 33(10.3) | 123(38.4) | 162(50.6) |
| χ2值 | 4.305 | 12.715 | 0.001 | 0.662 | 9.891 | 15.417 | 8.387 | 9.539 | |
| P值 | 0.038 | <0.001 | 0.978 | 0.416 | 0.002 | <0.001 | 0.004 | 0.002 | |
注:MCI=轻度认知障碍。
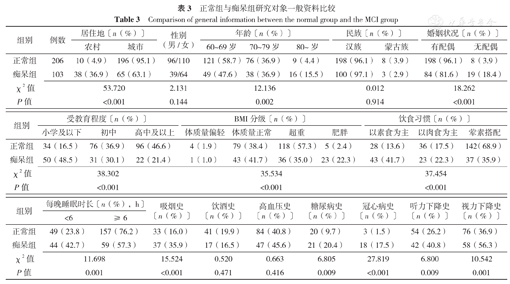
正常组与痴呆组研究对象一般资料比较
Comparison of general information between the normal group and the MCI group
正常组与痴呆组研究对象一般资料比较
Comparison of general information between the normal group and the MCI group
| 组别 | 例数 | 居住地〔n(%)〕 | 性别(男/女) | 年龄〔n(%)〕 | 民族〔n(%)〕 | 婚姻状况〔n(%)〕 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 农村 | 城市 | 60~69岁 | 70~79岁 | 80~岁 | 汉族 | 蒙古族 | 有配偶 | 无配偶 | |||
| 正常组 | 206 | 10(4.9) | 196(95.1) | 96/110 | 121(58.7) | 76(36.9) | 9(4.4) | 198(96.1) | 8(3.9) | 198(96.1) | 8(3.9) |
| 痴呆组 | 103 | 38(36.9) | 65(63.1) | 39/64 | 49(47.6) | 38(36.9) | 16(15.5) | 100(97.1) | 3(2.9) | 84(81.6) | 19(18.4) |
| χ2值 | 53.720 | 2.131 | 12.136 | 0.012 | 18.262 | ||||||
| P值 | <0.001 | 0.144 | 0.002 | 0.914 | <0.001 | ||||||
| 组别 | 受教育程度〔n(%)〕 | BMI分级〔n(%)〕 | 饮食习惯〔n(%)〕 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 小学及以下 | 初中 | 高中及以上 | 体质量偏轻 | 体质量正常 | 超重 | 肥胖 | 以素食为主 | 以肉食为主 | 荤素搭配 | |
| 正常组 | 34(16.5) | 76(36.9) | 96(46.6) | 4(1.9) | 79(38.4) | 118(57.3) | 5(2.4) | 28(13.6) | 36(17.5) | 142(68.9) |
| 痴呆组 | 50(48.5) | 31(30.1) | 22(21.4) | 1(1.0) | 43(41.7) | 36(35.0) | 23(22.3) | 43(41.7) | 23(22.3) | 37(35.9) |
| χ2值 | 38.302 | 35.534 | 37.454 | |||||||
| P值 | <0.001 | <0.001 | <0.001 | |||||||
| 组别 | 每晚睡眠时长〔n(%),h〕 | 吸烟史〔n(%)〕 | 饮酒史〔n(%)〕 | 高血压史〔n(%)〕 | 糖尿病史〔n(%)〕 | 冠心病史〔n(%)〕 | 听力下降史〔n(%)〕 | 视力下降史〔n(%)〕 | |
|---|---|---|---|---|---|---|---|---|---|
| <6 | ≥6 | ||||||||
| 正常组 | 49(23.8) | 157(76.2) | 33(16.0) | 41(19.9) | 84(40.8) | 20(9.7) | 3(1.5) | 54(26.2) | 76(36.9) |
| 痴呆组 | 44(42.7) | 59(57.3) | 37(35.9) | 17(16.5) | 47(45.6) | 21(20.4) | 18(17.5) | 42(40.8) | 58(56.3) |
| χ2值 | 11.698 | 15.524 | 0.520 | 0.663 | 6.805 | 27.819 | 6.800 | 10.542 | |
| P值 | 0.001 | <0.001 | 0.471 | 0.416 | 0.009 | <0.001 | 0.009 | 0.001 | |
以研究对象认知功能状况为因变量,以单因素分析有差异的变量为自变量进行多因素Logistic回归分析(各变量赋值情况见表4),结果显示无配偶〔OR=2.542,95%CI(1.139,5.674),P=0.023〕、肥胖〔OR=6.058,95%CI(2.281,16.093),P<0.001〕、以素食为主〔OR=3.037,95%CI(1.868,4.936),P<0.001〕、每晚睡眠时长<6 h〔OR=1.662,95%CI(1.099,2.516),P=0.016〕、吸烟史〔OR=1.971,95%CI(1.231,3.157),P=0.005〕、糖尿病史〔OR=1.975,95%CI(1.140,3.422),P=0.015〕、冠心病史〔OR=3.501,95%CI(1.016,12.062),P=0.047〕及视力下降史〔OR=2.454,95%CI(1.638,3.677),P<0.001〕是≥60岁人群SCD患病的危险因素。居住农村〔OR=2.636,95%CI(1.231,5.641),P=0.013〕、无配偶〔OR=2.843,95%CI(1.228,6.582),P=0.015〕、肥胖〔OR=5.626,95%CI(2.046,15.475),P=0.001〕、以素食为主〔OR=3.832,95%CI(2.212,6.640),P<0.001〕、以肉食为主〔OR=2.619,95%CI(1.536,4.465),P<0.001〕、吸烟史〔OR=1.912,95%CI(1.133,3.227),P=0.015〕、糖尿病史〔OR=2.544,95%CI(1.378,4.697),P=0.003〕、冠心病史〔OR=3.945,95%CI(1.110,14.016),P=0.034〕及视力下降史〔OR=2.846,95%CI(1.780,4.551),P<0.001〕是≥60岁人群MCI患病的危险因素,文化程度初中〔OR=0.180,95%CI(0.103,0.314),P<0.001〕、高中及以上〔OR=0.075,95%CI(0.041,0.136),P<0.001〕是≥60岁人群MCI的保护因素。居住农村〔OR=5.511,95%CI(2.306,13.170),P<0.001〕、无配偶〔OR=2.987,95%CI(1.152,7.746),P=0.024〕、肥胖〔OR=7.303,95%CI(2.436,21.890),P<0.001〕、以素食为主〔OR=7.025,95%CI(3.626,13.609),P<0.001〕、以肉食为主〔OR=2.255,95%CI(1.102,4.616),P=0.026〕、每晚睡眠时长<6 h〔OR=2.164,95%CI(1.206,3.883),P=0.010〕、吸烟史〔OR=2.661,95%CI(1.415,5.004),P=0.002〕、糖尿病史〔OR=2.186,95%CI(1.033,4.624),P=0.041〕、冠心病史〔OR=6.830,95%CI(1.809,25.783),P=0.005〕及视力下降史〔OR=3.267,95%CI(1.785,5.979),P<0.001〕是≥60岁人群痴呆患病的危险因素。60~69岁〔OR=0.211,95%CI(0.074,0.597),P=0.003〕、70~79岁〔OR=0.218,95%CI(0.077,0.620),P=0.004〕、文化程度初中〔OR=0.473,95%CI(0.229,0.977),P=0.043〕、高中及以上〔OR=0.227,95%CI(0.105,0.493),P<0.001〕是≥60岁人群痴呆患病的保护因素,见表5。

研究对象认知功能影响因素的多因素Logistic回归分析自变量赋值
Independent variable assignment of the multivariate Logistic regression analysis of influcncing factors of cognitive function of the study subjects
研究对象认知功能影响因素的多因素Logistic回归分析自变量赋值
Independent variable assignment of the multivariate Logistic regression analysis of influcncing factors of cognitive function of the study subjects
| 变量 | 赋值 |
|---|---|
| 居住地 | 1=农村,2=城市 |
| 年龄 | 1=60~69岁,2=70~79岁,3=80~岁 |
| 婚姻状况 | 0=无配偶,1=有配偶 |
| 受教育程度 | 1=高中及以上,2=初中,3=小学及以下 |
| BMI分级 | 1=体质量偏轻,2=超重,3=肥胖,4=体质量正常 |
| 饮食习惯 | 1=以素食为主,2=以肉食为主,3=荤素搭配 |
| 每晚睡眠时长 | 1=<6 h,2=≥6 h |
| 吸烟史 | 0=有,1=无 |
| 糖尿病史 | 0=有,1=无 |
| 冠心病史 | 0=有,1=无 |
| 听力下降史 | 0=有,1=无 |
| 视力下降史 | 0=有,1=无 |
| 认知功能状况 | 0=正常,1=SCD,2=MCI,3=痴呆 |
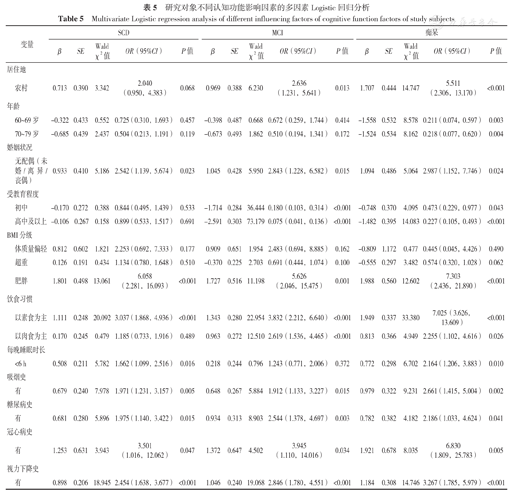
研究对象不同认知功能影响因素的多因素Logistic回归分析
Multivariate Logistic regression analysis of different influencing factors of cognitive function factors of study subjects
研究对象不同认知功能影响因素的多因素Logistic回归分析
Multivariate Logistic regression analysis of different influencing factors of cognitive function factors of study subjects
| 变量 | SCD | MCI | 痴呆 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| β | SE | Wald χ2值 | OR(95%CI) | P值 | β | SE | Wald χ2值 | OR(95%CI) | P值 | β | SE | Wald χ2值 | OR(95%CI) | P值 | |
| 居住地 | |||||||||||||||
| 农村 | 0.713 | 0.390 | 3.342 | 2.040 (0.950,4.383) | 0.068 | 0.969 | 0.388 | 6.230 | 2.636 (1.231,5.641) | 0.013 | 1.707 | 0.444 | 14.747 | 5.511 (2.306,13.170) | <0.001 |
| 年龄 | |||||||||||||||
| 60~69岁 | -0.322 | 0.433 | 0.552 | 0.725(0.310,1.693) | 0.457 | -0.398 | 0.487 | 0.668 | 0.672(0.259,1.744) | 0.414 | -1.558 | 0.532 | 8.578 | 0.211(0.074,0.597) | 0.003 |
| 70~79岁 | -0.685 | 0.439 | 2.437 | 0.504(0.213,1.191) | 0.119 | -0.673 | 0.493 | 1.862 | 0.510(0.194,1.341) | 0.172 | -1.524 | 0.534 | 8.162 | 0.218(0.077,0.620) | 0.004 |
| 婚姻状况 | |||||||||||||||
| 无配偶(未婚/离异/丧偶) | 0.933 | 0.410 | 5.186 | 2.542(1.139,5.674) | 0.023 | 1.045 | 0.428 | 5.950 | 2.843(1.228,6.582) | 0.015 | 1.094 | 0.486 | 5.064 | 2.987(1.152,7.746) | 0.024 |
| 受教育程度 | |||||||||||||||
| 初中 | -0.170 | 0.272 | 0.388 | 0.844(0.495,1.439) | 0.533 | -1.714 | 0.284 | 36.444 | 0.180(0.103,0.314) | <0.001 | -0.748 | 0.370 | 4.095 | 0.473(0.229,0.977) | 0.043 |
| 高中及以上 | -0.106 | 0.267 | 0.158 | 0.899(0.533,1.517) | 0.691 | -2.591 | 0.303 | 73.179 | 0.075(0.041,0.136) | <0.001 | -1.482 | 0.395 | 14.083 | 0.227(0.105,0.493) | <0.001 |
| BMI分级 | |||||||||||||||
| 体质量偏轻 | 0.812 | 0.602 | 1.821 | 2.253(0.692,7.333) | 0.177 | 0.909 | 0.651 | 1.954 | 2.483(0.694,8.885) | 0.162 | -0.809 | 1.172 | 0.477 | 0.445(0.045,4.426) | 0.490 |
| 超重 | 0.126 | 0.191 | 0.434 | 1.134(0.780,1.648) | 0.510 | -0.370 | 0.225 | 2.703 | 0.691(0.444,1.074) | 0.100 | -0.555 | 0.297 | 3.482 | 0.574(0.320,1.028) | 0.062 |
| 肥胖 | 1.801 | 0.498 | 13.061 | 6.058 (2.281,16.093) | <0.001 | 1.727 | 0.516 | 11.198 | 5.626 (2.046,15.475) | 0.001 | 1.988 | 0.560 | 12.602 | 7.303 (2.436,21.890) | <0.001 |
| 饮食习惯 | |||||||||||||||
| 以素食为主 | 1.111 | 0.248 | 20.092 | 3.037(1.868,4.936) | <0.001 | 1.343 | 0.280 | 22.954 | 3.832(2.212,6.640) | <0.001 | 1.949 | 0.337 | 33.380 | 7.025(3.626,13.609) | <0.001 |
| 以肉食为主 | 0.170 | 0.245 | 0.479 | 1.185(0.733,1.916) | 0.489 | 0.963 | 0.272 | 12.510 | 2.619(1.536,4.465) | <0.001 | 0.813 | 0.366 | 4.949 | 2.255(1.102,4.616) | 0.026 |
| 每晚睡眠时长 | |||||||||||||||
| <6 h | 0.508 | 0.211 | 5.782 | 1.662(1.099,2.516) | 0.016 | 0.218 | 0.244 | 0.796 | 1.243(0.771,2.006) | 0.372 | 0.772 | 0.298 | 6.702 | 2.164(1.206,3.883) | 0.010 |
| 吸烟史 | |||||||||||||||
| 有 | 0.679 | 0.240 | 7.978 | 1.971(1.231,3.157) | 0.005 | 0.648 | 0.267 | 5.884 | 1.912(1.133,3.227) | 0.015 | 0.979 | 0.322 | 9.231 | 2.661(1.415,5.004) | 0.002 |
| 糖尿病史 | |||||||||||||||
| 有 | 0.681 | 0.280 | 5.896 | 1.975(1.140,3.422) | 0.015 | 0.934 | 0.313 | 8.903 | 2.544(1.378,4.697) | 0.003 | 0.782 | 0.382 | 4.182 | 2.186(1.033,4.624) | 0.041 |
| 冠心病史 | |||||||||||||||
| 有 | 1.253 | 0.631 | 3.943 | 3.501 (1.016,12.062) | 0.047 | 1.372 | 0.647 | 4.502 | 3.945 (1.110,14.016) | 0.034 | 1.921 | 0.678 | 8.035 | 6.830 (1.809,25.783) | 0.005 |
| 视力下降史 | |||||||||||||||
| 有 | 0.898 | 0.206 | 18.945 | 2.454(1.638,3.677) | <0.001 | 1.046 | 0.240 | 19.068 | 2.846(1.780,4.551) | <0.001 | 1.184 | 0.308 | 14.746 | 3.267(1.785,5.979) | <0.001 |
老年痴呆是一个全球性人类健康问题。本研究结果显示,60岁及以上老年人SCD患病率为43.8%,高于国内HAO等[14]的研究结果。本研究MCI及痴呆的患病率分别为28.6%、9.2%,高于全国平均水平[6]。考虑与包头地区独特的地理环境、多元文化、饮食习惯有关。
积极干预引起痴呆的可控制危险因素是降低痴呆患病率的有效途径[7]。本研究发现,与正常组相比,SCD、MCI组和痴呆组有相似的危险因素,包括无配偶、肥胖、吸烟史、糖尿病史、冠心病史、视力下降史等。作为AD或其他痴呆临床前期的MCI患者,尤其是被认为可能处于AD超早期阶段的SCD患者[11],其认知功能仍然存在可塑性[15]。因此,探讨其发生的影响因素,并进行有针对性的预防和干预,对缓解或阻止痴呆的发展进程、减轻家庭及社会的巨大负担有重要意义。
在我国农村地区MCI、痴呆患病率更高[7],且高龄已被多项研究证实是痴呆的危险因素[16],本研究结果与之一致。本研究结果显示无配偶是SCD、MCI、痴呆的危险因素,与既往研究结论一致[7],这可能与社会和情感支持不足导致老年人处于孤独状态,焦虑、抑郁等负面情绪产生增加,使脑细胞长期处于非活跃的不良状态,从而降低认知功能有关[17]。文化程度在SCD中的作用尚存在争论[18],本研究未观察到其对SCD的调节作用,ZAHODNE等[19]的研究亦有类似发现。而较高的教育水平是MCI及痴呆的保护因素[6],本研究与之结果一致,这可能与受教育程度年限较长的人有着更高的认知储备和更发达的神经元网络,从而保护认知功能有关[20]。BMI与老年人认知功能有显著相关性,但结论不一致[21]。本研究结果显示肥胖会增加SCD、MCI、痴呆的患病风险,同BENITO-LEÓN等[22]的研究结果一致。可能与肥胖通过胰岛素抵抗、慢性炎症以及影响血管内皮功能和破坏血-脑脊液屏障等途径增加认知功能障碍的发病风险有关[23]。
本研究发现,生活方式对认知功能的改变有影响。认知功能下降可能与高脂肪、高蛋白、低碳水化合物的饮食模式有关,素食主义可能会增加高龄老年人认知障碍的患病风险[24]。与本研究饮食单纯以素或肉食为主的老年人患SCD、MCI及痴呆风险更高的结果一致,提示应合理均衡饮食。流行病学研究表明,睡眠时长会影响认知功能,表现为睡眠时间过短[25]或过长[26]可能增加老年人认知障碍的风险,或两者呈倒U形关系[27],但也有研究结果显示两者无关联[28]。研究结果的差异可能与研究对象的纳入标准、对睡眠时长的评价和分类、混杂因素的调整等不同有关。与KEAGE等[25]的研究结果一致,本研究结果显示老年人平均每晚睡眠时长<6 h是SCD及痴呆的危险因素,考虑与睡眠不足可能会导致大脑中代谢物β-淀粉样蛋白沉积有关[29]。本研究发现有吸烟史老年人患SCD、MCI及痴呆的风险均增高,这与既往大多数研究结果一致[30],考虑与吸烟通过释放自由基和其他氧化物质引起氧化应激和炎症反应,从而损伤认知功能有关[31]。本研究证实糖尿病、冠心病是SCD、MCI及痴呆的危险因素[32,33]。有关视力与认知功能关系的研究结论尚有争议,本研究结果显示视力下降老年人患SCD、MCI及痴呆的风险增高,与ZHENG等[34]的研究结果相一致,可能的机制为视觉障碍通过影响老年人参与社会活动来影响认知功能,视力障碍会降低老年人参与有助于维持健康的活动的能力,并导致大脑刺激减少,这可能成为认知功能下降的风险因素。
综上所述,包头地区SCD、MCI及痴呆的患病率较高,老年人中居住于农村、年龄≥80岁、无配偶、较低的文化程度、肥胖、单纯以素食或肉食为主的饮食模式、每晚睡眠时长<6 h、吸烟、糖尿病、冠心病、视力下降患者发生认知功能障碍的风险增加,对该重点人群采取针对性干预措施,从而预防或延缓不良结局的发生。
本研究存在一定不足,本研究为横断面调查,无法进行研究因素与认知功能的因果关系推断,以后还需进一步开展前瞻性队列研究来分析认知功能的影响因素、动态观察SCD、MCI的转归情况。
禹延雪,白茹玉,于文龙,等. ≥60岁人群认知功能障碍发生现状及影响因素研究[J].中国全科医学,2023,26(21):2581-2588. DOI:10.12114/j.issn.1007-9572.2023.0004. [www.chinagp.net]
YU Y X,BAI R Y,YU W L,et al. Occurrence status and influencing factors of cognitive dysfunction in population aged 60 and above[J]. Chinese General Practice,2023,26(21):2581-2588.
本文无利益冲突。































