
5-羟色胺是影响腹泻型肠易激综合征患者胃肠道功能活动的重要脑肠肽。近年来研究发现5-羟色胺的合成、释放、与受体结合及重摄取等信号传导过程中,任一环节发生异常均有可能导致腹泻型肠易激综合征的发生。通过查阅国内外大量文献,发现中医药通过调节5-羟色胺治疗腹泻型肠易激综合征疗效显著。因此,本文对5-羟色胺的现代医学认识、5-羟色胺与腹泻型肠易激综合征的相关性及中医药干预5-羟色胺治疗腹泻型肠易激综合征的研究进展等进行综述,以期探索5-羟色胺在腹泻型肠易激综合征中的潜在治疗价值,同时也为中医药防治腹泻型肠易激综合征提供理论参考及依据。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
肠易激综合征(irritable bowel syndrome,IBS)是临床上常见的功能性胃肠病,依照罗马Ⅳ标准,可将其分为4种亚型,我国以腹泻型IBS(diarrheapredominant IBS,IBS-D)最多见[1]。近年来关于5-羟色胺(5-hydroxytryptamine,5-HT)参与IBS-D的研究逐渐增多,发现5-HT是参与调节胃肠运动和分泌功能的重要神经递质,主要通过影响内脏敏感性、肠道免疫、肠道动力、精神心理等引起肠平滑肌运动紊乱和水代谢紊乱,从而引起IBS-D患者腹痛、腹泻等临床症状的发生和排便习惯的改变[2]。中医药干预具有多成分、多靶点、多途径等优势,其治疗IBS-D疗效确切、不良反应少。近年来中医药调控5-HT治疗IBS-D是热点研究方向,因此深入研究中医药调控5-HT治疗IBS-D的诊疗措施对于临床工作具有重要意义[3]。笔者通过综述中医药调控5-HT治疗IBS-D的研究进展,以期为中医药治疗IBS-D提供研究思路与科学依据。
计算机检索PubMed、Web of Science、中国知网数据库的相关文献,检索时间设定为2011年6月—2022年2月,中文检索词包括"腹泻型肠易激综合征;5羟色胺;跨膜转运蛋白;肠嗜铬细胞;5羟色胺受体;内脏敏感性;肠道免疫;肠道动力;精神心理;中医药";英文检索词包括"Diarrheal irritable bowel syndrome;5-HT;SERT;EC;5-HT receptor;Visceral sensitivity;Intestinal immunity;Intestinal motility;Mental psychology;Traditional Chinese medicine";纳入标准:纳入现代医学、发生机制、中医药用药(临床、动物实验)等;对与本文主题密切相关的相关文献,在文献发表时间方面,适当予以放宽,但主要以近5年文献为主。排除标准:与研究问题无关、数据信息少、重复发表、无法获得全文或质量差的文献。
5-HT是一种吲哚衍生物,最早在血清中发现。约95%的5-HT分布在肠道内,其中90%是由肠嗜铬细胞(EC)合成和分泌,其可以调节肠道神经系统的发育、肠道运动、分泌和炎性反应等[4]。色氨酸是合成5-HT的底物,在色氨酸羟化酶(tryptophan hydroxylase,TPH)的催化作用下生成5-羟色氨酸,再在5-羟色氨酸脱羧酶作用下生成5-HT,储存于囊泡内[5,6]。当胃肠道受到刺激时,EC释放的5-HT或直接参与脑肠轴上异常化学信号的调节,或与肠黏膜上皮、黏膜下层或肌间神经丛中的5-HT受体(5-HT receptors,5-HTR)结合,进一步影响胃肠运动和内脏敏感性[7]。与相应受体结合后,5-HT迅速解离,并被跨膜转运蛋白(transmembrane transporters,SERT)重新摄取到细胞中,终止其对胃肠道的作用,见图1。研究发现,5-HT的合成、释放、与受体结合及重摄取等信号传导过程中,任一环节发生异常均有可能导致内脏高敏感的产生、肠道免疫的破坏、肠道菌群的紊乱、肠道动力的异常及精神心理的变化[8]。
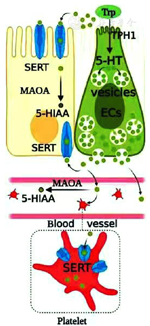

注:Trp=色氨酸,TPH=色氨酸羟化酶,SERT=跨膜转运蛋白,5-HT=5-羟色胺,MAOA=单氨酸氧化酶A,5-HIAA=5-羟吲哚乙酸,Vesicles=囊泡,ECs=肠嗜铬细胞,Blood=血液,vessel=血管,platelat=血小板。
EC由富含分泌颗粒的肠上皮基底干细胞分化而来,通过肠腔和循环系统的感应信号合成和分泌5-HT[9]。EC通过肠道脑回路与神经元建立直接突触连接,感知胃肠道吸收的食物及相关化学因子,调节胃肠道对营养物质的吸收,参与肠道免疫调节[10]。肠道EC表面有多种神经递质受体,当结肠内压力增加时EC功能活跃,释放5-HT等神经递质,这些递质作用于相应的受体,并将信号传输到肠肌间神经丛,以调节胃肠蠕动反射。同时EC能够激活黏膜下传入神经纤维,通过肠神经系统调节局部的兴奋和抑制[11]。TPH是触发5-HT合成的关键酶,可通过其生理活性和表达水平调控5-HT的合成,进一步参与调节胃肠各种生理活动[12,13]。TPH分为两种亚型:TPH-1和TPH-2。TPH-1表达量与调节肠道信号通路的5-HT含量有关联;TPH-2在某些特定的神经细胞中表达[14]。
SERT作为5-HT转运蛋白,主要分布于肠黏膜、肌间神经丛和边缘系统的神经元膜,对5-HT具有高选择性亲和力,并在调节其受体持续时间和信号空间分布中发挥重要作用。SERT不是肠道中唯一的5-HT转运体,有机阳离子转运体、多巴胺转运体和其他选择性转运体平行于SERT在肠道内分布和表达[15,16,17]。当5-HT作用于胃肠黏膜后,SERT利用Na+-K+-ATP酶产生的Na+浓度梯度差从突触间隙重新摄取5-HT到突触前神经元,通过SERT转运到周围的肠细胞,被单胺氧化酶降解为5-羟基吲哚乙醛,进一步转化为5-羟基吲哚乙酸,随尿液排泄[18,19,20]。同时SERT是影响局部5-HT浓度及其生物活性的重要物质。选择性5-HT再摄取抑制剂可增加突触间隙中的5-HT水平,因此SERT可能在内脏超敏反应的发生中起重要作用[21]。
SERT基因具有两个多态性位点,一个是启动子区的44bp核苷酸序列的插入/缺失,形成长型(L)和短型(S)两种等位基因片段,构成L/L、L/S、S/S 3种等位基因类型。另一个多态位点是SERT基因内含子2的17bp重复序列。SERT基因多态性的SS基因型和S等位基因频率与IBS-D的发病显著相关,但与临床症状无明显相关性[22,23]。
5-HT通过与不同受体相互作用,调节胃肠道的感觉及运动功能。5-HTR超家族主要有7种:5-HT 1~7R,在肠道炎症条件下,5-HT通过与不同的受体结合,对肠道产生抗炎和促炎作用。其中5-HT1-4R和5-HT7R在胃肠道表达,以5-HT3R和5-HT4R参与胃肠道的研究最为广泛[24]。
5-HT3R是一个五聚体复合体,也是众多5-HTR中唯一的配体门控离子通道型受体。据报道5-HT3R共有5种亚型:5-HT3A~ER[25]。激活5-HT3R可产生一系列效应:增加细胞内Ca2+水平、调节中枢和外周神经元的兴奋性、促进神经递质的释放、增加乙酰胆碱(acetylcholine,ACh)的释放、引起内脏敏感和腹部不适等一系列胃肠道异常[26]。动物实验已证明5-HT3R拮抗剂能抑制非选择性阳离子通道的激活,并在体外以剂量依赖性的方式阻断5-HT3R介导的肠黏膜下神经元的去极化等效应,增加肠道顺应性,提高痛阈水平,增加小肠对水和电解质的吸收,有效缓解腹胀和腹痛等胃肠道症状[27,28]。5-HT4R是一种G蛋白偶联亲代谢性受体,通过开放电压敏感性钙通道激活,激发在胃肠道运动和感觉方面发挥作用的其他神经递质释放,影响胃肠道动力及内脏感觉。5-HT4R在不同组织中存在表达及效应差异:位于结肠上皮5-HT4R在维持黏膜完整性方面发挥着重要作用[29];在肌层中发挥有益的神经源性作用,可促进神经元生长和存活[30]。
内脏高敏感性是IBS-D的病理生理基础。5-HT影响内脏敏感性基于其调节胃肠分泌和蠕动的作用,其作用机制可能与干预5-HT与受体结合有关。初级传入神经元上的5-HTR可激活腺苷酸环化酶,使肠道平滑肌紧张收缩和舒张,内脏传入神经元连接脊髓背角神经元突触,激活多种神经活性物质,降低对疼痛的耐受度[31]。当胃肠道受刺激时,EC释放5-HT,肠道5-HT阳性神经纤维或神经元的表达增强,导致内脏传入神经和肠神经系统的多种神经活性物质被激活,引起内脏敏感性增强,出现胃肠道不适[32]。SERT表达异常时,导致重摄取5-HT降低,造成内脏感觉异常,出现腹痛、腹泻等胃肠道功能异常症状,因此大多数SERT基因敲除的大鼠会交替出现腹泻和便秘[33,34]。在中枢,P物质(substancep,SP)作为兴奋性递质,参与疼痛信息传递并且产生疼痛、诱导释放5-HT,引起内脏高敏感性[35]。另外,丁酸是肠道菌群代谢产物的一种,通过增加肠道内5-HT水平及促进神经生长因子的表达,激活5-HT3R,诱导IBS-D患者的内脏高敏感性而出现大便性状的改变[36,37,38]。
5-HT在IBS-D患者肠道免疫调中发挥着重要作用。树突状细胞、B细胞可以迅速摄取并储存微环境中存在的5-HT;5-HT也能显著促进自然杀伤(NK)细胞的杀伤作用,但具体机制尚不清楚[39]。B细胞、T细胞、树突状细胞、巨噬细胞上存在许多5-HTR。当胃肠道受刺激时,肠道黏膜屏障受损,影响免疫细胞的功能,刺激分泌肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白介素(interleukin,IL)6、IL-9等炎性因子,大量炎性因子浸润损害肠黏膜,引起腹痛、腹泻等胃肠症状[40]。既往研究表明,Th1或Th2介导炎性细胞因子如TNF-α和IL-10的水平,在Th1/Th2平衡和CD4+ T淋巴细胞扩增中起重要作用,5-HT通过结合5-HT4R和5-HT7R,影响树突状细胞中细胞因子的分泌并增加Th2细胞的生成,促进树突状细胞产生适应性免疫反应[41]。一些学者发现,EC细胞增生被认为与CD4+ T淋巴细胞密切相关,尤其是Th1/Th2平衡。EC可以通过调节胃肠运动和分泌活动,影响巨噬细胞的极化和吞噬功能,从而改善免疫功能[7]。进一步研究发现EC细胞可以感应到IL-33等炎症细胞的表达,IL-33通过特异性在EC细胞中的非典型信号通路触发钙内流,从而诱导5-HT的释放[42]。
IBS-D胃肠动力调节机制复杂,5-HT是肠道中广泛存在的关键动力调控分子。研究表明促肾上腺皮质激素释放因子和5-HT通路在调节结肠运动过程中存在相互作用[43]。束缚应激或中枢注射促肾上腺皮质激素释放因子可刺激胆碱能神经,调节结肠壁张力,并促进EC释放5-HT,释放的5-HT刺激内在初级传入神经元,使其在肌间神经丛中与上下行中间神经元形成突触,从而调节局部的兴奋与抑制,调节胃肠动力[44];5-HT也可以直接作用于肠神经元及肌细胞等效应器发挥作用,能通过增加神经效应接头处胆碱类递质ACh的释放刺激结肠收缩[45]。当SERT受到抑制或敲除时,5-HT再摄取与失活受到抑制,肠道蠕动反射活动初期增强;随着5-HT受体敏感性逐渐降低,肠道动力受到抑制。因此SERT的表达与转录异常可能是IBS-D患者肠道运动、分泌功能和感觉异常的原因之一[46]。胃肠道感觉和运动关系最为密切的受体是5-HT3R,5-HT3R可同时调节兴奋性和抑制性神经传导物质的传递。5-HT与5-HT3R结合,可增加细胞内Ca2+水平并刺激中枢和外周神经元的兴奋性,促进神经递质的释放,引起ACh增多[47]。另外SP为胃肠道和运动神经元兴奋递质,其含量在胃肠道和中枢神经系统中最多,是连接中枢神经系统和消化系统的重要传导分子,可以刺激平滑肌兴奋,促进胃肠道蠕动,促进腺体和肠道水分泌[48]。因此5-HT和SP均具有促进胃肠运动,促进液体分泌作用。
随着对疾病的认识,精神、心理因素在IBS-D中的作用越来越受到人们的重视。循证医学证据显示50%~90%的IBS-D患者多伴随一系列精神心理问题,包括焦虑、抑郁、精神状态躯体化等[49]。5-HT广泛存在于大脑及肠道,与精神类疾病密切相关,参与脑肠功能异常的调节。作用于大脑边缘系统的5-HT3R,可使IBS-D患者产生焦虑及抑郁。一项同卵双生研究结果提示在5-HT3AR及5-HT3BR的染色体部分存在着感受态基因,这些基因可以引起抑郁及精神分裂[50]。5-HT3R拮抗剂可使大脑负责情感运动的区域血流减少[51]。TPH-1作为一些精神系统疾病如焦虑、抑郁、自杀的候补基因受到较多关注[52]。SERT表达水平与IBS-D患者的心理密切相关,SERT蛋白表达越低,越容易患焦虑和抑郁[53,54]。可能存在共同的因素导致中枢神经系统和肠肌神经丛内的发挥脑肠调节的5-HT数量减少、有效浓度下降,使IBS-D患者同时出现精神症状和肠道腹泻症状[55]。临床上常应用选择性5-HT再摄取抑制剂治疗存在精神心理障碍的IBS-D患者。
中医药通过作用于5-HT影响脑肠表达,改善IBS-D患者内脏敏感性、肠道免疫、肠道分泌及肠道动力治疗IBS-D,具有多成分、多效应、多靶点的干预优势,疗效确切,不良反应少。现将中医药干预5-HT治疗IBS-D的动物实验研究及临床研究总结如下,见表1、表2[56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75]。
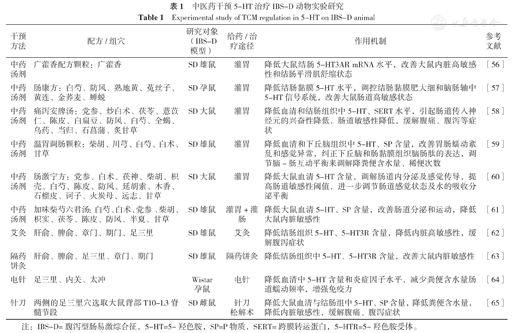
中医药干预5-HT治疗IBS-D动物实验研究
Experimental study of TCM regulation in 5-HT on IBS-D animal
中医药干预5-HT治疗IBS-D动物实验研究
Experimental study of TCM regulation in 5-HT on IBS-D animal
| 干预方法 | 配方/组穴 | 研究对象(IBS-D模型) | 给药/治疗途径 | 作用机制 | 参考文献 |
|---|---|---|---|---|---|
| 中药汤剂 | 广藿香配方颗粒:广藿香 | SD雄鼠 | 灌胃 | 降低大鼠结肠5-HT3AR mRNA水平,改善大鼠内脏高敏感性和结肠平滑肌舒缩状态 | [56] |
| 中药汤剂 | 肠康方:白芍、防风、熟地黄、菟丝子、黄连、金荞麦、蝉蜕 | SD孕鼠 | 灌胃 | 降低结肠黏膜5-HT水平,调控结肠黏膜肥大细和脑肠轴中5-HT信号系统,改善大鼠肠道高敏感状态 | [57] |
| 中药汤剂 | 痛泻安脾汤:党参、炒白术、茯苓、薏苡仁、陈皮、白扁豆、防风、白芍、全蝎、乌药、当归、石菖蒲、炙甘草 | SD大鼠 | 灌胃 | 降低血清和结肠组织中5-HT、SERT水平,引起肠道传入神经元的兴奋性降低,肠道敏感性降低,缓解腹痛、腹泻等症状 | [58] |
| 中药汤剂 | 温胃调肠颗粒:柴胡、川芎、白芍、白术、甘草 | SD雄鼠 | 灌胃 | 降低血清和下丘脑组织中5-HT、SP含量,改善胃肠蠕动紊乱和感觉异常,纠正下丘脑和肠黏膜组织脑肠肽的表达,调节脑-肠互动平衡来调解降粪便含水量、稀便次数 | [59] |
| 中药汤剂 | 肠激宁方:党参、白术、茯神、柴胡、枳壳、白芍、陈皮、防风、延胡索、木香、石榴皮、诃子、火炭母、远志、甘草 | SD大鼠 | 灌胃 | 降低大鼠血清5-HT含量,调解肠道内分泌及感觉传导,提高肠道敏感性阈值,进一步调节肠道感觉状态及水的吸收分泌平衡 | [60] |
| 中药汤剂 | 加味柴芍六君汤:白芍、白术、党参、柴胡、枳实、茯苓、陈皮、防风、半夏、甘草 | SD雄鼠 | 灌胃+灌肠 | 降低大鼠血清5-HT、SP含量,改善肠道分泌和运动,降低大鼠内脏敏感性 | [61] |
| 艾灸 | 肝俞、脾俞、章门、期门、足三里 | SD雄鼠 | 艾灸 | 降低结肠组织5-HT、5-HT3R含量,降低内脏高敏感性,缓解腹泻症状 | [62] |
| 隔药饼灸 | 肝俞、脾俞、足三里、章门、期门 | SD雄鼠 | 隔药饼灸 | 降低结肠组织中5-HT、5-HT3R含量,改善大鼠内脏敏感性 | [63] |
| 电针 | 足三里、内关、太冲 | Wistar孕鼠 | 电针 | 降低血清中5-HT含量和炎症因子水平,减少粪便含水量肠道蠕动频率,增强免疫力 | [64] |
| 针刀 | 两侧的足三里穴选取大鼠背部T10-L3脊髓节段 | SD雌鼠 | 针刀松解术 | 降低大鼠血清与结肠组中5-HT、SP含量,降低粪便含水量,降低内脏敏感性,缓解腹痛、腹泻症状 | [65] |
注:IBS-D=腹泻型肠易激综合征,5-HT=5-羟色胺,SP=P物质,SERT=跨膜转运蛋白,5-HTR=5-羟色胺受体。
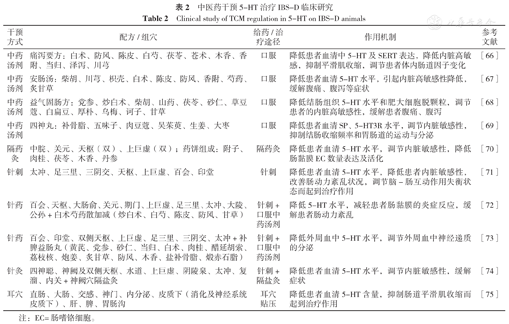
中医药干预5-HT治疗IBS-D临床研究
Clinical study of TCM regulation in 5-HT on IBS-D animals
中医药干预5-HT治疗IBS-D临床研究
Clinical study of TCM regulation in 5-HT on IBS-D animals
| 干预方式 | 配方/组穴 | 给药/治疗途径 | 作用机制 | 参考文献 |
|---|---|---|---|---|
| 中药汤剂 | 痛泻要方:白术、防风、陈皮、白芍、茯苓、苍术、木香、香附、当归、泽泻、川芎 | 口服 | 降低患者血清中5-HT及SERT表达,降低内脏高敏感,抑制平滑肌收缩,调节患者体内肠道因子变化 | [66] |
| 中药汤剂 | 安肠汤:柴胡、川芎、枳壳、白术、陈皮、防风、香附、芍药、炙甘草 | 口服 | 降低患者血清5-HT水平,引起内脏高敏感性降低,缓解腹痛、腹泻等症状 | [67] |
| 中药汤剂 | 益气固肠方:党参、炒白术、柴胡、山药、茯苓、砂仁、草豆蔻、白扁豆、厚朴、乌梅、诃子、甘草 | 口服 | 降低结肠组织5-HT水平和肥大细胞脱颗粒,调节患者的内脏高敏感性,缓解患者腹痛、腹泻 | [68] |
| 中药汤剂 | 四神丸:补骨脂、五味子、肉豆蔻、吴茱萸、生姜、大枣 | 口服 | 降低患者血清SP、5-HT3R水平,调节内脏敏感性,抑制结肠收缩频率和胃肠道的运动与分泌 | [69] |
| 隔药灸 | 中脘、关元、天枢(双)、上巨虚(双);药饼组成:附子、肉桂、茯苓、木香、丹参 | 隔药灸 | 降低患者血清5-HT水平,调节内脏敏感性,降低肠黏膜EC数量表达及活化 | [70] |
| 针刺 | 太冲、足三里、三阴交、天枢、上巨虚、百会、印堂 | 针刺 | 降低患者血清5-HT水平,降低患者内脏敏感性,改善肠动力紊乱状况,调节脑-肠互动作用失衡状态而起到治疗作用 | [71] |
| 针药 | 百会、天枢、大肠俞、关元、期门、上巨虚、足三里、太冲、大陵、公孙+白术芍药散加减(炒白术、白芍、陈皮、防风、甘草) | 针刺+口服中药汤剂 | 降低5-HT水平,减轻患者肠黏膜的炎症反应,缓解患者肠动力紊乱 | [72] |
| 针药 | 百会、印堂、双侧天枢、上巨虚、足三里、三阴交、太冲+补脾益肠丸(黄芪、党参、砂仁、当归、白术、肉桂、醋延胡索、荔枝核、炮姜、炙甘草、防风、木香、盐补骨脂、煅赤石脂) | 针刺+口服中药汤剂 | 降低外周血中5-HT水平,调节外周血中神经递质的分泌 | [73] |
| 针灸 | 四神聪、神阙及双侧天枢、水道、上巨虚、阴陵泉、太冲、复溜、内关+神阙穴隔盐灸 | 针刺+隔盐灸 | 降低患者血清5-HT水平,调节内脏敏感性,缓解症状 | [74] |
| 耳穴 | 直肠、大肠、交感、神门、内分泌、皮质下(消化及神经系统皮质下)、肝、脾、胃肠沟 | 耳穴贴压 | 降低患者血清5-HT含量,抑制肠道平滑肌收缩而起到治疗作用 | [75] |
注:EC=肠嗜铬细胞。
中医药调控5-HT治疗IBS-D的动物实验研究主要方法为通过中药灌胃、灌肠、电针、艾灸、隔药饼灸、针刀松解术等途径调节机体5-HT水平,改善胃肠蠕动紊乱、感觉异常及内脏高敏感性,纠正下丘脑和肠黏膜组织脑肠肽的表达,调节脑-肠互动平衡来降低粪便含水量、稀便次数,缓解腹痛、腹泻症状。选方用药以健脾和胃疏肝为主、选穴以足三里、脾俞、肝俞、章门、期门等脾经、胃经、肝经穴位为主。临床研究主要通过中药口服、针灸、针药联合以及耳穴等途径调节血清5-HT和炎症因子水平,降低内脏高敏感,抑制平滑肌收缩,调节患者体内肠道因子变化。选方用药较实验研究有所不同,用药以健脾疏肝、补肾益气为主,选穴除足三里、上巨虚、三阴交等脾胃经穴位外,多配以中脘、关元、天枢等近部取穴和百会、印堂等任、督脉穴位。总体来讲,中医药能够降低IBS-D大鼠或患者血清及结肠组织中5-HT、SERT含量,进而改善内脏敏感性、腹痛腹泻症状及大便性状。
随着社会的不断发展,人们所面临的精神心理压力逐渐上升,压力应激以及各种精神因素与IBS-D的相关性逐渐突显,5-HT作为重要脑肠肽对IBS-D的影响逐渐成为近年来研究的热点。5-HT通过与特异性受体结合调节胃肠活动,同时能够参与如认知、学习、记忆、情绪、睡眠障碍等一系列机体生理病理过程。随着中医药多措施、多成分、多效应、多靶点及通路协调作用的干预优势被逐渐阐释,发现其调节5-HT治疗IBS-D的机制可作为本病的治疗新靶点,在IBS-D的防治方面具有广阔的应用前景。中医药能够通过调节与脑-肠轴和胃肠功能有关的传入和传出通路,调节5-HT等脑肠肽水平,改善脑-肠互动异常,调节内脏敏感性,改善胃肠蠕动紊乱和感觉异常,有效改善IBS-D症状。目前研究多集中于某一中药方剂或中医治疗技术,鉴于中药及中药复方的有效成分复杂,期盼未来随着研究者的不断探索,通过对单味中药有效成分或中药提取物的化学成分进行研究,以探索出更加完善的药物和治疗方案。同时有必要进行大量的随机、双盲、安慰剂对照试验,为临床工作者对于IBS-D的靶向治疗及改善预后提供新的探索方向。
苏海霞,付兆媛,高永泽,等. 5-羟色胺与腹泻型肠易激综合征相关性及中医药调控研究进展[J].中国全科医学,2023,26(21):2678-2685. DOI:10.12114/j.issn.1007-9572.2022.0460. [www.chinagp.net]
SU H X,FU Z Y,GAO Y Z,et al. Correlation between 5-HT and diarrhea-type irritable bowel syndrome and regulation by traditional Chinese medicine[J]. Chinese General Practice,2023,26(21):2678-2685.
本文无利益冲突。



























