
巨大儿不仅会对孕妇及新生儿造成一定危害,也会影响子代远期代谢健康。母亲体质量状态与妊娠结局密切相关,超重肥胖者多伴有血脂异常,妊娠期血脂异常升高会影响宫内环境和新生儿出生体质量。
分析不同妊娠前BMI孕妇妊娠期血脂水平与巨大儿之间的关系。
本研究为单中心回顾性研究,纳入2018年1月—2019年6月在首都医科大学附属北京妇产医院产科建档至分娩并符合纳排标准的单胎孕妇5 287例,根据妊娠前BMI将孕妇分为低体质量、正常体质量和超重肥胖孕妇,根据新生儿出生体质量将低体质量孕妇分为低体质量孕妇非巨大儿组(A组,n=731)和低体质量孕妇巨大儿组(B组,n=27),正常体质量孕妇分为正常体质量孕妇非巨大儿组(C组,n=3 539)和正常体质量孕妇巨大儿组(D组,n=243),超重肥胖孕妇分为超重肥胖孕妇非巨大儿组(E组,n=675)和超重肥胖孕妇巨大儿组(F组,n=72)。收集孕妇相关临床及实验室数据进行统计学分析。采用二元Logistic回归分析探究不同妊娠前BMI孕妇妊娠期血脂水平与巨大儿之间的关系。
B组孕妇妊娠晚期高密度脂蛋白胆固醇(HDL-C)低于A组(P<0.05);D组孕妇妊娠早期总胆固醇(TC)及孕晚期三酰甘油(TG)高于C组(P<0.05),妊娠中、晚期HDL-C低于C组(P<0.05)。F组妊娠早、中、晚期TG均高于E组(P<0.05),妊娠中、晚期HDL-C低于E组(P<0.05)。二元Logistic回归分析结果示,妊娠晚期HDL-C〔OR=0.256,95%CI(0.075,0.871)〕是妊娠前低体质量孕妇娩出巨大儿的影响因素(P<0.05)。孕中期和晚期HDL-C〔OR=0.661,95%CI(0.450,0.971);OR=0.406,95%CI(0.271,0.610)〕是妊娠前正常体质量孕妇娩出巨大儿的影响因素(P<0.05)。妊娠早、中、晚期TG〔OR=1.546,95%CI(1.070,2.234);OR=1.399,95%CI(1.019,1.758);OR=1.289,95%CI(1.072,1.550)〕是妊娠前超重肥胖孕妇娩出巨大儿的影响因素(P<0.05)。
妊娠前低体质量及正常体质量孕妇妊娠期低HDL-C水平与巨大儿相关,而超重肥胖孕妇妊娠期TG水平升高与巨大儿相关。产检时对于胎儿偏大或预测巨大儿高风险的孕妇,需要加强血脂检测及控制。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
巨大儿指不考虑胎龄因素,胎儿出生体质量(birth weight,BW)绝对值>4 000 g或4 500 g[1]。我国对于巨大儿的定义是任何孕周胎儿BW>4 000 g。全球范围内巨大儿的发生率约为9%,但不同国家之间差异很大[2]。我国巨大儿发病率为7.3%,北方地区巨大儿的发病率(8.5%)显著高于南方地区(5.6%)[3]。巨大儿对孕妇及新生儿均会造成一定的危害,对孕妇来说,可导致产程延长或产程停滞,增加剖宫产、产后出血及软产道裂伤的发生率等[4,5,6]。对新生儿来说,增加肩难产、死胎、低血糖、呼吸系统疾病的风险,儿童期及以后患肥胖、糖耐量异常、代谢综合征等疾病的风险亦显著增加[7,8,9]。母亲体质量状态与妊娠结局密切相关[10,11,12],研究显示母亲肥胖和妊娠期增重过多对巨大儿发生率的影响已超过糖尿病[13,14]。超重肥胖者多伴有血脂异常,以三酰甘油(triglyceride,TG)水平升高伴高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平降低为特征[15],不同状态的孕妇妊娠期血脂水平也存在明显差异[16,17]。母体脂质代谢的改变是妊娠期正常生理反应,循环脂质的逐渐增加对胎儿生长发育至关重要,但妊娠期血脂异常升高会影响宫内环境和胎儿结局[18]。因此,本研究拟通过单中心回顾性研究,分析不同妊娠前BMI孕妇妊娠期血脂水平与巨大儿的关系。
纳入2018年1月—2019年6月在首都医科大学附属北京妇产医院产科建档并定期产前检查至分娩的单胎孕妇5 287例。纳入标准:年龄18~45岁,单胎妊娠,有妊娠前身高、体质量数据及妊娠期血脂数据;排除标准:合并妊娠期高血糖、妊娠期高血压疾病、甲状腺疾病;合并胎儿单脐动脉等可能影响胎儿生长发育的疾病;低BW儿( BW<2 500 g)。本研究经首都医科大学附属北京妇产医院伦理委员会批准(2018-ky-009-01)。
先根据妊娠前BMI将孕妇分为低体质量(BMI<18.5 kg/m2)、正常体质量(18.5~<24.0 kg/m2)和超重肥胖孕妇(BMI≥24.0 kg/m2)[19],再根据新生儿BW〔新生儿BW 2 500~4 000 g为非巨大儿,新生儿BW>4 000 g为巨大儿〕分别将低体质量孕妇分为低体质量孕妇非巨大儿组(A组,n=731)和低体质量孕妇巨大儿组(B组,n=27),正常体质量孕妇分为正常体质量孕妇非巨大儿组(C组,n=3 539)和正常体质量孕妇巨大儿组(D组,n=243),超重肥胖孕妇分为超重肥胖孕妇非巨大儿组(E组,n=675)和超重肥胖孕妇巨大儿组(F组,n=72)。
本研究为单中心回顾性研究,收集孕妇临床资料、妊娠期血脂及新生儿出生资料(新生儿BW、新生儿性别),分析不同妊娠前BMI孕妇妊娠期血脂水平与巨大儿之间的关系。
收集孕妇的年龄、末次月经时间、孕产次、授孕方式、既往史〔包括糖尿病、高血压、多囊卵巢综合征(polycystic ovary syndrome,PCOS)、甲状腺疾病等〕、妊娠期合并症及并发症(包括妊娠期糖尿病、妊娠期高血压疾病、妊娠期急性脂肪肝等);体格检查资料包括身高、妊娠前体质量,以妊娠前体质量(kg)/身高(m2)计算妊娠前BMI;辅助检查资料包括妊娠早(5~14周)、中(24~28周)、晚(32~34周)三期血脂,妊娠早期及晚期空腹血糖(fasting plasma glucose,FBG),妊娠中期检测口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)结果。
孕妇分别于妊娠早、中、晚期检测血脂水平,禁食8 h以上次日晨起采集空腹静脉血,应用全自动生化分析仪ARCHITECT ci16200(Abbott Park,IL,USA)检测总胆固醇(total cholesterol,TC)、TG、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和HDL-C水平。
孕妇分别于妊娠早、晚期检测FBG水平,禁食8 h以上次日晨起采集空腹静脉血,应用全自动生化分析仪ARCHITECT ci16200(Abbott Park,IL,USA)检测FBG。妊娠中期行75 g OGTT检查,分别于0 h及服糖后1 h、2 h采血,葡萄糖氧化酶法测血浆葡萄糖,血糖阈值分别为5.1、10.0、8.5 mmol/L,任何一个时间点血糖值≥上述标准即诊断为妊娠期糖尿病;同时计算OGTT曲线下面积。
应用SPSS 25.0统计软件进行统计学分析,符合正态分布的计量资料以( ±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料以相对数表示,组间比较采用χ2检验。将单因素分析中差异有统计学意义的血脂指标(TG、LDL-C、HDL-C)纳入二元Logistics回归分析,分析妊娠前不同BMI孕妇妊娠期血脂水平与巨大儿之间的关系。以P<0.05为差异有统计学意义。
±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料以相对数表示,组间比较采用χ2检验。将单因素分析中差异有统计学意义的血脂指标(TG、LDL-C、HDL-C)纳入二元Logistics回归分析,分析妊娠前不同BMI孕妇妊娠期血脂水平与巨大儿之间的关系。以P<0.05为差异有统计学意义。
研究共纳入低体质量孕妇758例,其中A组731例、B组27例。如表1所示,A组和B组孕妇年龄、妊娠前BMI、经产妇比例、体外受精-胚胎移植(IVF-ET)比例、PCOS比例、剖宫产率、新生儿性别比例、妊娠早期FBG、OGTT结果(0 h血糖、0 h血糖、2 h血糖、曲线下面积)、妊娠晚期FBG及妊娠早、中期TC、TG及LDL-C,妊娠早、中期HDL-C比较,差异无统计学意义(P>0.05);B组孕妇妊娠期增重、分娩孕周及新生儿BW高于A组,妊娠晚期HDL-C低于A组,差异有统计学意义(P<0.05)。
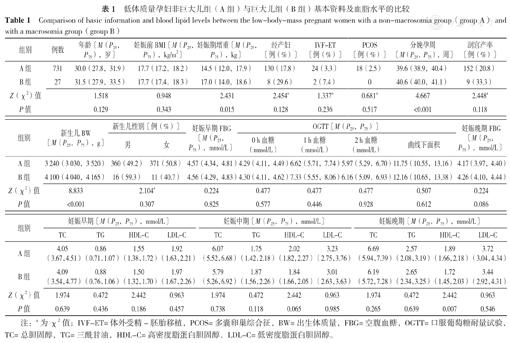
低体质量孕妇非巨大儿组(A组)与巨大儿组(B组)基本资料及血脂水平的比较
Comparison of basic information and blood lipid levels between the low-body-mass pregnant women with a non-macrosomia group(group A) and with a macrosomia group(group B)
低体质量孕妇非巨大儿组(A组)与巨大儿组(B组)基本资料及血脂水平的比较
Comparison of basic information and blood lipid levels between the low-body-mass pregnant women with a non-macrosomia group(group A) and with a macrosomia group(group B)
| 组别 | 例数 | 年龄〔M(P25,P75),岁〕 | 妊娠前BMI〔M(P25,P75),kg/m2〕 | 妊娠期增重〔M(P25,P75),kg〕 | 经产妇〔例(%)〕 | IVF-ET 〔例(%)〕 | PCOS 〔例(%)〕 | 分娩孕周〔M(P25,P75),周〕 | 剖宫产率〔例(%)〕 |
|---|---|---|---|---|---|---|---|---|---|
| A组 | 731 | 30.0(27.8,31.9) | 17.7(17.2,18.2) | 14.5(12.0,17.9) | 130(17.8) | 24(3.3) | 18(2.5) | 39.6(38.9,40.4) | 152(20.8) |
| B组 | 27 | 31.5(27.9,33.5) | 17.7(17.4,18.3) | 17.0(14.0,18.6) | 8(29.6) | 2(7.4) | 0 | 40.6(40.0,41.1) | 9(33.3) |
| Z(χ2)值 | 1.518 | 0.948 | 2.431 | 2.454a | 1.337a | 0.681a | 4.667 | 2.448a | |
| P值 | 0.129 | 0.343 | 0.015 | 0.128 | 0.236 | 0.517 | <0.001 | 0.118 |
| 组别 | 新生儿BW 〔M(P25,P75),g〕 | 新生儿性别〔例(%)〕 | 妊娠早期FBG 〔M(P25,P75),mmol/L〕 | OGTT〔M(P25,P75)〕 | 妊娠晚期FBG 〔M(P25,P75),mmol/L〕 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 0 h血糖(mmol/L) | 1 h血糖(mmol/L) | 2 h血糖(mmol/L) | 曲线下面积 | ||||
| A组 | 3 240(3 030,3 520) | 360(49.2) | 371(50.8) | 4.57(4.34,4.81) | 4.29(4.11,4.49) | 6.62(5.71,7.74) | 5.97(5.29,6.70) | 11.75(10.55,13.16) | 4.17(3.97,4.40) |
| B组 | 4 100(4 040,4 165) | 16(59.3) | 11(40.7) | 4.56(4.29,4.83) | 4.30(4.11,4.62) | 7.33(5.55,8.06) | 6.16(5.09,6.93) | 12.16(10.65,13.38) | 4.26(4.10,4.44) |
| Z(χ2)值 | 8.833 | 2.104a | 0.224 | 0.477 | 0.477 | 0.477 | 0.507 | 0.224 | |
| P值 | <0.001 | 0.307 | 0.825 | 0.577 | 0.446 | 0.928 | 0.612 | 0.086 | |
| 组别 | 妊娠早期〔M(P25,P75),mmol/L〕 | 妊娠中期〔M(P25,P75),mmol/L〕 | 妊娠晚期〔M(P25,P75),mmol/L〕 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TC | TG | HDL-C | LDL-C | TC | TG | HDL-C | LDL-C | TC | TG | HDL-C | LDL-C | ||||||||||
| A组 | 4.05 (3.67,4.51) | 0.86 (0.71,1.07) | 1.55 (1.38,1.72) | 1.92 (1.63,2.21) | 6.07 (5.52,6.68) | 1.75 (1.42,2.18) | 2.02 (1.82,2.27) | 3.23 (2.75,3.76) | 6.69 (5.94,7.39) | 2.57 (2.08,3.19) | 1.89 (1.66,2.18) | 3.72 (3.04,4.34) | |||||||||
| B组 | 4.09 (3.54,4.77) | 0.88 (0.76,1.06) | 1.50 (1.32,1.70) | 1.97 (1.67,2.26) | 5.79 (5.26,6.92) | 1.87 (1.56,2.26) | 1.84 (1.66,2.05) | 3.01 (2.63,3.63) | 6.19 (5.72,7.28) | 2.65 (2.34,3.25) | 1.72 (1.45,2.03) | 3.44 (2.92,4.31) | |||||||||
| Z(χ2)值 | 1.974 | 0.472 | 2.442 | 0.963 | 1.974 | 0.472 | 2.442 | 0.963 | 1.974 | 0.472 | 2.442 | 0.963 | |||||||||
| P值 | 0.639 | 0.436 | 0.186 | 0.457 | 0.738 | 0.118 | 0.065 | 0.985 | 0.265 | 0.639 | 0.007 | 0.546 | |||||||||
注:a为χ2值;IVF-ET=体外受精-胚胎移植,PCOS=多囊卵巢综合征,BW=出生体质量,FBG=空腹血糖,OGTT=口服葡萄糖耐量试验,TC=总胆固醇,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇。
研究共纳入正常体质量孕妇3 782例,其中C组3 539例、D组243例。如表2所示,C组和D组孕妇经产妇比例、IVF-ET比例及PCOS比例、OGTT 2 h血糖,妊娠早期TG、HDL-C,妊娠中期TC、TG,妊娠晚期TC及妊娠早、中、晚期LDL-C比较,差异无统计学意义(P>0.05)。D组孕妇年龄、妊娠前BMI、妊娠期增重、分娩孕周、剖宫产率及新生儿BW、男性新生儿比例、妊娠早期FBG、OGTT血糖(包括0 h、1 h血糖及曲线下面积)、妊娠晚期FBG、妊娠早期TC、妊娠晚期TG水平高于C组,D组孕妇妊娠中、晚期HDL-C水平低于C组,差异有统计学意义(P<0.05)。
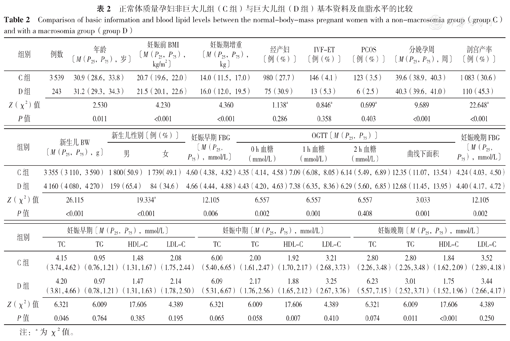
正常体质量孕妇非巨大儿组(C组)与巨大儿组(D组)基本资料及血脂水平的比较
Comparison of basic information and blood lipid levels between the normal-body-mass pregnant women with a non-macrosomia group(group C) and with a macrosomia group(group D)
正常体质量孕妇非巨大儿组(C组)与巨大儿组(D组)基本资料及血脂水平的比较
Comparison of basic information and blood lipid levels between the normal-body-mass pregnant women with a non-macrosomia group(group C) and with a macrosomia group(group D)
| 组别 | 例数 | 年龄〔M(P25,P75),岁〕 | 妊娠前BMI 〔M(P25,P75),kg/m2〕 | 妊娠期增重〔M(P25,P75),kg〕 | 经产妇〔例(%)〕 | IVF-ET 〔例(%)〕 | PCOS 〔例(%)〕 | 分娩孕周〔M(P25,P75),周〕 | 剖宫产率〔例(%)〕 |
|---|---|---|---|---|---|---|---|---|---|
| C组 | 3 539 | 30.9(28.6,33.8) | 20.7(19.6,22.0) | 14.0(11.5,17.0) | 980(27.7) | 146(4.1) | 123(3.5) | 39.6(38.9,40.3) | 1 083(30.6) |
| D组 | 243 | 31.2(29.3,34.3) | 21.5(20.1,22.6) | 16.0(12.0,19.5) | 75(30.9) | 13(5.3) | 6(2.5) | 40.3(39.6,41.0) | 110(45.3) |
| Z(χ2)值 | 2.530 | 4.230 | 4.360 | 1.138a | 0.846a | 0.699a | 9.689 | 22.648a | |
| P值 | 0.011 | <0.001 | <0.001 | 0.286 | 0.358 | 0.403 | <0.001 | <0.001 |
| 组别 | 新生儿BW 〔M(P25,P75),g〕 | 新生儿性别〔例(%)〕 | 妊娠早期FBG 〔M(P25,P75),mmol/L〕 | OGTT〔M(P25,P75)〕 | 妊娠晚期FBG 〔M(P25,P75),mmol/L〕 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 0 h血糖(mmol/L) | 1 h血糖(mmol/L) | 2 h血糖(mmol/L) | 曲线下面积 | ||||
| C组 | 3 355(3 110,3 590) | 1 800(50.9) | 1 739(49.1) | 4.60(4.38,4.82) | 4.35(4.14,4.58) | 7.09(6.08,8.05) | 6.14(5.49,6.89) | 12.35(11.07,13.54) | 4.24(4.03,4.50) |
| D组 | 4 160(4 080,4 270) | 159(65.4) | 84(34.6) | 4.66(4.44,4.88) | 4.43(4.20,4.63) | 7.38(6.35,8.36) | 6.29(5.60,6.85) | 12.68(11.45,13.95) | 4.40(4.17,4.72) |
| Z(χ2)值 | 26.115 | 19.334a | 12.105 | 6.557 | 6.557 | 6.557 | 3.033 | 12.105 | |
| P值 | <0.001 | <0.001 | 0.006 | 0.002 | 0.001 | 0.408 | 0.001 | 0.002 | |
| 组别 | 妊娠早期〔M(P25,P75),mmol/L〕 | 妊娠中期〔M(P25,P75),mmol/L〕 | 妊娠晚期〔M(P25,P75),mmol/L〕 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TC | TG | HDL-C | LDL-C | TC | TG | HDL-C | LDL-C | TC | TG | HDL-C | LDL-C | |
| C组 | 4.15 (3.74,4.62) | 0.95 (0.76,1.21) | 1.48 (1.31,1.67) | 2.08 (1.75,2.44) | 6.00 (5.40,6.65) | 2.00 (1.61,2.47) | 1.92 (1.70,2.17) | 3.21 (2.68,3.73) | 2.80 (2.26,3.48) | 2.80 (2.26,3.48) | 1.84 (1.62,2.09) | 3.52 (2.89,4.18) |
| D组 | 4.20 (3.81,4.66) | 0.97 (0.78,1.21) | 1.47 (1.31,1.63) | 2.14 (1.78,2.50) | 6.09 (5.31,6.67) | 2.17 (1.76,2.56) | 1.88 (1.65,2.12) | 3.25 (2.67,3.76) | 6.23 (5.57,7.15) | 3.01 (2.52,3.71) | 1.75 (1.52,1.96) | 3.44 (2.66,4.17) |
| Z(χ2)值 | 6.321 | 6.009 | 17.606 | 4.389 | 6.321 | 6.009 | 17.606 | 4.389 | 6.321 | 6.009 | 17.606 | 4.389 |
| P值 | 0.046 | 0.764 | 0.385 | 0.195 | 0.065 | 0.058 | 0.007 | 0.410 | 0.074 | 0.011 | <0.001 | 0.250 |
注:a为χ2值。
研究共纳入超重肥胖孕妇747例,其中E组675例、F组72例。如表3所示,两组孕妇年龄、妊娠前BMI、妊娠期增重、经产妇比例、PCOS比例、妊娠早期FBG、OGTT 2 h血糖及妊娠早期TC、HDL-C,妊娠中、晚期TC、LDL-C比较,差异无统计学意义(P>0.05)。F组孕妇IVF-ET比例、分娩孕周、剖宫产率及新生儿BW、男性新生儿比例、OGTT血糖(包括0 h、1 h血糖及曲线下面积)、妊娠晚期FBG及妊娠早、中、晚期TG均高于E组,孕中、晚期HDL-C低于E组,差异有统计学意义(P<0.05)。
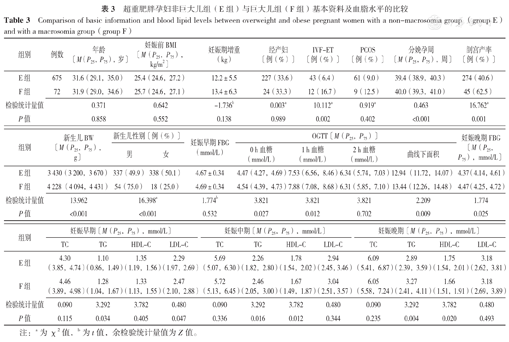
超重肥胖孕妇非巨大儿组(E组)与巨大儿组(F组)基本资料及血脂水平的比较
Comparison of basic information and blood lipid levels between overweight and obese pregnant women with a non-macrosomia group (group E) and with a macrosomia group(group F)
超重肥胖孕妇非巨大儿组(E组)与巨大儿组(F组)基本资料及血脂水平的比较
Comparison of basic information and blood lipid levels between overweight and obese pregnant women with a non-macrosomia group (group E) and with a macrosomia group(group F)
| 组别 | 例数 | 年龄〔M(P25,P75),岁〕 | 妊娠前BMI 〔M(P25,P75),kg/m2〕 | 妊娠期增重(kg) | 经产妇〔例(%)〕 | IVF-ET 〔例(%)〕 | PCOS 〔例(%)〕 | 分娩孕周〔M(P25,P75),周〕 | 剖宫产率〔例(%)〕 |
|---|---|---|---|---|---|---|---|---|---|
| E组 | 675 | 31.6(29.1,35.0) | 25.4(24.6,27.2) | 12.2±5.5 | 227(33.6) | 43(6.4) | 61(9.0) | 39.4(38.9,40.3) | 274(40.6) |
| F组 | 72 | 31.9(29.0,34.6) | 25.7(24.6,27.1) | 13.4±6.3 | 24(33.3) | 12(16.7) | 9(12.5) | 40.0(39.3,41.0) | 45(62.5) |
| 检验统计量值 | 0.371 | 0.642 | -1.736b | 0.003a | 10.112a | 0.919a | 0.463 | 16.762a | |
| P值 | 0.858 | 0.552 | 0.138 | 0.989 | 0.002 | 0.402 | <0.001 | 0.001 |
| 组别 | 新生儿BW 〔M(P25,P75),g〕 | 新生儿性别〔例(%)〕 | 妊娠早期FBG (mmol/L) | OGTT〔M(P25,P75)〕 | 妊娠晚期FBG 〔M(P25,P75),mmol/L〕 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 0 h血糖(mmol/L) | 1 h血糖(mmol/L) | 2 h血糖(mmol/L) | 曲线下面积 | ||||
| E组 | 3 430(3 200,3 670) | 337(49.9) | 338(50.1) | 4.67±0.34 | 4.47(4.27,4.69) | 7.53(6.56,8.46) | 6.34(5.74,7.03) | 12.94 (11.72,14.07) | 4.37(4.14,4.61) |
| F组 | 4 228 (4 094,4 431) | 54(75.0) | 18(25.0) | 4.69±0.34 | 4.54(4.39,4.73) | 7.88(7.08,8.68) | 6.31(5.85,7.10) | 13.44(12.26,14.48) | 4.47(4.25,4.72) |
| 检验统计量值 | 13.962 | 16.398a | 1.774b | 3.821 | 3.821 | 3.821 | 2.209 | 1.774 | |
| P值 | <0.001 | <0.001 | 0.532 | 0.027 | 0.012 | 0.702 | 0.009 | 0.025 | |
| 组别 | 妊娠早期〔M(P25,P75),mmol/L〕 | 妊娠中期〔M(P25,P75),mmol/L〕 | 妊娠晚期〔M(P25,P75),mmol/L〕 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TC | TG | HDL-C | LDL-C | TC | TG | HDL-C | LDL-C | TC | TG | HDL-C | LDL-C | |
| E组 | 4.30 (3.85,4.74) | 1.10 (0.86,1.49) | 1.35 (1.19,1.56) | 2.29 (1.97,2.69) | 5.69 (5.07,6.30) | 2.26 (1.82,2.80) | 1.78 (1.54,2.02) | 2.94 (2.45,3.46) | 6.09 (5.41,6.87) | 2.89 (2.39,3.59) | 1.75 (1.54,2.01) | 3.18 (2.62,3.81) |
| F组 | 4.46 (3.89,4.98) | 1.28 (1.04,1.67) | 1.33 (1.13,1.55) | 2.47 (2.10,2.88) | 5.72 (5.13,6.45) | 2.46 (2.05,3.00) | 1.67 (1.49,1.87) | 3.04 (2.51,3.57) | 6.05 (5.58,7.24) | 3.27 (2.41,4.11) | 1.66 (1.51,1.91) | 3.18 (2.69,3.89) |
| 检验统计量值 | 0.090 | 3.292 | 3.782 | 0.480 | 0.090 | 3.292 | 3.782 | 0.480 | 0.090 | 3.292 | 3.782 | 0.480 |
| P值 | 0.115 | 0.034 | 0.405 | 0.047 | 0.336 | 0.016 | 0.012 | 0.344 | 0.235 | 0.004 | 0.020 | 0.493 |
注:a为χ2值,b为t值,余检验统计量值为Z值。
根据单因素分析结果,以巨大儿为因变量(赋值:是=1,否=0),以TG、HDL-C和LDL-C为自变量(赋值为实测值),进行二元Logistic回归分析,结果显示,妊娠晚期HDL-C是妊娠前低体质量孕妇娩出巨大儿的影响因素〔OR=0.196,95%CI(0.060,0.645),P=0.007〕,校正分娩孕周、新生儿性别、孕妇年龄、妊娠前BMI、妊娠期增重及FBG之后,相关性仍然存在〔OR=0.256,95%CI(0.075,0.871),P=0.029〕,见表4。
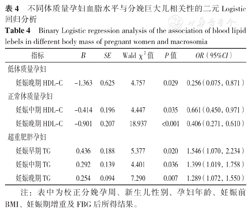
不同体质量孕妇血脂水平与分娩巨大儿相关性的二元Logistic回归分析
Binary Logistic regression analysis of the association of blood lipid lebels in different body mass of pregnant women and macrosomia
不同体质量孕妇血脂水平与分娩巨大儿相关性的二元Logistic回归分析
Binary Logistic regression analysis of the association of blood lipid lebels in different body mass of pregnant women and macrosomia
| 指标 | Β | SE | Wald χ2值 | P值 | OR(95%CI) |
|---|---|---|---|---|---|
| 低体质量孕妇 | |||||
| 妊娠晚期HDL-C | -1.363 | 0.625 | 4.757 | 0.029 | 0.256(0.075,0.871) |
| 正常体质量孕妇 | |||||
| 妊娠中期HDL-C | -0.414 | 0.196 | 4.447 | 0.035 | 0.661(0.450,0.971) |
| 妊娠晚期HDL-C | -0.901 | 0.207 | 18.937 | <0.001 | 0.406(0.271,0.610) |
| 超重肥胖孕妇 | |||||
| 妊娠早期TG | 0.436 | 0.188 | 5.377 | 0.020 | 1.546(1.070,2.234) |
| 妊娠中期TG | 0.292 | 0.139 | 4.401 | 0.036 | 1.399(1.019,1.758) |
| 妊娠晚期TG | 0.254 | 0.094 | 7.290 | 0.007 | 1.289(1.072,1.550) |
注:表中为校正分娩孕周、新生儿性别、孕妇年龄、妊娠前BMI、妊娠期增重及FBG后所得结果。
妊娠中期和晚期HDL-C是妊娠前正常体质量孕妇娩出巨大儿的影响因素〔OR=0.598,95%CI(0.412,0.869);OR=0.355,95%CI(0.239,0.527)〕(P<0.05),校正分娩孕周、新生儿性别、孕妇年龄、妊娠前BMI、妊娠期增重及FBG之后,相关性仍然存在〔OR=0.661,95%CI(0.450,0.971);OR=0.406,95%CI(0.271,0.610);P<0.05〕,见表4。
妊娠早、中、晚期TG是妊娠前超重肥胖孕妇娩出巨大儿的影响因素〔OR=1.501,95%CI(1.044,2.160);OR=1.355,95%CI(1.052,1.745);OR=1.260,95%CI(1.065,1.490)〕(P<0.05),校正分娩孕周、新生儿性别、孕妇年龄、妊娠前BMI、妊娠期增重及FBG之后,相关性仍然存在〔OR=1.546,95%CI(1.070,2.234);OR=1.399,95%CI(1.019,1.758);OR=1.289,95%CI(1.072,1.550);P<0.05〕,见表4。
不同体质量状态的孕妇妊娠期血脂水平存在明显差异[16,17],超重肥胖者多伴有TG水平升高和/或HDL-C水平降低[15],母体妊娠期脂质代谢对胎儿生长发育至关重要。目前国内外已有多项有关妊娠期血脂水平与巨大儿、大于胎龄儿(large for gestational age,LGA)或新生儿BW之间关系的研究,但未对孕妇体质量进行分层分析[18,20,21,22,23]。孔令英等[22]将北京市15家医院2013年6月—2014年11月分娩的27 152例孕妇作为研究对象,分析妊娠期血脂水平与妊娠期糖尿病巨大儿的关系,结果发现巨大儿组孕妇妊娠早、中、晚期TG均高于正常体质量组,而HDL-C低于正常体质量组。国内另有学者研究妊娠中期母体血脂水平对巨大儿的预测价值,结果发现妊娠20周时母体低HDL-C是巨大儿的独立危险因素〔OR=1.67,95%CI(1.06,2.64),P=0.026)〕[23]。妊娠期高血糖是巨大儿的重要危险因素,但有研究发现在血糖控制良好的糖尿病孕妇中,母体妊娠期血脂水平是胎儿大小的强预测指标,这可能解释了为何即使严格控制血糖,糖尿病孕妇巨大儿或LGA的发生率仍然很高[24,25,26,27]。在糖耐量正常的孕妇中,妊娠期血脂水平也与BW及巨大儿的风险相关[28,29],有研究显示无糖尿病的孕妇妊娠晚期TG每升高1 mmol/L,巨大儿风险增加27%,HDL-C每升高1 mmol/L巨大儿风险降低37%,高TG同时伴有低HDL-C的孕妇巨大儿风险高于单纯高TG或低HDL-C孕妇[29]。一项纳入46项研究包括31 402例孕妇在内的Meta分析结果显示,孕妇在整个妊娠期间高TG和低HDL-C水平与BW增加、LGA风险增加以及小于胎龄儿(small for gestational age,SGA)风险降低有关,在妊娠前超重或肥胖的女性中关联性更强[30]。
超重肥胖者多伴有血脂异常,以TG水平升高伴HDL-C水平降低为特征[15],不同体质量状态的孕妇妊娠期血脂水平也存在显著差异[16,17]。本研究根据孕妇妊娠前BMI进行分组,在不同BMI等级中分析妊娠期血脂与巨大儿之间的关系,结果显示娩出巨大儿与非巨大儿的不同BMI孕妇妊娠期血脂水平均有所差异,二元Logistic回归分析结果示,低体质量及正常体质量孕妇妊娠期低HDL-C水平与巨大儿相关,而超重肥胖孕妇妊娠期TG水平升高与巨大儿相关。有学者对超重肥胖与巨大儿的关系进行中介分析,结果发现超重对巨大儿的总影响为0.006〔95%CI(0.001,0.010)〕,其中直接影响为0.005〔95%CI(0.001,0.009)〕,间接影响为0.001〔95%CI(0,0.001)〕,估计由高TG水平介导的比例为11.1%;此外,肥胖对巨大儿的总影响为0.026〔95%CI(0.018,0.036)〕,其中直接影响为0.025〔95%CI(0.017,0.036)〕,间接影响为0.001〔95%CI(0,0.001)〕,估计由高TG水平介导的比例为3.8% [31]。但也有研究发现,在非超重肥胖孕妇中,LGA风险与妊娠早期TG水平呈正相关(OR=1.740,P=0.034),而在超重肥胖孕妇中,LGA风险与妊娠早期TG水平无相关性(OR=1.410,P=0193)[32]。另一项纳入了143例单胎孕妇的前瞻性队列研究,将孕妇根据妊娠前BMI分为正常体质量组(BMI≤25.0 kg/m2)和超重肥胖组(BMI>25.0 kg/m2)进行分层分析,结果显示超重肥胖孕妇妊娠期HDL-C与BW呈负相关,而在正常体质量孕妇无相关性[33]。
脂蛋白脂酶介导母体TG脂解生成的非酯化脂肪酸直接通过脂肪酸转运蛋白或脂肪酸转位酶CD36进入胎盘,胰岛素可激活合胞滋养层细胞母体侧丰富的胰岛素受体,通过蛋白激酶B(AKT)信号通路,诱导游离脂肪酸酯化成TG[34]。这些TG储存在滋养层细胞中,经过水解释放出的游离脂肪酸被扩散至胎儿血浆,进而为胎儿提供能量[35]。超重肥胖孕妇多合并有胰岛素抵抗,母体高胰岛素血症会诱导胎盘储存大量的TG,TG经胎盘脂蛋白酯酶水解成游离脂肪酸增加,过多的游离脂肪酸转运给胎儿是母亲高TG血症增加巨大儿风险的部分原因[34,35]。HDL-C在胆固醇转运和稳态中发挥重要作用,动物实验证实母体HDL-C参与胎儿代谢及生长[36,37]。在缺乏HDL-C的小鼠模型中发现,为了弥补摄取和运输给胎儿的胆固醇不足,胎盘甾醇合成率增加,或者胎盘代谢发生改变允许更多的胆固醇被运输,或者两者都有[36,37]。这可能部分解释了低HDL-C与巨大儿的发生相关。
综上,不同BMI孕妇巨大儿组与非巨大儿组妊娠期血脂水平均有所差异,低体质量及正常体质量孕妇妊娠期HDL-C水平降低与巨大儿相关,而超重肥胖孕妇妊娠期TG水平升高与巨大儿相关。因此,产检时对于胎儿偏大或预测巨大儿高风险的孕妇,需要加强血脂检测及控制,不仅要关注高TG还要重视低HDL-C,从而改善不良妊娠结局。但目前尚无统一的妊娠血脂水平的参考标准,有必要开展多中心、大规模的流行病学研究,制定统一的妊娠期血脂异常诊断标准。
中国临床试验注册中心注册号:ChiCTR220058395
袁仙仙,王佳,张可欣,等.妊娠前不同体质指数孕妇妊娠期血脂水平与巨大儿的关系研究[J].中国全科医学,2023,26(24):2973-2979. DOI:10.12114/j.issn.1007-9572.2023.0097.[www.chinagp.net]
YUAN X X,WANG J,ZHANG K X,et al. Association between blood lipid levels and macrosomia in pregnant women with different pre-pregnancy body mass index[J]. Chinese General Practice,2023,26(24):2973-2979.
本文无利益冲突。



























