
缺血性脑卒中发病率、死亡率、致残率均较高,溶栓后的再灌注损伤对患者影响较大,针刺是治疗本病的特色疗法,但作用机制尚不明确。
探讨"通督调神"电针预处理对脑缺血再灌注损伤(CIRI)大鼠miR-124-3p/糖原合成酶激酶β(GSK-3β)/亲环素D(Cyp-D)信号通路及线粒体膜通透性转换孔(MPTP)的影响,探讨其防治CIRI的可能机制。
2022年6—8月,将100只清洁级SD大鼠随机分为假手术组、模型组、电针组、抑制剂组和电针+激动剂组,每组20只。造模前干预7 d,电针组、电针+激动剂组选取通督调神穴组:百会、风府、大椎穴进行电针干预,1次/d,连续7 d;造模前24 h电针+激动剂组和抑制剂组分别侧脑室注射miR-124激动剂和抑制剂(5 nmol)。除假手术组,余组采用改良线栓法制备大鼠右侧脑缺血再灌注模型;造模成功后,取大鼠右侧脑皮质,采用改良神经功能损伤评分量表(mNSS)、TTC染色观察各组大鼠神经功能损伤程度,TUNEL染色以及透射电镜观察神经细胞损伤情况;免疫荧光染色、Western blotting、实时荧光定量PCR检测各组大鼠脑皮质GSK-3β、p-GSK-3β、Cyp-D、细胞色素C(Cyt-C)、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表达;流式细胞检测MPTP开放程度,MPTP阳性细胞率越高,代表MPTP开放程度越大。
除假手术组,各组大鼠均造模成功。与假手术组比较,模型组大鼠mNSS评分及相对脑梗死体积均增加,线粒体结构破坏严重,细胞凋亡指数升高,p-GSK-3β、Cyp-D阳性表达分别减弱和增强,miR-124-3p及Cyp-D、Cyt-C、Caspase-3 mRNA表达增高,p-GSK-3β/ GSK-3β值降低,Cyp-D、Cyt-C、Caspase-3蛋白相对表达量增高,MPTP开放程度增加(P<0.05)。与模型组比较,电针组、抑制剂组mNSS评分及相对脑梗死体积均降低,线粒体结构破坏减轻,p-GSK-3β/GSK-3β增加,Caspase-3蛋白相对表达量降低;电针+激动剂组GSK-3β mRNA表达增高(P<0.05);电针组、抑制剂组、电针+激动剂组细胞凋亡指数降低,p-GSK-3β、Cyp-D阳性表达分别减弱和增强,miR-124-3p及Cyp-D、Cyt-C、Caspase-3 mRNA表达降低,Cyp-D、Cyt-C蛋白相对表达量降低,MPTP开放程度降低(P<0.05)。与电针组比较,抑制剂组p-GSK-3β阳性表达增强,Cyp-D阳性表达减弱,miR-124-3p及Cyp-D、Cyt-C、Caspase-3 mRNA表达降低,GSK-3β mRNA表达增高,Cyp-D、Cyt-C蛋白相对表达量降低,MPTP开放程度降低(P<0.05);电针+激动剂组细胞凋亡指数增高,p-GSK-3β阳性表达减弱,Cyp-D阳性表达增强,miR-124-3p、Cyt-C、Caspase-3 mRNA表达增高,Cyp-D、Cyt-C蛋白相对表达量增高,MPTP开放程度增加(P<0.05)。
"通督调神"电针预处理可减轻CIRI大鼠神经损伤,其机制可能与介导miR-124-3p/GSK-3β/Cyp-D信号通路、抑制MPTP开放进而减轻细胞损伤相关。这一研究结果从机制上进一步验证了"通督调神"针法治疗CIRI的疗效,同时为中医"治未病"提供新的科学依据,促进临床应用。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
脑卒中是人类致死和致残的主要疾病之一[1],其中,缺血性脑卒中的发生率约为87%[2]。目前国际公认的急性期脑卒中的有效治疗手段是尽早溶栓、恢复血流[3],然而恢复缺血区血流会不可避免地加重缺血性脑损伤,引起脑缺血再灌注损伤(CIRI)[4]。研究发现,电针预处理对CIRI具有抑制炎性反应、调节自噬、抗氧化应激等作用[5,6]。然而,有关电针防治CIRI的作用机制尚未能完全明晰,有待进一步研究。
CIRI的病理过程较为复杂,线粒体作为细胞的动力源在细胞能量稳态中起着关键作用[7],线粒体功能障碍是器官再灌注损伤发生后诱发机体损伤的重要因素[8,9]。因此,靶向线粒体可能是缺血性卒中的重要防治策略之一[10]。线粒体通透性转换孔(MPTP)开放是线粒体功能障碍以及诱发神经元凋亡级联反应的关键环节[11]。亲环素D(Cyp-D)是调控MPTP的关键蛋白,当MPTP异常开放后,线粒体内膜上细胞色素C(Cyt-C)等被释放入细胞质中,进而激活凋亡相关蛋白,诱发细胞凋亡[12]。
微小RNA在调节多种细胞功能中发挥重要作用,其中miR-124特异性表达于中枢神经系统[13]。研究显示,miR-124的异常表达与脑损伤密切相关[14],且miR-124与糖原合成酶激酶-3β(GSK-3β) mRNA之间可能存在靶向关系[15]。GSK-3β可以通过直接调节MPTP而维持线粒体功能[16]。电针预处理对CIRI的神经保护作用是否与miR-124-3p/GSK-3β/Cyp-D信号通路介导的MPTP开放度降低相关,值得关注。
本研究通过观察"通督调神"电针预处理对CIRI大鼠缺血侧脑皮质神经元线粒体MPTP的影响,探讨电针预处理对CIRI大鼠的潜在神经保护机制,为促进"通督调神"针刺法在缺血性脑卒中的临床应用提供新的科学依据。
SPF级雄性SD大鼠100只,鼠龄7周,体质量200~250 g,购自湖南斯莱克景达实验动物有限公司〔许可证号:SCXK(湘)2019-0004〕,饲养于安徽中医药大学实验动物中心。饲养条件:Ⅱ级,温度(23±2) ℃,相对湿度(60±10)%,自由摄食饮水,12 h/12 h明暗周期。适应性饲养1周后,采用随机数字表法将大鼠分为假手术组、模型组、电针组、抑制剂组与电针+激动剂组,每组20只。本次实验过程中对大鼠的处置符合国家科技部2006年颁布的《关于善待实验动物的指导性意见》中的相关规定,并取得安徽中医药大学伦理委员会批准(伦理编号:AHUCM-rats-2021012)。
小鼠抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)抗体(TA-08)、山羊抗小鼠IgG(HRP,ZB-2305)、山羊抗兔IgG(HRP,ZB-2301)均购于北京Zsbio公司。GSK3β抗体(BS1402)、p-GSK3β抗体(BS4084)购于美国Bioworld公司,Cyp-D抗体(ABP52875)购于瑞士Abbkin公司,Cyt C抗体(BA0781)购于美国Boster公司,半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)抗体(ab184787)购于英国abcam公司;PCR引物(上海Sangon Biotech公司);原位末端转移酶标记技术(TUNEL)细胞凋亡检测试剂盒(B014)、山羊抗兔IgG(FITC,B029)购于安徽欣乐生物技术有限公司;兔抗大鼠Cyp-D抗体(bs-9878R)购于北京博奥森生物技术有限公司,兔抗大鼠GSK3β抗体(BS1402)、兔抗大鼠p-GSK3β抗体(BS4084)购于美国Bioworld公司;MPTP检测试剂盒(C2009S)购于上海碧云天生物技术有限公司。miR-124-3p激动剂(ISO9001)、miR-124-3p抑制剂(ISO13485),购于广州市锐博生物科技有限公司。
天协牌一次性无菌针灸针(0.2 mm×25.0 mm,苏州天协针灸器械有限公司),华佗牌电子针疗仪(SDZ-Ⅱ,苏州医疗用品厂有限公司),电子天平(FA2004N,上海菁海仪器有限公司),荧光显微镜(BX51,日本Olympus公司),徕卡切片机(RM2016,德国Leica公司),荧光定量PCR仪(PIKOREAL 96,美国Thermo Scientific),流式细胞仪(CytoFLEX,上海贝克曼库尔特国际贸易有限公司),动物麻醉机(R500/R600系列,深圳瑞沃德生命科技有限公司),Image J图像分析软件(美国NIH公司),全自动数字切片扫描系统(Pannoramic MIDI,匈牙利3DHISTECH公司),形态学图像分析系统(JD801,江苏省捷达科技发展有限公司)。
造模前干预7 d:(1)假手术组与模型组大鼠常规饲养,同电针组做相同的抓取、捆绑,但不做任何干预。(2)电针组大鼠在干预期内吸入异氟烷,麻醉状态下抓取、捆绑,俯卧位固定于鼠板上。选取通督调神穴组:百会、风府、大椎穴进行干预,取0.2 mm×25.0 mm毫针,在针柄处连接电针治疗仪,以针体轻轻抖动为度,选用疏密波,频率为2 Hz/5 Hz,电流强度1~2 mA,1次/d,20 min/次,连续干预7 d。穴区定位及针刺方法:百会,顶骨的正中央,向后斜刺3 mm;风府,枕骨顶脊后枕寰关节背凹陷处,平刺进针3 mm;大椎,第7颈椎与第1胸椎间,背部正中,向后斜刺3 mm。穴位定位参照《实验针灸学》[17]关于"常用实验动物针灸穴位"的取穴标准。(3)抑制剂组大鼠在干预期内前期常规饲养,同电针组做相同的抓取、捆绑。大鼠于造模前24 h经侧脑室注射miR-124-3p抑制剂10 μL(0.5 nmol/μL)。侧脑室注射:大鼠腹腔注射2%戊巴比妥钠溶液(30 mg/kg)麻醉后俯卧位固定于脑立体定位仪上,备皮后用2%复方聚维酮碘溶液消毒,沿头部正中作一长0.5~1.0 mm的纵向切口,暴露颅骨后用棉签蘸取3%过氧化氢溶液涂擦颅骨表面,记号笔标记前囟点。以前囱为基点,调整进针点坐标位置(前囟后:0.8 mm,距矢状缝横向距离:1.5 mm,进针深度:4.5 mm)。用牙科钻(孔径约2 mm)钻开颅骨至硬脑膜,使用微量注射器进入硬膜下4.5 mm的侧脑室位置后连接脑立体定位仪,以0.5 μL/min的速度向脑室内注射miR-124-3p抑制剂,注射完毕后留针5~10 min,以防药液外渗,结束后缓慢退出注射器,干棉球轻微按压针孔,消毒后逐层缝合头皮。(4)电针+激动剂组大鼠在干预期内与电针组同期进行相同的电针干预,并且于造模前24 h经侧脑室注射miR-124-3p激动剂10 μL(0.5 nmol/μL)。
末次电针及侧脑室注射24 h后,参照文献[18]采用改良线栓法制备CIRI大鼠模型。大鼠腹腔注射2%戊巴比妥钠溶液(30 mg/kg)麻醉后仰卧位固定于鼠板上、备皮,2%复方聚维酮碘溶液消毒,于颈前正中偏右0.2~0.3 cm皮肤行一长1.5~2.0 cm纵向切口,镊子钝性分离浅筋膜,暴露胸锁乳突肌,在颈前肌群与胸锁乳突肌之间向深部钝性分离,暴露颈动脉鞘,玻璃分针游离颈总动脉(CCA)和迷走神经,向上分离直至CCA分叉处。钝性分离颈外动脉(ECA)和颈内动脉(ICA),使之清晰可见。结扎距离ICA、ECA分叉处下7~10 mm的CCA近心端,同时在CCA距离ICA、ECA分叉处下3 mm的CCA远心端打一活结备用。结扎ECA近心端,动脉微血管夹夹闭ICA。在活结下2 mm处用显微剪在CCA上剪一"V"型切口,插入直径0.3 mm的硅胶线栓,沿ICA方向插入后去除血管夹,从ICA、ECA分叉处继续插入18~20 mm,至线栓遇轻微阻力时停止并结扎CCA上的活结。2%复方聚维酮碘溶液消毒后逐层缝合切口,将线栓尾端留置在体外,用0.9%氯化钠溶液浸湿的棉球覆盖伤口,腹腔注射青霉素钠溶液0.2 mL/d(4×104 U/d)预防感染。
模型组、电针组、电针+激动剂组及抑制剂组均按上述方法造模;假手术组大鼠只分离右侧颈部CCA、ICA、ECA,不进行结扎和插线;模型大鼠脑缺血2 h后,回抽线栓令头端退至CCA结扎处,恢复大脑中动脉灌注。
再灌注2 h后依据Zea-Longa 5分法对大鼠进行神经功能缺损评分[19],0分:无神经功能损伤症状;1分:不能完全伸展对侧前肢,提尾悬吊时左前肢屈曲;2分:爬行时向对侧转圈;3分:爬行时向对侧倾倒;4分:意识水平下降或丧失,不能自主行走。1~3分视为造模成功,纳入实验。各组大鼠均造模成功。
采用改良神经功能损伤评分量表(mNSS)[20]评定各组大鼠CIRI模型制备完成24 h后神经行为学情况。mNSS评分总分为0~18分。分数越高,代表神经功能损伤越严重。
神经功能损伤评分结束后大鼠腹腔注2%戊巴比妥钠(30 mg/kg)麻醉。每组随机选取15只大鼠,迅速断头,取出全脑组织。每组取5只大鼠全脑用冰0.9%氯化钠溶液冲洗,冰箱速冻,用于TTC染色。每组取4只大鼠迅速打开胸腔暴露心脏,用0.9%氯化钠溶液进行灌注后取脑,分离右侧皮质组织,将其修整成2份大小为1 mm×1 mm×1 mm的组织样本,一份置于电镜固定液内室温固定24 h,于4 ℃冰箱保存以行透射电镜观察,另一份用于制备单细胞悬液,以行流式细胞检测。每组取6只大鼠断头后取右侧脑皮质组织迅速装入冻存管置于液氮罐中低温保存,用于实时荧光定量PCR、Western blotting检测。每组剩余的5只大鼠迅速打开胸腔,暴露心脏后依次予以0.9%氯化钠溶液及4%多聚甲醛灌注,结束后于冰上断头分离出全脑组织,置于4%多聚甲醛中固定24~48 h,用于TUNEL染色和免疫荧光染色。
取-20 ℃冰箱冷冻20 min的脑组织,去除小脑及嗅球部分后,切成5个厚度约2 mm的冠状切片,将脑片置于2% TTC溶液中,37 ℃恒温避光染色,30 min后取出脑片,置于4%多聚甲醛中固定24 h后拍照。最后使用Image J软件进行分析并计算大鼠的相对脑梗死体积,用百分比(%)表示。相对脑梗死体积=脑切片白色缺血区域体积/脑切片总体积×100%。
取电镜固定液固定后的脑皮质组织,以1%的锇酸×0.1 mmol/L磷酸缓冲液(PBS)于室温固定2 h后漂洗,15 min×3次。梯度乙醇脱水,丙酮渗透、包埋,制成超薄切片(厚度70 nm),铀铅双染色各15 min,室温干燥过夜,将切片置于透射电镜下×10 000、×25 000观察神经细胞超微结构。
取脑皮质组织100 mg,按试剂盒说明,经过总RNA抽提、反转录成cDNA样本后进行荧光定量PCR扩增。反应结束后根据测得样品CT值,以U6、β-actin为内参,按照2-ΔΔCT法计算目的基因的miRNA及mRNA的相对表达量。引物由生工生物工程(上海)股份有限公司提供,引物序列见表1。

目的基因及内参基因的引物序列
Primer sequence of target gene and internal reference gene
目的基因及内参基因的引物序列
Primer sequence of target gene and internal reference gene
| 基因名称 | 扩增长度(bp) | 上游引物(5'→3') | 下游引物(5'→3') |
|---|---|---|---|
| β-actin | 150 | CCCATCTATGAGGGTTACGC | TTTAATGTCACGCACGATTTC |
| U6 | 94 | CTCGCTTCGGCAGCACA | AACGCTTCACGAATTTGCGT |
| Cyp-D | 101 | ATCCTTAGCAAGTGTCTCGG | CTGGTCAAGGAAAAAGGCAG |
| GSK-3β | 113 | ACTTTGGAAGTGCAAAGCAG | ACTAGACGTGTAATCGGTGG |
| Cyt-C | 86 | TAAGACTGGACCAAACCTCC | TGTTCTTGTTGGCATCTGTG |
| Caspase-3 | 138 | ATGTCGATGCAGCTAACCTC | AACTGCTCCTTTTGCTGTGA |
| miR-124-3p | 64 | ACACTCCAGCTGGGTAAGGCACGCGGTG | TGGTGTCGTGGAGTCG |
| miR-124-3p-RT | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGGCATT |
注:Cyp-D=亲环素D,GSK-3β=糖原合成酶激酶,Cyt-C=细胞色素C,Caspase-3=半胱氨酸天冬氨酸蛋白酶3。
取脑皮质组织100 mg,裂解、离心取上清液、测定蛋白浓度、加热使蛋白充分变性后,依次经过电泳、转膜、封闭,漂洗,加入一抗,过夜,磷酸盐吐温缓冲液(PBST)漂洗3遍,加入二抗,室温孵育2 h,PBST漂洗10 min,重复3遍。使用L增强型化学发光试剂(ECL)试剂盒检测蛋白,Image J处理分析灰度值,以GAPDH为内参蛋白,计算目标蛋白相对表达量,目的蛋白相对表达量=目的条带灰度值/内参条带灰度值。
取出脑皮质组织加入1 mL混合消化液,剪碎组织后37 ℃恒温箱中振荡消化,过滤后收集单细胞悬液,加入适当体积的检测缓冲液、Calcein AM染色液、荧光淬灭工作液或Ionomycin对照重悬,37 ℃避光孵育30 min后,1 000×g室温离心5 min收集细胞,加入400 µL检测缓冲液重悬细胞后进行流式细胞仪检测和分析。Calcein的最大激发光波长为494 nm,最大发射光波长为517 nm。MPTP阳性细胞率越高,代表MPTP开放程度越大。
将固定后的脑组织石蜡包埋、切片(厚度5 μm)。切片依次经过烤片、浸洗、脱蜡、洗片,滴加蛋白酶K工作液37 ℃孵育25 min后PBS冲洗3次,滴加TUNEL检测液,37 ℃培养箱孵育60 min,PBS冲洗3次,滴加DAPI染液,避光反应10 min。PBS清洗后甩干,抗荧光淬灭封片剂封片。数字切片扫描仪(Pannoramic MIDI)扫描荧光切片,CaseViewer 2.2软件×400观察并记录图像。每只大鼠随机选取2张切片,每张切片随机截取3个视野,用Image J软件计算凋亡指数(apoptosis index,AI),公式为AI(%)=凋亡细胞数/总细胞数×100%。
将标本从组织固定液中取出,依次进行脱水、浸蜡、包埋、切片(厚度5 μm)后浸洗及脱蜡,抗原高压修复,山羊血清封闭,室温孵育30 min后滴加一抗,37 ℃孵育1 h,PBS冲洗,甩干,滴加FITC标记的荧光二抗,37 ℃避光孵育30 min,PBS冲洗后封片,Pannoramic MIDI扫描荧光切片,CaseViewer 2.2软件×400观察并记录图像。每只大鼠随机选取2张切片,每张切片随机取3个视野,捷达JD801医学图像分析系统进行图像分析,计算平均光密度值。
采用SPSS 26.0软件进行数据处理和分析,采用GraphPad Prism 8.0整理生成统计图。符合正态分布的计量资料数据以( ±s)表示,Shapiro-Wilk法检验各指标数据的正态性,Leven检验数据方差齐性。数据符合正态分布且方差齐时,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t法,方差不齐时多重比较采用盖姆斯-豪厄尔检验;不符合正态分布的计量资料以M(P25,P75)表示,多组间比较采用独立样本克鲁斯卡尔-沃利斯检验。以P<0.05为差异有统计学意义。
±s)表示,Shapiro-Wilk法检验各指标数据的正态性,Leven检验数据方差齐性。数据符合正态分布且方差齐时,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t法,方差不齐时多重比较采用盖姆斯-豪厄尔检验;不符合正态分布的计量资料以M(P25,P75)表示,多组间比较采用独立样本克鲁斯卡尔-沃利斯检验。以P<0.05为差异有统计学意义。
各组大鼠mNSS评分和相对脑梗死体积比较,差异均有统计学意义(P<0.01)。假手术组大鼠脑组织无梗死,神经功能无缺损;与假手术组比较,模型组大鼠mNSS评分升高、相对脑梗死体积增大,差异有统计学意义(P<0.05);与模型组比较,电针组、抑制剂组大鼠mNSS评分降低、相对脑梗死体积减小,差异有统计学意义(P<0.05);与电针组比较,电针+激动剂组大鼠mNSS评分升高、相对脑梗死体积增大,差异有统计学意义(P<0.05),见图1、表2。
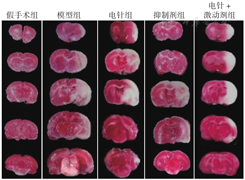

各组大鼠mNSS评分及相对脑梗死体积比较
Comparison of mNSS score and infarct volume of brain tissue of rats in each group
各组大鼠mNSS评分及相对脑梗死体积比较
Comparison of mNSS score and infarct volume of brain tissue of rats in each group
| 组别 | 只数 | mNSS评分〔M(P25,P75),分〕 | 只数 | 相对脑梗死体积( ±s,% ) ±s,% ) |
|---|---|---|---|---|
| 假手术组 | 20 | 0(0,0) | 5 | 0 |
| 模型组 | 20 | 10(10,11)a | 5 | 34.95±3.80a |
| 电针组 | 20 | 6(6,7)b | 5 | 22.37±3.73b |
| 抑制剂组 | 20 | 6(5,7)b | 5 | 17.88±1.90b |
| 电针+激动剂组 | 20 | 10(9,10)c | 5 | 30.85±1.56c |
| F(H)值 | 86.638 | 135.041e | ||
| P值 | <0.001 | <0.001 |
注:a表示与假手术组比较P<0.05,b表示与模型组比较P<0.05,c表示与电针组比较P<0.05,e为H值;mNSS=改良神经功能损伤评分量表。
假手术组大鼠脑皮质神经细胞轮廓清晰,细胞核膜完整无皱缩,线粒体形态多呈椭圆形或梭形,大小适中,结构完整,膜边界清晰,嵴纵行排列密集有规律,横纹排列清晰有序,未出现肿胀及空泡;模型组和电针+激动剂组大鼠的神经细胞体积缩小,核膜皱缩,线粒体肿胀,线粒体膜边界不清,嵴断裂稀疏,横纹大部分消失,体内大部分呈空泡状态;电针组和抑制剂组大鼠细胞轮廓尚清晰,细胞核膜轻度皱缩,线粒体呈椭圆或梭形,略肿胀,结构完整,膜尚清晰,嵴和横纹分布基本整齐有序,见图2。
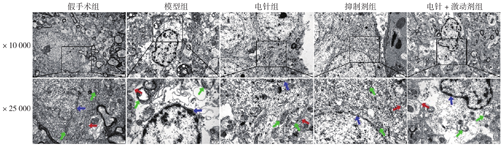

注:图中红色箭头所示细胞膜,蓝色箭头所示细胞核,绿色箭头所示线粒体。
各组大鼠脑皮质神经细胞AI比较,差异均有统计学意义(P<0.05)。与假手术组比较,模型组大鼠脑皮质细胞AI升高,差异有统计学意义(P<0.01);与模型组比较,电针组、抑制剂组、电针+激动剂组大鼠脑皮质细胞AI降低,差异有统计学意义(P<0.01);与电针组比较,抑制剂组大鼠脑皮质细胞AI降低,电针+激动剂组细胞AI增高,差异有统计学意义(P<0.05),见图3、表3。
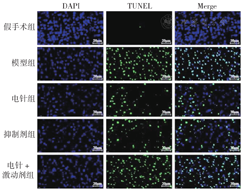

注:蓝色荧光标记细胞核(DAPI),绿色荧光为TUNEL阳性细胞。
各组大鼠脑皮质AI、GSK-3β、p-GSK-3β、Cyp-D蛋白阳性表达比较( ±s)
±s)
Comparison of AI,GSK-3β,p-GSK-3β,Cyp-D protein positive expression in cerebral cortex of rats in each group
各组大鼠脑皮质AI、GSK-3β、p-GSK-3β、Cyp-D蛋白阳性表达比较( ±s)
±s)
Comparison of AI,GSK-3β,p-GSK-3β,Cyp-D protein positive expression in cerebral cortex of rats in each group
| 组别 | 只数 | AI(%) | GSK-3β | p-GSK-3β | Cyp-D |
|---|---|---|---|---|---|
| 假手术组 | 5 | 15.68±2.07 | 0.59±0.02 | 0.61±0.03 | 0.14±0.01 |
| 模型组 | 5 | 60.14±2.70a | 0.60±0.04 | 0.16±0.02a | 0.61±0.04a |
| 电针组 | 5 | 37.14±1.91b | 0.59±0.02 | 0.37±0.04b | 0.37±0.02b |
| 抑制剂组 | 5 | 28.98±1.96bc | 0.59±0.01 | 0.50±0.03bc | 0.28±0.02bc |
| 电针+激动剂组 | 5 | 41.28±2.75bc | 0.60±0.05 | 0.27±0.03bc | 0.46±0.04bc |
| F值 | 251.206 | 0.205 | 157.005 | 193.968 | |
| P值 | <0.001 | 0.932 | <0.001 | <0.001 |
注:a表示与假手术组比较P<0.01,b表示与模型组比较P<0.01,c表示与电针组比较P<0.05。
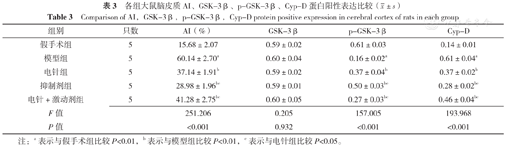
各组GSK-3β蛋白阳性表达结果比较,差异无统计学意义(P>0.05)。各组p-GSK-3β蛋白、Cyp-D阳性表达结果比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组p-GSK-3β蛋白阳性表达减弱,Cyp-D蛋白阳性表达增强,差异有统计学意义(P<0.01);与模型组比较,电针组、抑制剂组、电针+激动剂组p-GSK-3β蛋白阳性表达增强,Cyp-D蛋白阳性表达减弱,差异有统计学意义(P<0.01);与电针组比较,抑制剂组p-GSK-3β蛋白阳性表达增强,Cyp-D蛋白阳性表达减弱,电针+激动剂组p-GSK-3β蛋白阳性表达减弱,Cyp-D蛋白阳性表达增强,差异有统计学意义(P<0.05),见表3、图4。
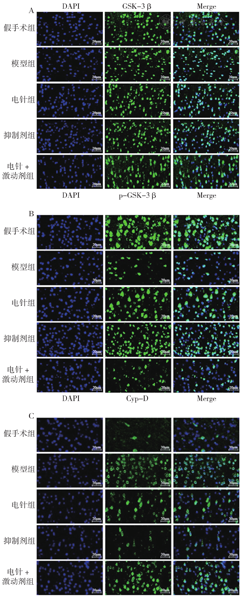

注:蓝色荧光标记细胞核(DAPI),绿色荧光分别标记糖原合成酶激酶(GSK-3β)、p-GSK-3β、亲环素D(Cyp-D)表达,Merge为合图;A为GSK-3β,B为p-GSK-3β,C为Cyp-D。
各组大鼠脑皮质miR-124-3p及GSK-3β、Cyp-D、Cyt-C、Caspase-3 mRNA表达比较,差异均有统计学意义(P<0.05)。与假手术组比较,模型组大鼠脑皮质miR-124-3p及Cyp-D、Cyt-C、Caspase-3 mRNA表达增高,GSK-3β mRNA表达降低,差异有统计学意义(P<0.01);与模型组比较,电针组、抑制剂组、电针+激动剂组miR-124-3p及Cyp-D、Cyt-C、Caspase-3 mRNA表达降低,电针组、抑制剂组、电针+激动剂组GSK-3β mRNA表达增高,差异有统计学意义(P<0.05);与电针组比较,抑制剂组miR-124-3p及Cyp-D、Cyt-C、Caspase-3 mRNA表达降低,GSK-3β mRNA表达增高,差异有统计学意义(P<0.05),电针+激动剂组miR-124-3p、Cyt-C、Caspase-3 mRNA表达增高,GSK-3β mRNA表达降低,差异有统计学意义(P<0.05),见表4。

各组大鼠脑皮质miR-124-3p及GSK-3β、Cyp-D、Cyt-C、Caspase-3 mRNA表达比较( ±s)
±s)
Comparison of miR-124-3p,GSK-3β,Cyp-D,Cyt-C,Caspase-3 mRNA expressions in cerebral cortex of rats in each group
各组大鼠脑皮质miR-124-3p及GSK-3β、Cyp-D、Cyt-C、Caspase-3 mRNA表达比较( ±s)
±s)
Comparison of miR-124-3p,GSK-3β,Cyp-D,Cyt-C,Caspase-3 mRNA expressions in cerebral cortex of rats in each group
| 组别 | 只数 | miR-124-3p | GSK-3β | Cyp-D | Cyt-C | Caspase-3 |
|---|---|---|---|---|---|---|
| 假手术组 | 6 | 1.00±0.05 | 1.02±0.03 | 0.91±0.14 | 0.97±0.08 | 0.98±0.05 |
| 模型组 | 6 | 1.94±0.10a | 0.48±0.11a | 2.32±0.11a | 2.78±0.04a | 1.92±0.11a |
| 电针组 | 6 | 1.32±0.05b | 0.79±0.08b | 1.88±0.24b | 2.09±0.14b | 1.38±0.03b |
| 抑制剂组 | 6 | 0.16±0.01bc | 0.94±0.05bc | 1.40±0.16bc | 1.59±0.05bc | 1.24±0.05bc |
| 电针+激动剂组 | 6 | 1.46±0.06bc | 0.68±0.05c | 2.06±0.08b | 2.42±0.05bc | 1.59±0.08bc |
| F值 | 664.668 | 57.980 | 78.919 | 487.748 | 162.193 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
注:a表示与假手术组比较P<0.05,b表示与模型组比较P<0.05,c表示与电针组比较P<0.05。
各组大鼠脑皮质p-GSK-3β/GSK-3β、Cyp-D、Cyt-C、Caspase-3蛋白表达比较,差异均有统计学意义(P<0.05)。与假手术组比较,模型组大鼠脑皮质p-GSK-3β/GSK-3β值降低,Cyp-D、Cyt-C、Caspase-3蛋白相对表达量增高(P<0.01);与模型组比较,电针组、抑制剂组p-GSK-3β/ GSK-3β值增高,Cyp-D、Cyt-C蛋白相对表达量降低(P<0.01),Caspase-3蛋白相对表达量降低(P<0.01、P<0.05);电针+激动剂组Cyp-D、Cyt-C蛋白相对表达量降低(P<0.01),p-GSK-3β/ GSK-3β值增高、Caspase-3蛋白相对表达量降低,差异均无统计学意义(P>0.05)。与电针组比较,抑制剂组Cyp-D、Cyt-C蛋白相对表达量降低(P<0.01);电针+激动剂组Cyp-D、Cyt-C蛋白相对表达量增高(P<0.01),p-GSK-3β/ GSK-3β值降低,Caspase-3蛋白相对表达量增高,差异均有统计学意义(P<0.05),见表5、图5。



各组大鼠脑皮质p-GSK-3β/ GSK-3β、Cyp-D、Cyt-C、Caspase-3蛋白表达比较( ±s)
±s)
Comparison of p-GSK-3β/ GSK-3β protein expression ratio and GSK-3β,Cyp-D,Cyt-C,Caspase-3 protein expressions in cerebral cortex of rats in each group
各组大鼠脑皮质p-GSK-3β/ GSK-3β、Cyp-D、Cyt-C、Caspase-3蛋白表达比较( ±s)
±s)
Comparison of p-GSK-3β/ GSK-3β protein expression ratio and GSK-3β,Cyp-D,Cyt-C,Caspase-3 protein expressions in cerebral cortex of rats in each group
| 组别 | 只数 | p-GSK-3β/ GSK-3β | Cyp-D | Cyt-C | Caspase-3 |
|---|---|---|---|---|---|
| 假手术组 | 6 | 0.95±0.18 | 0.25±0.06 | 0.08±0.05 | 0.10±0.02 |
| 模型组 | 6 | 0.37±0.13a | 0.95±0.12a | 0.82±0.10a | 0.79±0.14a |
| 电针组 | 6 | 0.62±0.13b | 0.51±0.09b | 0.43±0.12b | 0.46±0.13bc |
| 抑制剂组 | 6 | 0.73±0.10b | 0.36±0.03bc | 0.10±0.06bc | 0.31±0.08b |
| 电针+激动剂组 | 6 | 0.47±0.11bc | 0.75±0.11bc | 0.60±0.09bc | 0.62±0.09bc |
| F值 | 17.343 | 65.481 | 80.363 | 41.303 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 |
注:a表示与假手术组比较P<0.01,b表示与模型组比较P<0.05,c表示与电针组比较P<0.05。
与假手术组比较,模型组MPTP开放程度明显增加(P<0.01);与模型组比较,电针组、抑制剂组、电针+激动剂组MPTP开放程度降低(P<0.01);与电针组比较,抑制剂组MPTP开放程度降低(P<0.05)、电针+激动剂组MPTP开放程度增加(P<0.05),见表6、图6。
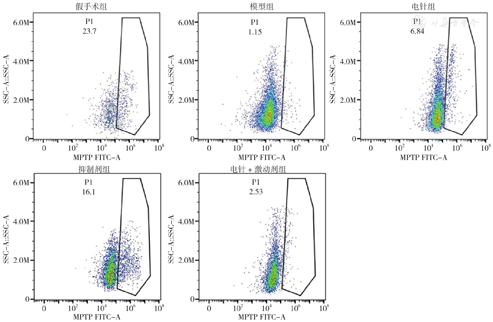

注:SSC=侧向散射光,FITC-A=FITC通道的荧光信号脉冲面积。

各组大鼠脑皮质神经细胞线粒体通透性转换孔开放程度比较( ±s)
±s)
Comparison of openness degree of MPTP in cerebral cortex neurons of rats in each group
各组大鼠脑皮质神经细胞线粒体通透性转换孔开放程度比较( ±s)
±s)
Comparison of openness degree of MPTP in cerebral cortex neurons of rats in each group
| 组别 | 只数 | MPTP阳性细胞率(%) |
|---|---|---|
| 假手术组 | 4 | 20.575±2.085 |
| 模型组 | 4 | 0.865±0.207a |
| 电针组 | 4 | 6.753±0.076b |
| 抑制剂组 | 4 | 16.350±0.493bc |
| 电针+激动剂组 | 4 | 2.690±0.338bc |
| F值 | 313.385 | |
| P值 | <0.001 |
注:a表示与假手术组比较P<0.05,b表示与模型组比较P<0.05,c表示与电针组比较P<0.05。
本研究采用"通督调神"电针预处理CIRI模型大鼠,选穴百会、风府、大椎。百会乃"三阳五会",聚一身之阳气汇于巅顶;大椎为"诸阳之会",具有保健强身之效;风府可"醒脑调神",三穴均为督脉之要穴,共用有通督调神、燮理阴阳之功[21,22]。研究表明,"通督调神"针刺能够促进神经髓鞘再生、调节细胞自噬,改善CIRI后大鼠神经功能,但其更为具体的作用机制尚未明晰[23,24]。因此,探讨"通督调神"电针预处理减轻CIRI作用机制,对于本病的防治意义重大。本研究中,CIRI模型大鼠mNSS评分增高、相对脑梗死体积增大、TUNEL阳性细胞率增高;电针预处理后,大鼠mNSS评分及相对脑梗死体积减少、TUNEL阳性细胞率明显降低,表明"通督调神"电针预处理可抑制CIRI的发生和发展,减轻神经功能损伤,与相关研究[25,26]结果一致。
细胞凋亡是CIRI的一种细胞死亡方式[27],而线粒体功能障碍介导细胞凋亡的内源性途径,并发挥中心调控作用[28]。MPTP位于线粒体内外膜之间的接触点上,对调控线粒体通透性起关键作用[29],当MPTP过度开放时,线粒体与细胞质之间的离子交换异常,导致线粒体结构和功能异常[30]。线粒体内膜上Cyt-C释放到细胞质中,并进一步活化Caspase-3等凋亡相关因子,诱发凋亡发生、加重神经损伤。本研究透射电镜显示CIRI大鼠线粒体形态破坏严重,流式细胞术结果显示MPTP开放程度升高;电针组线粒体结构尚完整,MPTP开放程度降低,提示电针预处理对CIRI后的神经保护作用可能与抑制MPTP开放、进而保护线粒体功能有关。
miR-124是参与缺血再灌注损伤发生机制的重要调控因子[31]。李杰等[32]研究发现,采用冲击波干预脑梗死大鼠可降低海马组织miR-124表达,促进神经干细胞增殖,改善受损神经功能。研究发现,miR-124表达下调可增强GSK-3β的表达,减弱Wnt/β-catenin途径的活性,发挥保护性作用[33]。GSK-3β是一种在体内广泛表达的信号转导激酶,参与细胞的多种生理过程,如代谢、凋亡和免疫调节等[34]。目前,已有研究发现GSK-3β信号传导通路与调控MPTP开放有关[35],其磷酸化产物p-GSK-3β在CIRI中的神经保护作用已被证实,即通过抑制MPTP的开放来维持线粒体再灌注损伤后的跨膜电位[36]。Cyp-D是构成MPTP最关键的调节蛋白,也是参与神经元缺血性死亡的重要物质[37]。Cyt-C、Caspase-3是重要的促凋亡蛋白[38],Caspase-3被认为是细胞凋亡的标志[39]。
本研究中,模型组大鼠脑皮质miRNA-124-3p表达升高、GSK-3β mRNA、p-GSK-3β/GSK-3β蛋白表达比值降低、Cyp-D蛋白及微小RNA表达增高,电针和抑制剂干预后miR-124-3p表达降低、GSK-3β mRNA、p-GSK-3β/GSK-3β蛋白表达比值增高、Cyp-D蛋白及mRNA表达降低,说明miR-124被抑制后可靶向激活GSK-3β,进而通过上调p-GSK-3β的表达,抑制Cyp-D介导的MPTP开放,起到保护线粒体的作用。与模型组比较,电针组和抑制剂组Cyt-C、Caspase-3蛋白及mRNA表达降低,说明细胞凋亡得到抑制、细胞功能相对稳定。该结果进一步验证电针预处理可能通过负向调控大鼠神经细胞miRNA-124-3p,进而抑制MPTP开放发挥神经保护作用。
为进一步验证"通督调神"电针预处理对CIRI大鼠神经细胞线粒体MPTP的影响是否与miR-124-3p/GSK-3β/Cyp-D信号通路相关,本研究设置了miR-124-3p抑制剂组和电针+激动剂组。结果显示,抑制剂组miR-124-3p及Cyp-D、Cyt-C、Caspase-3表达降低,GSK-3β表达增高,总体结果与电针组趋同,而电针与miR-124-3p激动剂联用后,其抑制miR-124-3p、进而激活GSK-3β抑制MPTP开放的作用被逆转。进一步说明"通督调神"电针预处理对CIRI大鼠神经功能损伤发生发展的抑制作用,可能是通过调控miR-124-3p/GSK-3β/Cyp-D信号通路,抑制神经细胞线粒体MPTP开放。课题组前期研究发现,"通督调神"针刺法对中风高危因素的干预可有效控制"中风先兆"的进展[40,41],本研究对今后开展针灸预处理防治缺血性脑卒中的临床应用具有积极的促进作用。然而,电针预处理预防CIRI的作用机制复杂,仍有待进一步深入研究。本研究中大鼠为吸入异氟烷麻醉状态下电针,麻醉药对大鼠神经系统的影响是否影响到本实验尚未得知,这使得本实验存在一定的局限性和不足,后续研究将通过查阅文献、实体实验等方式优化电针方式,减少干预因素。
张国庆,童婷婷,王颖,等. "通督调神"电针预处理介导miR-124-3p/GSK-3β/Cyp-D信号通路对脑缺血再灌注损伤大鼠脑皮质线粒体通透性转换孔的影响及机制探讨[J].中国全科医学,2023,26(24):3050-3060. DOI:10.12114/j.issn.1007-9572.2023.0056. [www.chinagp.net]
ZHANG G Q,TONG T T,WANG Y,et al. Effect and mechanism of Tongdu Tiaoshen electroacupuncture pretreatment-mediated miR-124-3p/GSK-3β/Cyp-D signaling pathway on mitochondrial permeability transition pore in cerebral cortex of rats with cerebral ischemia-reperfusion injury[J]. Chinese General Practice,2023,26(24):3050-3060.
本文无利益冲突。



























