
我国糖尿病肾病(DKD)的发病率及其所致终末期肾病(ESRD)在透析患者中所占比例不断攀升,DKD防控已刻不容缓,强化的多因素干预措施可延缓或者阻止DKD的病程进展,因而通过建立个性化的风险预测模型,可延缓或者阻止DKD病程进展,从而实现DKD的有效防治。
开发和验证一个基于诺模图(Nomogram)的列线图模型,根据预测变量预测2型糖尿病(T2DM)患者从微量白蛋白尿(MAU)进展为大量白蛋白尿(CAU)的风险。
回顾性收集2016年10月—2020年3月于空军军医大学第一附属医院内分泌科住院的2型糖尿病合并白蛋白尿患者1 263例,并根据入院时间将入组病例分为开发队列906例和验证队列357例。应用LASSO回归从收集的基线数值中筛选预测变量,并根据筛选的预测变量构建多因素Logistic回归模型,绘制模型的Nomogram。模型的验证和评估主要基于受试者工作特征(ROC)曲线、校准曲线和Hosmer-Lemeshow检验(H-L检验),并根据决策曲线分析法(DCA)评价该模型的实际临床净收益。
基于LASSO回归惩罚收缩方法筛选出糖尿病病程、收缩压(SBP)、糖化血红蛋白(HbA1c)、低密度脂蛋白胆固醇(LDL-C)、胱抑素C(Cys-C)、估算肾小球滤过率(eGFR)及糖尿病视网膜病变(DR)7个预测变量,依据这些预测变量构建的多因素Logistic回归模型显示,糖尿病病程≥10年、SBP≥140 mmHg、HbA1c≥7.0 mmol/L、LDL-C≥1.8mmol/L、Cys-C>1.09 mg/L及合并DR是T2DM患者MAU进展为CAU的危险因素(P<0.05),而eGFR分层处理后无统计学意义(P>0.05)。预测模型的内外部验证显示该模型预测效能较优,开发队列的ROC曲线下面积(AUC)为0.814〔95%CI(0.782,0.846)〕,验证队列的AUC为0.768〔95%CI(0.713,0.823)〕,校准曲线和H-L检验(开发队列P=0.065;验证队列P=0.451)均显示该模型具有较好的一致性和拟合度,另外DCA结果显示当开发队列和验证队列的阈值概率分别为0.08~0.74和0.14~0.70时,该模型临床有效性较高。
本研究开发了一个包含糖尿病病程、SBP、HbA1c、LDL-C、Cys-C、eGFR及是否合并DR 7个变量的列线图模型,可用于预测T2DM患者MAU进展为CAU的临床风险。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
尽管随着经济发展水平及全民健康意识的不断提高,但糖尿病肾病(DKD)仍然是全球终末期肾病(ESRD)的常见原因[1],约占发达国家病例的50%[2],而在我国DKD已超过了肾小球肾炎相关慢性肾脏病,并成为慢性肾脏病(CKD)进展至ESRD的首要病因[3],更严重的是ESRD患者需要透析的人数正在不断增加,给患者和社会造成了沉重的负担[4]。我国2012年的一项横断面调查研究显示,CKD的整体患病率为10.8%〔95%CI(10.2%,11.3%)〕,估计的CKD总患病人数约为1.195亿〔95%CI(1.129,1.250)〕[5]。DKD典型病程进展过程是最初出现白蛋白尿〔微量白蛋白尿(MAU)〕增加,进展为大量白蛋白尿(CAU),随后肾功能迅速下降并发展至ESRD[6]。研究表明,很多初步诊断的2型糖尿病(T2DM)患者就已经出现MAU或者CAU,在没有特定干预措施的情况下,20%~40%的MAU患者会逐渐发展为CAU,并有20%的CAU患者在20年后进展至ESRD[7]。尽管过去的研究认为CAU的出现是肾脏已发生的"不可逆转临界点",但越来越多的证据表明,通过一系列强化干预措施可使CAU降为MAU或者正常白蛋白尿(NAU),并能改善糖尿病患者的肾脏预后,从而延长患者的寿命,提高患者的长期生活质量[8,9,10,11]。
因此,有必要建立一个基于诺模图(Nomogram)的简单、直观的个性化预测模型,筛选影响T2DM患者MAU进展为CAU的危险因素,通过列线图直观地预测T2DM患者MAU进展为CAU的临床风险,有利于使医生做出合理的临床诊疗决策,及时采取必要的强化干预措施,阻止或者延缓DKD的病程进展或者恶化,改善肾脏功能并防止其进展至ESRD,从而降低糖尿病相关不良预后事件的发生概率,减轻患者和社会的负担。
本研究为回顾性研究,收集2016年10月—2020年3月于空军军医大学第一附属医院内分泌科住院的2型糖尿病合并白蛋白尿患者1 263例,并根据入院时间将研究对象分为两个部分,即2016年10月—2019年3月作为开发队列(906例),2019年4月—2020年3月作为验证队列(357例)。研究对象的纳入标准:(1)依据1999年WHO制定的糖尿病诊断标准[12]及2011年WHO建议的糖化血红蛋白(HbA1c)≥6.5%[13];(2)尿微量白蛋白/肌酐(UACR)≥30 mg/g;(3)年龄≥18岁;(4)入院前3个月内保持平稳的降糖治疗方案。排除标准:(1)酮症酸中毒以及近期反复发作低血糖事件病史;(2)近期内服用过影响肾功能及尿蛋白排泄的肾毒性药物;(3)急慢性泌尿系感染、急性肾损伤以及肾脏恶性肿瘤等;(4)严重免疫系统疾病、精神心理疾患以及肝肾功能障碍;(5)1型糖尿病及其他类型糖尿病等。本研究已通过空军军医大学第一附属医院医学伦理委员会审核批准(KY20222107-C-1)。
依据最新指南[14,15],所有研究对象在排除短期内运动、急性感染、经期、严重血糖及血压过高、酮症酸中毒等造成的急性肾功能损伤后,采用随机尿测定UACR,在入院前3个月至半年内3次检测中≥2次异常,即可诊断为尿白蛋白排泄增加。同时,依据UACR将蛋白尿分为3个阶段:<30 mg/g为NAU;30~300 mg/g为MAU;>300 mg/g为临床蛋白尿或CAU。
应用EpiData 3.1软件录入临床数据,数据来源于医院临床数据信息管理系统,收集患者基本特征、实验室指标、伴发疾病以及用药情况,数据录入由2名内分泌科医生完成,并对数据进行校验与查错。
研究对象的基本特征包括性别、年龄、糖尿病家族史、高血压家族史、糖尿病病程、生活方式(吸烟状况、饮酒状况)、生理指标〔收缩压(SBP)、舒张压(DBP)、BMI、腹型肥胖情况〕。"吸烟"定义为吸烟≥1支/d,且持续或累积≥6个月;"饮酒"定义为至少1次/周,持续半年以上。BMI=体质量(kg)/身高(m2),腹型肥胖(即中心型肥胖)[14]:腰围男性≥90 cm,女性≥85 cm。
所有研究对象入院后禁食8~12 h,于入院次日清晨空腹行肘静脉抽血并及时送检验科检测,生化指标采用本院检验科全自动生化分析仪(4 000 r/min离心5 min,离心半径22.5 cm,取血清)检测血常规〔计算血清中性粒细胞与淋巴细胞比值(NLR)〕、血肌酐(Scr)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、尿素氮(BUN)、尿酸(UA)以及胱抑素C(Cys-C);空腹血糖(FPG)和HbA1c由内分泌实验室进行检测,利用入院次日晨尿检测UACR。根据患者的性别、年龄以及Scr计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR),计算公式采用适合我国人群的中国改良简化MDRD公式(eGFRc_MDRD)[16],即175×(Scra)-1.234×(年龄)-0.179×(0.79女性),eGFR单位为mL·min-1·(1.73 m2)-1,a表示单位为mg/dL(1 mg/dL=88.4 μmol/L)。
伴发疾病有动脉粥样硬化性心血管疾病(ASCVD)和糖尿病性视网膜病变(DR)。药物使用情况包括降脂药物(贝特类及他汀类)、血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)降压药以及降糖药物,其中降糖药物包括二甲双胍、α-葡萄糖苷酶抑制剂(阿卡波糖、伏格列波糖)以及是否注射基础胰岛素(甘精胰岛素、地特胰岛素及德谷胰岛素)。
采用SPSS 23.0和R 4.1.3进行统计分析,符合正态分布的计量资料以( ±s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;计数资料采用相对数表示,组间比较采用χ2检验。运用R语言中glmnet包进行最小绝对收缩和选择算子(LASSO)回归筛选预测变量,并通过Logistic回归分析筛选的变量,对连续性变量分层处理后建立预测模型,并画出Nomogram。模型的验证与评估主要基于受试者工作特征(ROC)曲线、校准曲线、Hosmer-Lemeshow检验(H-L检验)以及决策曲线分析(DCA),从模型的区分度、校准度和临床净收益3个方面进行综合评价。以P<0.05为差异有统计学意义。
±s)表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;计数资料采用相对数表示,组间比较采用χ2检验。运用R语言中glmnet包进行最小绝对收缩和选择算子(LASSO)回归筛选预测变量,并通过Logistic回归分析筛选的变量,对连续性变量分层处理后建立预测模型,并画出Nomogram。模型的验证与评估主要基于受试者工作特征(ROC)曲线、校准曲线、Hosmer-Lemeshow检验(H-L检验)以及决策曲线分析(DCA),从模型的区分度、校准度和临床净收益3个方面进行综合评价。以P<0.05为差异有统计学意义。
开发队列年龄低于验证队列,差异有统计学意义(P<0.05)。开发队列和验证队列性别、糖尿病家族史所占比例、高血压家族史所占比例、糖尿病病程、吸烟所占比例、饮酒所占比例、SBP、DBP、BMI、腹型肥胖所占比例、FPG、HbA1c、TG、TC、LDL-C、HDL-C、BUN、UA、Cys-C、eGFR、NLR、UACR、DR发生率、ASCVD发生率、贝特类所占比例、他汀类所占比例、ACEI/ARB降压药所占比例、二甲双胍所占比例、α-葡萄糖苷酶抑制剂、注射基础胰岛素所占比例比较,差异均无统计学意义(P>0.05),见表1。
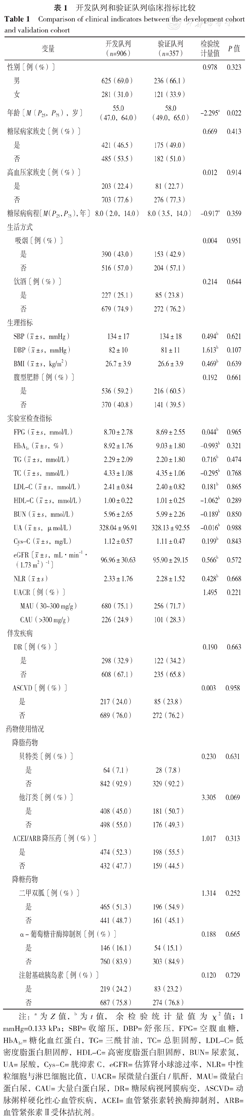
开发队列和验证队列临床指标比较
Comparison of clinical indicators between the development cohort and validation cohort
开发队列和验证队列临床指标比较
Comparison of clinical indicators between the development cohort and validation cohort
| 变量 | 开发队列(n=906) | 验证队列(n=357) | 检验统计量值 | P值 |
|---|---|---|---|---|
| 性别〔例(%)〕 | 0.978 | 0.323 | ||
| 男 | 625(69.0) | 236(66.1) | ||
| 女 | 281(31.0) | 121(33.9) | ||
| 年龄〔M(P25,P75),岁〕 | 55.0(47.0,64.0) | 58.0(49.0,65.0) | -2.295a | 0.022 |
| 糖尿病家族史〔例(%)〕 | 0.669 | 0.413 | ||
| 是 | 421(46.5) | 175(49.0) | ||
| 否 | 485(53.5) | 182(51.0) | ||
| 高血压家族史〔例(%)〕 | 0.012 | 0.914 | ||
| 是 | 203(22.4) | 81(22.7) | ||
| 否 | 703(77.6) | 276(77.3) | ||
| 糖尿病病程〔M(P25,P75),年〕 | 8.0(2.0,14.0) | 8.0(3.5,14.0) | -0.917a | 0.359 |
| 生活方式 | ||||
| 吸烟〔例(%)〕 | 0.004 | 0.951 | ||
| 是 | 390(43.0) | 153(42.9) | ||
| 否 | 516(57.0) | 204(57.1) | ||
| 饮酒〔例(%)〕 | 0.214 | 0.644 | ||
| 是 | 227(25.1) | 85(23.8) | ||
| 否 | 679(74.9) | 272(76.2) | ||
| 生理指标 | ||||
SBP( ±s,mmHg) ±s,mmHg) | 134±17 | 134±18 | 0.494b | 0.621 |
DBP( ±s,mmHg) ±s,mmHg) | 82±10 | 81±11 | 1.613b | 0.107 |
BMI( ±s,kg/m2) ±s,kg/m2) | 26.7±3.9 | 26.6±3.9 | 0.469b | 0.639 |
| 腹型肥胖〔例(%)〕 | 0.192 | 0.661 | ||
| 是 | 536(59.2) | 216(60.5) | ||
| 否 | 370(40.8) | 141(39.5) | ||
| 实验室检查指标 | ||||
FPG( ±s,mmol/L) ±s,mmol/L) | 8.70±2.78 | 8.69±2.55 | 0.044b | 0.965 |
HbA1c( ±s,%) ±s,%) | 8.92±1.76 | 9.03±1.80 | -0.993b | 0.321 |
TG( ±s,mmol/L) ±s,mmol/L) | 2.29±2.09 | 2.20±1.80 | 0.716b | 0.474 |
TC( ±s,mmol/L) ±s,mmol/L) | 4.33±1.08 | 4.35±1.06 | -0.295b | 0.768 |
LDL-C( ±s,mmol/L) ±s,mmol/L) | 2.41±0.84 | 2.40±0.82 | 0.181b | 0.865 |
HDL-C( ±s,mmol/L) ±s,mmol/L) | 1.00±0.22 | 1.01±0.25 | -1.062b | 0.289 |
BUN( ±s,mmol/L) ±s,mmol/L) | 5.96±2.65 | 5.99±2.26 | -0.189b | 0.850 |
UA( ±s,μmol/L) ±s,μmol/L) | 328.04±96.91 | 328.13±92.55 | -0.016b | 0.988 |
Cys-C( ±s,mg/L) ±s,mg/L) | 1.12±0.57 | 1.11±0.47 | 0.199b | 0.843 |
eGFR〔 ±s,mL·min-1·(1.73 m2)-1〕 ±s,mL·min-1·(1.73 m2)-1〕 | 96.96±30.63 | 95.90±29.15 | 0.566b | 0.572 |
NLR( ±s) ±s) | 2.33±1.76 | 2.28±1.52 | 0.428b | 0.668 |
| UACR〔例(%)〕 | 1.495 | 0.221 | ||
| MAU(30~300 mg/g) | 680(75.1) | 256(71.7) | ||
| CAU(>300 mg/g) | 226(24.9) | 101(28.3) | ||
| 伴发疾病 | ||||
| DR〔例(%)〕 | 0.190 | 0.663 | ||
| 是 | 298(32.9) | 122(34.2) | ||
| 否 | 608(67.1) | 235(65.8) | ||
| ASCVD〔例(%)〕 | 0.003 | 0.958 | ||
| 是 | 217(24.0) | 85(23.8) | ||
| 否 | 689(76.0) | 272(76.2) | ||
| 药物使用情况 | ||||
| 降脂药物 | ||||
| 贝特类〔例(%)〕 | 0.230 | 0.631 | ||
| 是 | 64(7.1) | 28(7.8) | ||
| 否 | 842(92.9) | 329(92.2) | ||
| 他汀类〔例(%)〕 | 3.305 | 0.069 | ||
| 是 | 408(45.0) | 181(50.7) | ||
| 否 | 498(55.0) | 176(49.3) | ||
| ACEI/ARB降压药〔例(%)〕 | 1.017 | 0.313 | ||
| 是 | 474(52.3) | 198(55.5) | ||
| 否 | 432(47.7) | 159(44.5) | ||
| 降糖药物 | ||||
| 二甲双胍〔例(%)〕 | 1.314 | 0.252 | ||
| 是 | 465(51.3) | 196(54.9) | ||
| 否 | 441(48.7) | 161(45.1) | ||
| α-葡萄糖苷酶抑制剂〔例(%)〕 | 0.188 | 0.665 | ||
| 是 | 146(16.1) | 54(15.1) | ||
| 否 | 760(83.9) | 303(84.9) | ||
| 注射基础胰岛素〔例(%)〕 | 0.120 | 0.729 | ||
| 是 | 219(24.2) | 83(23.2) | ||
| 否 | 687(75.8) | 274(76.8) | ||
注:a为Z值,b为t值,余检验统计量值为χ2值;1 mmHg=0.133 kPa;SBP=收缩压,DBP=舒张压,FPG=空腹血糖,HbA1c=糖化血红蛋白,TG=三酰甘油,TC=总胆固醇,LDL-C=低密度脂蛋白胆固醇,HDL-C=高密度脂蛋白胆固醇,BUN=尿素氮,UA=尿酸,Cys-C=胱抑素C,eGFR=估算肾小球滤过率,NLR=中性粒细胞与淋巴细胞比值,UACR=尿微量白蛋白/肌酐,MAU=微量白蛋白尿,CAU=大量白蛋白尿,DR=糖尿病视网膜病变,ASCVD=动脉粥样硬化性心血管疾病,ACEI=血管紧张素转换酶抑制剂,ARB=血管紧张素Ⅱ受体拮抗剂。
根据白蛋白尿诊断标准,将开发队列906例患者分为MAU组(n=680)和CAU组(n=226)。MAU组和CAU组性别、糖尿病家族史所占比例、高血压家族史所占比例、吸烟所占比例、饮酒所占比例、BMI、腹型肥胖所占比例、FPG、HbA1c、TG、TC、HDL-C、ASCVD发生率、贝特类所占比例、他汀类所占比例、ACEI/ARB降压药所占比例、α-葡萄糖苷酶抑制剂所占比例、注射基础胰岛素所占比例比较,差异均无统计学意义(P>0.05);两组年龄、糖尿病病程、SBP、DBP、HbA1c、LDL-C、BUN、UA、Cys-C、eGFR、NLR、DR发生率以及二甲双胍所占比例比较,差异均有统计学意义(P<0.05),见表2。
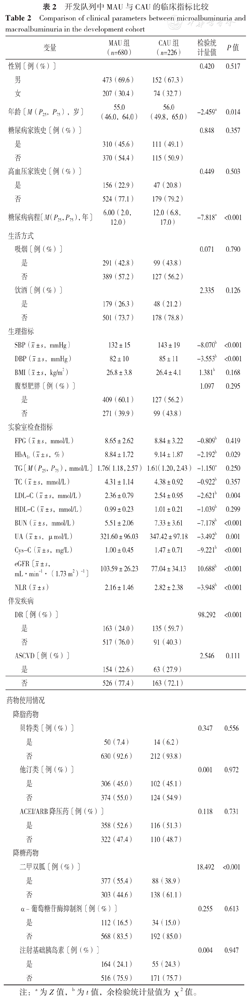
开发队列中MAU与CAU的临床指标比较
Comparison of clinical parameters between microalbuminuria and macroalbuminuria in the development cohort
开发队列中MAU与CAU的临床指标比较
Comparison of clinical parameters between microalbuminuria and macroalbuminuria in the development cohort
| 变量 | MAU组(n=680) | CAU组(n=226) | 检验统计量值 | P值 |
|---|---|---|---|---|
| 性别〔例(%)〕 | 0.420 | 0.517 | ||
| 男 | 473(69.6) | 152(67.3) | ||
| 女 | 207(30.4) | 74(32.7) | ||
| 年龄〔M(P25,P75),岁〕 | 55.0(46.0,64.0) | 56.0(49.8,65.0) | -2.459a | 0.014 |
| 糖尿病家族史〔例(%)〕 | 0.848 | 0.357 | ||
| 是 | 310(45.6) | 111(49.1) | ||
| 否 | 370(54.4) | 115(50.9) | ||
| 高血压家族史〔例(%)〕 | 0.449 | 0.503 | ||
| 是 | 156(22.9) | 47(20.8) | ||
| 否 | 524(77.1) | 179(79.2) | ||
| 糖尿病病程〔M(P25,P75),年〕 | 6.00(2.0,12.0) | 12.0(6.8,17.0) | -7.818a | <0.001 |
| 生活方式 | ||||
| 吸烟〔例(%)〕 | 0.071 | 0.790 | ||
| 是 | 291(42.8) | 99(43.8) | ||
| 否 | 389(57.2) | 127(56.2) | ||
| 饮酒〔例(%)〕 | 2.335 | 0.126 | ||
| 是 | 179(26.3) | 48(21.2) | ||
| 否 | 501(73.7) | 178(78.8) | ||
| 生理指标 | ||||
SBP( ±s,mmHg) ±s,mmHg) | 132±15 | 143±19 | -8.070b | <0.001 |
DBP( ±s,mmHg) ±s,mmHg) | 82±10 | 85±11 | -3.553b | <0.001 |
BMI( ±s,kg/m2) ±s,kg/m2) | 26.8±3.8 | 26.4±4.1 | 1.381b | 0.168 |
| 腹型肥胖〔例(%)〕 | 1.097 | 0.295 | ||
| 是 | 409(60.1) | 127(56.2) | ||
| 否 | 271(39.9) | 99(43.8) | ||
| 实验室检查指标 | ||||
FPG( ±s,mmol/L) ±s,mmol/L) | 8.65±2.62 | 8.84±3.22 | -0.809b | 0.419 |
HbA1c( ±s,%) ±s,%) | 8.84±1.72 | 9.14±1.87 | -2.192b | 0.029 |
| TG〔M(P25,P75),mmol/L〕 | 1.76(1.18,2.57) | 1.61(1.20,2.43) | -1.150a | 0.250 |
TC( ±s,mmol/L) ±s,mmol/L) | 4.31±1.14 | 4.38±0.92 | -0.922b | 0.357 |
LDL-C( ±s,mmol/L) ±s,mmol/L) | 2.36±0.79 | 2.54±0.95 | -2.621b | 0.004 |
HDL-C( ±s,mmol/L) ±s,mmol/L) | 0.99±0.23 | 1.01±0.21 | -1.039b | 0.299 |
BUN( ±s,mmol/L) ±s,mmol/L) | 5.51±2.06 | 7.33±3.61 | -7.178b | <0.001 |
UA( ±s,μmol/L) ±s,μmol/L) | 321.60±96.03 | 347.42±97.18 | -3.492b | 0.001 |
Cys-C( ±s,mg/L) ±s,mg/L) | 1.00±0.45 | 1.47±0.71 | -9.221b | <0.001 |
eGFR〔 ±s,mL·min-1·(1.73 m2)-1〕 ±s,mL·min-1·(1.73 m2)-1〕 | 103.59±26.23 | 77.04±34.13 | 10.688b | <0.001 |
NLR( ±s) ±s) | 2.16±1.46 | 2.82±2.38 | -3.948b | <0.001 |
| 伴发疾病 | ||||
| DR〔例(%)〕 | 98.292 | <0.001 | ||
| 是 | 163(24.0) | 135(59.7) | ||
| 否 | 517(76.0) | 91(40.3) | ||
| ASCVD〔例(%)〕 | 2.546 | 0.111 | ||
| 是 | 154(22.6) | 63(27.9) | ||
| 否 | 526(77.4) | 163(72.1) | ||
| 药物使用情况 | ||||
| 降脂药物 | ||||
| 贝特类〔例(%)〕 | 0.347 | 0.556 | ||
| 是 | 50(7.4) | 14(6.2) | ||
| 否 | 630(92.6) | 212(93.8) | ||
| 他汀类〔例(%)〕 | 0.001 | 0.972 | ||
| 是 | 306(45.0) | 102(45.1) | ||
| 否 | 374(55.0) | 124(54.9) | ||
| ACEI/ARB降压药〔例(%)〕 | 0.118 | 0.731 | ||
| 是 | 358(52.6) | 116(51.3) | ||
| 否 | 322(47.4) | 110(48.7) | ||
| 降糖药物 | ||||
| 二甲双胍〔例(%)〕 | 18.492 | <0.001 | ||
| 是 | 377(55.4) | 88(38.9) | ||
| 否 | 303(44.6) | 138(61.1) | ||
| α-葡萄糖苷酶抑制剂〔例(%)〕 | 0.255 | 0.613 | ||
| 是 | 112(16.5) | 34(15.0) | ||
| 否 | 568(83.5) | 192(85.0) | ||
| 注射基础胰岛素〔例(%)〕 | 0.004 | 0.947 | ||
| 是 | 164(24.1) | 55(24.3) | ||
| 否 | 516(75.9) | 171(75.7) | ||
注:a为Z值,b为t值,余检验统计量值为χ2值。
利用开发队列中入组病例的基线数据,通过LASSO回归基于一种惩罚收缩回归方法,从基线数据包含的30个危险因素中筛选出7个与结局相关的变量,即糖尿病病程、SBP、HbA1c、LDL-C、Cys-C、eGFR以及是否合并DR(图1A和图1B)。在λ最小值(λ=0.004)和最小值的1 SE(λ=0.033)处绘制垂直线,即log(λ)=-3.400时LASSO回归拟合的模型最优,此时模型可筛选出7个具有非零系数的预测变量。


注:A为LASSO回归筛选变量系数曲线;B为在LASSO回归模型中筛选最合适λ的过程。
根据上述LASSO回归分析筛选的糖尿病病程、SBP、HbA1c、LDL-C、Cys-C、eGFR(赋值:实测值)以及是否合并DR(赋值:否=0,是=1) 7个变量作为自变量,以T2DM合并白蛋白尿患者最终是否发生CAU为因变量(赋值:MAU=0,CAU=1),建立多因素Logistic回归模型,结果显示,SBP、HbA1c、LDL-C、Cys-C、eGFR以及是否合并DR是T2DM合并白蛋白尿患者发生CAU的影响因素(P<0.05),见表3。
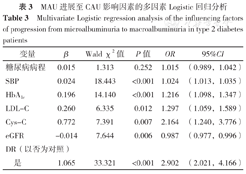
MAU进展至CAU影响因素的多因素Logistic回归分析
Multivariate Logistic regression analysis of the influencing factors of progression from microalbuminuria to macroalbuminuria in type 2 diabetes patients
MAU进展至CAU影响因素的多因素Logistic回归分析
Multivariate Logistic regression analysis of the influencing factors of progression from microalbuminuria to macroalbuminuria in type 2 diabetes patients
| 变量 | β | Wald χ2值 | P值 | OR | 95%CI |
|---|---|---|---|---|---|
| 糖尿病病程 | 0.015 | 1.313 | 0.252 | 1.015 | (0.989,1.042) |
| SBP | 0.024 | 18.443 | <0.001 | 1.024 | (1.013,1.035) |
| HbA1c | 0.196 | 14.140 | <0.001 | 1.216 | (1.098,1.347) |
| LDL-C | 0.260 | 6.335 | 0.012 | 1.297 | (1.059,1.589) |
| Cys-C | 0.772 | 7.391 | 0.007 | 2.164 | (1.240,3.776) |
| eGFR | -0.014 | 7.644 | 0.006 | 0.987 | (0.977,0.996) |
| DR(以否为对照) | |||||
| 是 | 1.065 | 33.321 | <0.001 | 2.902 | (2.021,4.166) |
由于表3中糖尿病病程、SBP、HbA1c、LDL-C、Cys-C及eGFR均为连续性变量,直接将其构建风险预测模型临床价值不高(即OR值的临床意义为连续性变量每单位改变所引起的相对危险度改变),不能较好的为临床医生提供诊疗决策。同时,考虑到各种临床实验室和其他检查指标波动范围较大,直接纳入模型将导致模型的实际预测效能不高。因此,据大量文献和临床应用实际,将连续性变量依据不同的临床分类标准进行分层处理[14,15,17],再将其纳入模型,进而分析变量的相对风险,以便更好地阐释模型的临床应用价值。通过查阅文献检索相关指标的最新指南,对表3中的糖尿病病程、SBP、HbA1c、LDL-C、Cys-C、eGFR进行了分层处理,并对上述7个变量进行赋值,见表4。最终,以T2DM合并白蛋白尿患者是否发生CAU为因变量(赋值同上),以表4中分层处理后的7个预测变量为自变量构建多因素Logistic回归预测模型,结果显示,糖尿病病程≥10年、SBP≥140 mmHg、HbA1c≥7.0%、LDL-C≥1.8 mmol/L、Cys-C>1.09 mg/L、eGFR<60 mL·min-1·(1.73 m2)-1及合并DR是T2DM合并白蛋白尿患者发生CAU的危险因素(P<0.05,表5)。其中糖尿病病程5~<10年相较于<5年的OR值接近1(P=0.939)以及eGFR分层处理后P>0.05,皆无统计学意义,但考虑其均具有重要的临床意义,仍将其纳入模型。因此,根据上述7个预测变量的预测模型绘制基于Nomogram的列线图(图2)。
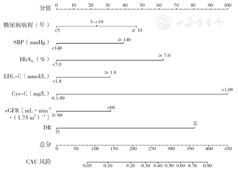

注:MAU=微量白蛋白尿,CAU=大量白蛋白尿;1 mmHg=0.133 kPa。

MAU进展至CAU预测变量的分层赋值表
The multi-layered assignment table of the predictive factors for progression from microalbuminuria to macroalbuminuria in type 2 diabetes patients
MAU进展至CAU预测变量的分层赋值表
The multi-layered assignment table of the predictive factors for progression from microalbuminuria to macroalbuminuria in type 2 diabetes patients
| 变量 | 赋值 |
|---|---|
| 糖尿病病程(年) | <5=1,5~<10=2,≥10=3 |
| SBP(mmHg) | <140=0,≥140=1 |
| HbA1c(%) | <7.0=0,≥7.0=1 |
| LDL-C(mmol/L) | <1.8=0,≥1.8=1 |
| Cys-C(mg/L) | ≤1.09=0,>1.09=1 |
| eGFR〔mL·min-1·(1.73 m2)-1〕 | <60=0,≥60=1 |
| DR | 是=1,否=0 |
影响MAU进展至CAU的多因素Logistic回归分析
Multivariate Logistic regression analysis of the influencing factors of progression from microalbuminuria to macroalbuminuria in type 2 diabetes patients
影响MAU进展至CAU的多因素Logistic回归分析
Multivariate Logistic regression analysis of the influencing factors of progression from microalbuminuria to macroalbuminuria in type 2 diabetes patients
| 变量 | β | Wald χ2值 | P值 | OR | 95%CI |
|---|---|---|---|---|---|
| 糖尿病病程(年) | |||||
| 5~<10 | -0.022 | 0.006 | 0.939 | 0.979 | (0.563,1.700) |
| ≥10 | 0.574 | 6.156 | 0.013 | 1.775 | (1.128,2.794) |
| SBP(mmHg) | |||||
| ≥140 | 0.555 | 9.446 | 0.002 | 1.742 | (1.223,2.482) |
| HbA1c(%) | |||||
| ≥7.0 | 0.833 | 8.238 | 0.004 | 2.301 | (1.302,4.065) |
| LDL-C(mmol/L) | |||||
| ≥1.8 | 0.438 | 4.073 | 0.044 | 1.550 | (1.013,2.371) |
| Cys-C(mg/L) | |||||
| >1.09 | 1.364 | 44.220 | <0.001 | 3.911 | (2.616,5.846) |
| eGFR〔mL·min-1·(1.73 m2)-1〕 | |||||
| ≥60 | -0.417 | 2.953 | 0.086 | 0.659 | (0.409,1.060) |
| DR | |||||
| 是 | 1.099 | 35.429 | <0.001 | 3.001 | (2.090,4.310) |
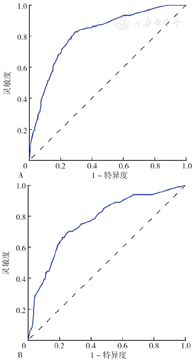
为了进一步评估该模型的实际预测效能,需要对模型的区分度和校准度进行内外部验。首先,利用ROC曲线面积(AUC)来分析模型的区分度,开发队列的AUC为0.814〔95%CI(0.782,0.846)〕,截断值为0.213(图3A);外部验证队列的AUC为0.768〔95%CI(0.713,0.823)〕,截断值为0.284(图3B),表明该预测模型具有比较优秀的区分度。

注:A为开发队列,B为验证队列。
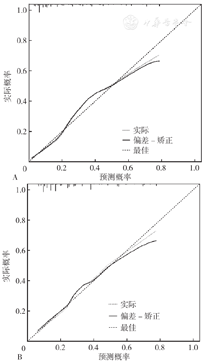
其次,利用校准曲线和H-L检验评估模型的校准度,如图4A和图4B所示,两者的校准曲线均显示该模型的预测概率比较接近于观察到的实际概率,一致性较高。同时,H-L检验(开发队列:χ2=13.186,P=0.065;验证队列:χ2=7.823,P=0.451)也显示该模型预测结局事件的预测概率与实际发生概率基本一致,拟合度较高。

注:A为开发队列,B为验证队列。
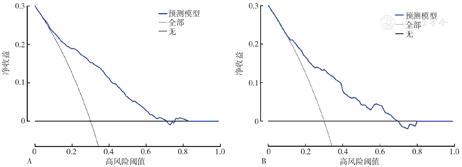
为了评估该模型的临床有效性,通过绘制DCA,进一步评估T2DM患者MAU进展至CAU风险列线图的临床净收益(图5A和图5B)。结果分析显示,在开发队列中,当阈值概率为0.08~0.74时,使用该列线图模型会比对所有患者实施或者不实施干预措施更有利,即净收益>0,而验证队列的阈值概率为0.14~0.70。

注:A为开发队列,B为验证队列。
本研究开发了一个包含糖尿病病程、SBP、HbA1c、LDL-C、Cys-C、eGFR以及是否合并DR的7个变量的列线图模型,模型的实际预测效能较优,开发队列和外部验证队列的AUC分别为0.814和0.768,校准曲线和H-L检验也显示基于该模型分析结局事件的实际发生概率与预测概率基本一致,DCA分析表明应用该模型可获得较高的临床净收益。对于T2DM合并白蛋白尿患者,依据该预测模型,通过降低血糖(HbA1c)、血压(SBP)、血脂(LDL-C)、改善肾脏功能(Cys-C和eGFR)以及预防DR,可有效降低T2DM患者MAU进展至CAU的风险。
研究表明,从诊断T2DM开始,出现MAU的每年发生率为2.0%,从MAU进展至CAU的每年发生率为2.8%,而从CAU发展到Scr升高(≥175 mmol/L)或肾代替治疗的每年发生率为2.3%;T2DM病程10年以上,MAU患病率为24.9%,CAU患病率为5.3%,Scr升高或肾代替治疗的患病率为0.8%以及其年死亡率为19.2%〔95%CI(14.0%,24.4%)〕[18]。另有研究表明,如果没有特殊的干预措施,将有20%~40%的MAU患者发展为CAU,但在T2DM患者进展为CAU的20年后,只有20%的患者会发展为ESRD[19]。本研究发现,与病程<5年的患者相比,病程≥10年的患者进展为CAU的风险分别是其1.775倍,表明糖尿病病程是T2DM患者MAU进展为CAU的重要危险因素,与DKD病程进展密切相关。
高血压是DKD发生、发展的重要危险因素[20,21],平均SBP≥140 mmHg(1 mmHg=0.133 kPa)和平均DBP≥80 mmHg与DKD患者较差的肾脏预后密切相关,严格控制血压可显著减轻UACR的恶化[22],并阻止或者延缓MAU进展至CAU或者ESRD[20]。大量临床研究发现,强化降压治疗不仅可以减轻蛋白尿,还可以降低ESRD发生率,甚至降低心血管不良事件及相关死亡的风险[23,24,25]。同时,高血压与胰岛素抵抗密切相关,是"代谢症候群"的一部分,DKD直接影响肾脏钠处理、血管顺应性及血管舒缩功能,从而导致高血压,因而使肾素-血管紧张素-醛固酮系统(RASS)直接参与了DKD发生、发展的生理病理学过程,而ACEI或ARB类药物能持续降低MAU进展为CAU的风险,实现降低血压和改善肾脏预后的目的[26]。我国及美国糖尿病学会(ADA)最新糖尿病肾病指南均建议,对于CAU患者,血压的控制目标为<130/80 mmHg[14,15]。
HbA1c是糖尿病患者蛋白尿发生或者恶化的独立危险因素,合理的血糖控制水平是防止MAU发生的有效措施,并可以阻止其进一步进展为CAU或者ESRD[27]。日本的J-DOIT3表明,与常规治疗(HbA1c<6.9%)相比,强化降糖治疗(HbA1c<6.2%)可使肾脏事件显著减少32%〔HR=0.68,95%CI(0.56,0.82),P<0.000 1〕,其中强化治疗组在干预结束时的白蛋白尿缓解率(MAU降为NAU或者CAU降为MAU/NAU即为缓解)为30.0%,而常规治疗组缓解率为16%(P<0.001),且在干预期间HbA1c每升高1%导致肾脏事件增加21%,HbA1c与调整基线相关风险因素后的肾脏结局风险呈显著相关(P=0.002)[28]。本研究发现,与HbA1c<7.0%相比,HbA1c≥7.0%的患者MAU进展为CAU的风险是其2.301倍(P=0.004),这进一步印证了HbA1c是DKD发生、发展的独立危险因素。目前,根据最新指南要求,对于T2DM合并白蛋白尿的患者,应在综合分析患者年龄、病程、合并症、并发症以及低血糖风险等后,制定出个体化的血糖控制目标[14,15]。
LDL-C作为血脂控制目标的重要指标之一[29],与糖尿病患者白蛋白尿的发生或进展密切相关,严格控制血脂异常(LDL-C<100 mg/dL)是防止MAU进展、延缓肾病进展到ESRD和降低心血管死亡率的有效措施[30]。意大利一项涉及14家糖尿病机构的多中心随机对照试验研究结果显示,与标准护理组相比,多因素强化治疗组(其中LDL-C<100 mg/dL)DKD患者主要致死/非致死性心血管事件风险降低53%〔调整后的HR=0.47,95%CI(0.30,0.74),P=0.001〕,全因死亡风险降低47%〔调整后的HR=0.53,95%CI(0.29,0.93),P=0.027〕[31]。同样,日本的J-DOIT3研究表明,与常规治疗(LDL-C<120 mg/dL)相比,强化降脂治疗(LDL-C<80 mg/dL)可使肾脏事件显著减少32%〔HR=0.68,95%CI(0.56,0.82),P<0.0001〕,且强化的多因素干预可显著减少白蛋白尿的发生和进展[28]。我国的糖尿病肾脏病防治指南建议,根据DKD患者的ASCVD风险进行分层,无ASCVD病史的LDL-C及非HDL-C水平均应<2.6 mmol/L;有明确ASCVD病史的LDL-C<1.8 mmol/L,非HDL-C<2.2 mmol/L[32]。
Cys-C和eGFR(Scr估算)是评估肾脏功能的重要指标,也是DKD发生、发展的独立危险因素[33,34],及时评估肾功能有助于预防白蛋白尿的发生及恶化,减缓或阻止进展为ESRD。最新研究表明,与Scr相比,Cys-C可作为糖尿病患者eGFR下降更理想的标志物,尤其对早期或者轻度DKD的诊断价值优于Scr,而对晚期或者重度DKD的诊断作用与Scr相当[33]。而且Cys-C水平随着白蛋白尿的增加而升高,并与UACR呈正相关(r=0.594,P<0.001)[35]。同样,eGFR作为诊断DKD的重要指标,eGFR<60 mL·min-1·(1.73 m2)-1持续3个月以上即可诊断为DKD[32],且与UACR密切相关[34]。本研究同样佐证了Cys-C和eGFR是白蛋白尿进展或恶化的重要危险因素,是评价肾功能恶化的重要指标。
DR与DKD具有相似的病理生理过程,两者互为危险因素,常伴随发生,且具有一定的平行性[36]。日本糖尿病并发症研究(JDCS)表明,与无DR的NAU组相比,有DR的NAU组、无DR的MAU组和有DR的MAU组患者进展为CAU的多变量调整风险比分别为2.48、10.40和11.55,且有DR组患者的eGFR每年下降速度是其他组的2~3倍[37]。本研究226例CAU患者中有135例(59.7%)出现了DR,680例MAU患者中有163例(24.0%)出现了DR,合并DR的MAU患者进展为CAU风险是单纯MAU患者的3.001倍(P<0.001),DR与蛋白尿的发生或恶化风险密切相关。
但是本研究仍有一些缺陷。首先,此研究仅构建T2DM患者MAU进展为CAU的风险预测模型,并不能为DKD进展为ESRD提供准确的预测作用,尚需更多研究完善该方面的模型;其次,本研究为回顾性研究,暂不能得出因果的结论,需要更多研究进行外部验证;最后,基线数据未纳入包含影响MAU进展为CAU的所有潜在变量,例如患者的心理健康状况、是否使用新型降糖药物以及其他可能影响结局的因素。
因此,基于7个预测变量(糖尿病病程、SBP、HbA1c、LDL-C、Cys-C、eGFR以及是否合并DR)的列线图模型,可根据每例患者的预测变量比较准确地预测其CAU发生风险,及时采取临床强化干预措施,能有效控制患者的高血压、高血糖、高血脂,阻止或者延缓其从MAU进展为CAU或恶化为ERSD,从而实现DKD的有效防治。
卢作维,曹宏伟,刘涛,等. 2型糖尿病患者微量白蛋白尿进展至大量白蛋白尿的风险预测模型研究[J].中国全科医学,2023,26(26):3259-3268. DOI:10.12114/j.issn.1007-9572.2023.0002. [www.chinagp.net]
LU Z W,CAO H W,LIU T,et al. Development and validation of a risk prediction model for the progression from microalbuminuria to macroalbuminuria in patients with type 2 diabetes mellitus[J]. Chinese General Practice,2023,26(26):3259-3268.
本文无利益冲突。



























