
为规范眩晕症的科学用药,中国医药教育协会眩晕专业委员会特成立专家小组,在纳入现有医学科学证据的基础上,结合专家丰富的临床经验,经反复讨论后形成《甲磺酸倍他司汀治疗眩晕症的专家共识》。本共识包括组胺类药物的药理基础以及甲磺酸倍他司汀在常见眩晕疾病(如良性阵发性位置性眩晕、梅尼埃病、前庭神经炎等)中的用药推荐等级、剂量、疗程、复查方法、特殊人群用药、药物不良反应等方面,旨在帮助医生提升临床实践水平。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
目前眩晕疾病发病率高,但诊治困难,在这种现状下,如何更加合理使用眩晕药物,目前尚无此类专家共识。甲磺酸倍他司汀是眩晕的常用药物之一。中国医药教育协会眩晕专业委员会拟从最常见的倍他司汀入手,关注眩晕的规范化药物治疗,旨在向临床医生和药学专家等提供眩晕药物的有关信息,提高对合理用药的认识,帮助管理眩晕患者的药物使用和基于临床实践的建议。
《甲磺酸倍他司汀治疗眩晕症的专家共识》由中国医药教育协会眩晕专业委员会各位专家,在纳入现有医学科学证据的基础上,结合专家丰富的临床经验,经反复磋商讨论后形成本共识,共识中有临床推荐等级及证据分级,见表1、表2。
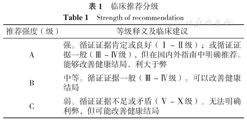
临床推荐分级
Strength of recommendation
临床推荐分级
Strength of recommendation
| 推荐强度(级) | 等级释义及临床建议 |
|---|---|
| A | 强。循证证据肯定或良好(Ⅰ~Ⅱ级);或循证证据一般(Ⅲ~Ⅳ级),但在国内外指南中明确推荐。能够改善健康结局,利大于弊 |
| B | 中等。循证证据一般(Ⅲ~Ⅳ级)。可以改善健康结局 |
| C | 弱。循证证据不足或矛盾(Ⅴ~Ⅹ级)。无法明确利弊,但可能改善健康结局 |
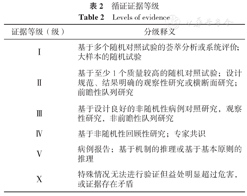
循证证据等级
Levels of evidence
循证证据等级
Levels of evidence
| 证据等级(级) | 分级释义 |
|---|---|
| Ⅰ | 基于多个随机对照试验的荟萃分析或系统评价;大样本的随机试验 |
| Ⅱ | 基于至少1个质量较高的随机对照试验;设计规范、结果明确的观察性研究或横断面研究;前瞻性队列研究 |
| Ⅲ | 基于设计良好的非随机性病例对照研究,观察性研究,非前瞻性队列研究 |
| Ⅳ | 基于非随机性回顾性研究;专家共识 |
| Ⅴ | 病例报告;基于机制的推理或基于基本原则的推理 |
| Ⅹ | 特殊情况无法进行验证但益处明显超过危害,或证据存在矛盾 |
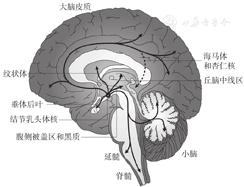
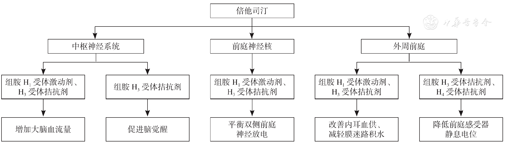
组胺是一类广泛分布于体内、具有多种生理活性的神经递质。中枢神经系统中,下丘脑的结节乳头体核(tuberomammillary nucleus,TMN)[1]中有大量组胺能神经元胞体集中分布,其发出的突起投射至中枢神经系统几乎所有的功能区,包括大脑皮质、杏仁核、纹状体、海马、黑质、视网膜和脊髓等。TMN有广泛的投射和联系系统(图1),可调节多种脑功能,如睡眠-觉醒、学习与记忆、神经内分泌、饮水摄食、感觉运动。目前已发现的组胺受体有H1、H2、H3、H4亚型[2]。中枢神经元中,H1、H2、H3受体均有表达。H1受体广泛分布于新皮层、海马、丘脑、下丘脑、杏仁核等脑区,激活该受体引起神经元兴奋[3],H2受体主要调节胃酸分泌,H3受体位于突触前膜,作为自身受体负反馈调节组胺的合成与释放,H3受体也存在于其他神经元末梢和某些细胞上,调节γ-氨基丁酸、去甲肾上腺素、乙酰胆碱等神经递质的释放[4]。

倍他司汀是组胺H1受体弱激动剂、H3受体强拮抗剂[5],具有扩张血管作用,有促进脑干、内耳血液循环,缓解血管痉挛并减轻膜迷路积水的作用。另外,还可抗血小板聚集、预防血栓形成[6]。
组胺受体影响前庭功能的可能机制有:(1)中枢觉醒水平;(2)中枢组胺的合成与释放;(3)前庭神经核兴奋性;(4)前庭神经兴奋性;(5)耳蜗微循环。
表3概述了组胺受体在前庭系统及相关脑区的分布、偶联G蛋白及下游信号转导通路、细胞功能分布以及影响前庭功能的可能作用机制[4,7,8,9,10,11,12,13]。
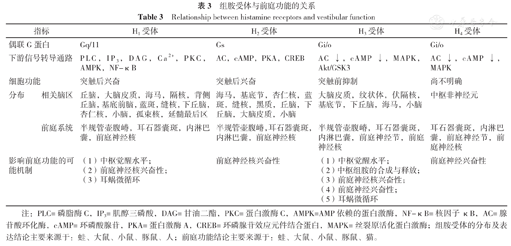
组胺受体与前庭功能的关系
Relationship between histamine receptors and vestibular function
组胺受体与前庭功能的关系
Relationship between histamine receptors and vestibular function
| 指标 | H1受体 | H2受体 | H3受体 | H4受体 | |
|---|---|---|---|---|---|
| 偶联G蛋白 | Gq/11 | Gs | Gi/o | Gi/o | |
| 下游信号转导通路 | PLC,IP3,DAG,Ca2+,PKC,AMPK,NF-κB | AC,cAMP,PKA,CREB | AC↓,cAMP↓,MAPK,Akt/GSK3 | AC↓,cAMP↓,MAPK | |
| 细胞功能 | 突触后兴奋 | 突触后兴奋 | 突触前抑制 | 尚不明确 | |
| 分布 | 相关脑区 | 丘脑,大脑皮质,海马,隔核,背侧丘脑,基底前脑,蓝斑,缝核,下丘脑,杏仁核,小脑,孤束核,延髓最后区 | 海马,基底节,杏仁核,蓝斑,缝核,黑质,丘脑,下丘脑,大脑皮质,小脑 | 大脑皮质,纹状体,伏隔核,基底节,下丘脑,海马,小脑 | 中枢非神经元 |
| 前庭系统 | 半规管壶腹嵴,耳石器囊斑,内淋巴囊,前庭神经核 | 半规管壶腹嵴,耳石器囊斑,内淋巴囊,前庭神经核 | 半规管壶腹嵴,耳石器囊斑,内淋巴囊,前庭神经节,前庭神经核 | 耳石器囊斑,内淋巴囊,前庭神经节,前庭神经核 | |
| 影响前庭功能的可能机制 | (1)中枢觉醒水平;(2)前庭神经核兴奋性;(3)耳蜗微循环 | 前庭神经核兴奋性 | (1)中枢觉醒水平;(2)中枢组胺的合成与释放;(3)前庭神经核兴奋性;(4)前庭神经兴奋性;(5)耳蜗微循环 | 前庭神经兴奋性 | |
注:PLC=磷脂酶C,IP3=肌醇三磷酸,DAG=甘油二酯,PKC=蛋白激酶C,AMPK=AMP依赖的蛋白激酶,NF-κB=核因子κB,AC=腺苷酸环化酶,cAMP=环磷酸腺苷,PKA=蛋白激酶A,CREB=环磷腺苷效应元件结合蛋白,MAPK=丝裂原活化蛋白激酶;组胺受体的分布及表达结论主要来源于:蛙、大鼠、小鼠、豚鼠、人;前庭功能结论主要来源于:蛙、大鼠、小鼠、豚鼠、猫。
倍他司汀可通过多种途径促进前庭代偿,见图2。

常用的倍他司汀药物包括甲磺酸倍他司汀〔N-甲基-2-吡啶乙胺二甲磺酸盐;分子式C8H12N2.2(CH4O3S);分子量328.41 g/mol〕和盐酸倍他司汀(N-甲基-2-吡啶乙胺二盐酸盐;分子式C8H12N2.2HCl;分子量209.12 g/mol),二者具有不同的盐化基团[14]。相比于盐酸倍他司汀,甲磺酸倍他司汀与受体(H1、H3)的结合率相对更高,且餐后用药的胃内溶解度更高[15]。甲磺酸倍他司汀与盐酸倍他司汀在临床用药适应证、安全性及不良反应等方面均相似[16]。
甲磺酸倍他司汀与盐酸倍他司汀的成盐基团(配体)不同,这也导致二者与受体相互作用的强弱有一定差别。使用Z-Dock方法对配体(甲磺酸和盐酸)与受体(H1、H3)之间的分子相互作用进行评价,甲磺酸倍他司汀在与H1和H3受体的对接模式中表现出更好的性能[17]。
由于胃液中存在盐酸,非盐酸盐(如甲磺酸)不如盐酸盐易受普通离子效应的影响。从药物溶解度角度来看,甲磺酸盐在pH值3~5的环境中溶解度更高,这是由于在该环境下其溶度积(Ksp)约为盐酸盐的12.5倍;甲磺酸盐相比于传统盐酸盐具有更高的溶解度并可能提供更高的生物利用度。因此,相比于餐前给药,甲磺酸倍他司汀在餐后胃液中的溶解度更高(餐后的pH值上升),药效更好[18]。
甲磺酸倍他司汀比盐酸倍他司汀的达峰时间更短、药物t1/2更长[15]。
推荐意见:(1)改善复位后有慢性头晕或者残留前庭症状的BPPV患者;(2)BPPV反复发作的预防性治疗。(A级推荐)
按照我国最新BPPV指南[26],BPPV主要治疗方法是手法复位,药物治疗主要是考虑BPPV可能合并其他眩晕疾病导致的内耳损害,这也跟BPPV复发有关[27],本专家共识明确指出倍他司汀可用于复位后有残存症状的患者。
根据国内外对后遗症状的分析发现,BPPV成功复位后的残留症状主要为头晕、不稳及颈部不适,且残留症状的发生率与患者复位次数有关[28,29]。多年来,国内外均有文献报道倍他司汀有缩短复位后BPPV患者残余头晕的持续时间、减轻残余头晕严重程度的作用[30,31],可单独使用[32,33]或联合其他治疗方法[34,35]。
治疗开始前评估:建议在初始治疗(手法复位)完成1周后。推荐评估手段:有条件的建议行眼性前庭诱发性肌源性电位检查(oVEMP)[36,37](B级推荐)和动静态平衡评估[38,39](B级推荐)。
治疗后:建议用药后每个月监测、复查,如功能完全恢复(oVEMP波幅对称、动静态平衡显示完全代偿,如改良感觉统合试验进入正常值)、症状完全缓解或患者不能获益(用药至3个月[31,35])则及时停药(B级推荐)。
推荐意见:用于预防梅尼埃病发作。常规剂量为18~36 mg/d[19,20],最大可达108 mg/d[21]。(A级推荐)
按照我国最新梅尼埃病指南[40],眩晕间歇期的治疗目的主要是控制或预防眩晕发作,除患者教育与生活治疗外,药物治疗首推倍他司汀。
还需要特别指出的是,倍他司汀对梅尼埃病的预防作用呈剂量-时长依赖效应,即强调大剂量、足疗程的药物治疗(即至少2片/次、3次/d,维持12个月),同时高剂量组发作次数最少[41]。如果高剂量3个月疗效不佳,可以将剂量提升至超高剂量(20~30片/d)[42,43]。但该作者最新的分剂量随机双盲研究表明,使用9个月后疾病发作明显得到控制,但与剂量无关[44]。然而,也有活体动物实验证明,倍他司汀对耳蜗血管纹的血流增加作用呈现剂量依赖效应[45]。因此,足疗程(每3个月评估、3~9个月)使用倍他司汀的推荐等级为A级,而大剂量使用因存在上述矛盾的证据,在梅尼埃病的治疗中推荐等级仅为B级。
用药前评估:建议在保证基础治疗(患者教育与生活治疗)的前提下,对仍在发作期的患者进行前庭功能评估后,开始维持性口服药物治疗。推荐评估手段:温度试验[46]和头脉冲试验[47,48](B级推荐);眩晕发作量表(可自行选择简单方便者)(B级推荐);动静态平衡评估[49,50](B级推荐)。耳蜗电图因其侵入性和复杂性,不适用于日常随访。
用药后每3个月复查,监测评估数据是否使患者获益[41],如6~9个月无获益,建议继续升阶治疗方案。如有明显改善,至少半年无发作,可减至常规剂量维持,直至停药。注意,每次减量或停药,均应在医生的随访和检查评估下进行。
推荐意见:鉴于对前庭性偏头痛认识的局限性,倍他司汀主要用于:(1)发作期症状控制;(2)促进前庭代偿。(B级推荐)
前庭性偏头痛是临床上常见的发作性前庭综合征之一,倍他司汀治疗前庭性偏头痛可行性仍存在争议。一方面,组胺系统在偏头痛发病机制中起到至关重要的作用,数个小样本药物临床试验已证实低剂量抗组胺药物可预防偏头痛发展,其机制被认为可能与拮抗组胺H3受体降低组胺水平及其他神经递质释放有关[51,52],而倍他司汀药理机制作用于多种组胺受体,其对偏头痛治疗潜在疗效评估尚需要相关随机对照试验支持;另一方面,前庭性偏头痛发作期存在外周性前庭系统损害的证据[53,54],且功能影像学证实前庭性偏头痛发作间期存在类似于外周前庭损害后的中枢代偿过程[55],倍他司汀具有调控外周前庭传入和促进前庭中枢代偿作用[5]。
推荐意见:改善眩晕症状及日常生活活动能力。(A级推荐)
前庭神经炎或急性单侧前庭病是常见的急性前庭综合征。前庭神经炎治疗包括急性期使用前庭抑制剂对症处理、糖皮质激素抗炎以及前庭康复治疗(vestibular rehabilitation therapy,VRT)。倍他司汀联合VRT[56]有助于促进外周性前庭损害后中枢前庭代偿[57,58]。随机、双盲、对照研究发现,与安慰剂组相比,倍他司汀缩短了大多数单侧前庭神经切断术患者静态姿势、眼动、空间感知觉以及患者对稳定性自我评估的恢复时间,也间接证实该药物在前庭神经核水平具有调控前庭张力失衡的功能[59]。随机对照试验结果显示前庭神经炎患者使用甲磺酸倍他司汀(12 mg/次,3次/d,疗程4周)可使眩晕症状较基线减轻70%,改善日常生活活动能力评分(activities of daily living,ADL),且促进神经-耳科体征的恢复[60]。而在药物安全性方面,EudraCT(2009-013702-14)研究中对前庭神经炎患者采用较大剂量倍他司汀(144 mg/d),在4周的疗程中显示出良好的安全性和耐受性。
推荐意见:(1)改善脑血流量;(2)前庭康复。(B级推荐)
倍他司汀为H1受体弱激动剂,可通过H1受体的激动作用促觉醒[61],同时对脑血管有舒张作用,以增加脑血流[59,62]。倍他司汀也是H3受体强拮抗剂,可通过对H3自身受体的拮抗作用增加组胺的合成与释放[63]。多项动物实验显示,甲磺酸倍他司汀可增加脑血流量,改善血管源性眩晕/头晕患者的眩晕症状,12 mg/次、3次/d的方案疗效更优[5,64,65,66,67]。
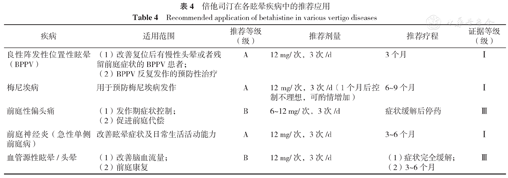
倍他司汀在各眩晕疾病的推荐应用见表4。
倍他司汀在各眩晕疾病中的推荐应用
Recommended application of betahistine in various vertigo diseases
倍他司汀在各眩晕疾病中的推荐应用
Recommended application of betahistine in various vertigo diseases
| 疾病 | 适用范围 | 推荐等级(级) | 推荐剂量 | 推荐疗程 | 证据等级(级) |
|---|---|---|---|---|---|
| 良性阵发性位置性眩晕(BPPV) | (1)改善复位后有慢性头晕或者残留前庭症状的BPPV患者;(2)BPPV反复发作的预防性治疗 | A | 12 mg/次,3次/d | 3个月 | Ⅰ |
| 梅尼埃病 | 用于预防梅尼埃病发作 | A | 12 mg/次,3次/d(1个月后控制不理想,可酌情增加) | 6~9个月 | Ⅰ |
| 前庭性偏头痛 | (1)发作期症状控制;(2)促进前庭代偿 | B | 6~12 mg/次,3次/d | 症状缓解后停药 | Ⅲ |
| 前庭神经炎(急性单侧前庭病) | 改善眩晕症状及日常生活活动能力 | A | 12 mg/次,3次/d | 3~6个月 | Ⅰ |
| 血管源性眩晕/头晕 | (1)改善脑血流量;(2)前庭康复 | B | 12 mg/次,3次/d | (1)症状完全缓解;(2)3~6个月 | Ⅲ |
老年患者,尤其是慢性肝肾功能损害患者,需酌情减量服用。
目前缺乏相关的可靠的参考文献。根据经验,儿童用药为C级推荐,证据等级Ⅴ级。孕妇及哺乳期妇女出于安全性考虑,不建议应用。
推荐意见:无论常规剂量还是高剂量(108 mg/次)的甲磺酸倍他司汀治疗眩晕症,安全性与耐受良好,不良反应发生率低。(A级推荐)
倍他司汀作为梅尼埃病与其他病因所致眩晕对症治疗的主要药物,具有良好的安全性与耐受,不良反应风险发生率低,部分报道显示倍他司汀与安慰剂治疗不良反应发生率相似[19,68,69,70,71]。在一项总病例为2 254例的研究中,26例(1.15%)发生不良反应,其中偶有(0.1%~5.0%)恶心、呕吐胃肠道不良反应,偶有(0.1%~5.0%)皮疹过敏反应[69]。
特殊人群中,妊娠期暴露于倍他司汀的妇女有先天性畸形的风险[72]。
一项双盲前瞻性随机交叉研究比较发现,测试前服用倍他司汀72 mg/次、3次/d的精神运动效应与安慰剂类似,提示倍他司汀对从事驾驶等特殊人群的安全性与耐受良好[73]。
甲磺酸倍他司汀在眩晕症的临床治疗中使用最多,但缺少规范,本专家共识就其常见的临床使用提出建议,提高对其合理用药的认识,以求规范化眩晕症患者的药物使用。另外,在控制患者眩晕症状的同时,本专家共识强调对前庭功能恢复程度的关注,并推荐将其作为复查评估的指标,以规范用药。
学术秘书:刘兴健(中国人民解放军总医院)
执笔人(按姓氏拼音排序):毕竞韬(首都医科大学附属北京同仁医院),戴晴晴(四川大学华西医院),冷杨名(华中科技大学同济医学院附属协和医院),李文妍(复旦大学附属眼耳鼻喉科医院),刘鹏(陕西省人民医院),任丽丽(中国人民解放军总医院),施天明(浙江省人民医院),王乐(空军军医大学西京医院),徐雪(中山大学附属第一医院),张红鸭(深圳大学总医院),赵秀丽(哈尔滨医科大学附属第一医院),赵雪柠(山东第一医科大学附属省立医院)
中国医药教育协会眩晕专业委员会.甲磺酸倍他司汀治疗眩晕症的专家共识[J].中国全科医学,2023,26(29):3591-3598. DOI:10.12114/j.issn.1007-9572.2023.0312. [www.chinagp.net]
The Vertigo Committee of the Chinese Medical Education Association. Expert consensus on betahistine mesylate in the treatment of vertigo[J]. Chinese General Practice,2023,26(29):3591-3598.
本文无利益冲突。本专家共识旨在通过制订策略、提供循证框架来帮助临床医生进行临床决策,不具法律效力。医生必须根据患者的个体情况选择最适合的治疗方案。遵守这些意见并不能确保患者在每种情况下均能获得满意的治疗效果。


























