
急进高原会引起急性低氧损伤,出现不同程度的临床症状,有些可能发展成急性重症高原反应。然而目前防治方法有限,缺乏安全有效的预防及减轻其严重程度的方法。
通过模拟4 400 m海拔低氧环境,探讨间歇性低氧训练(IH)预防急性低氧损伤的有效性和安全性。
于2022-08-01—10-31在北京小汤山医院采用公开募集的方式招募受试者40名为研究对象,将受试者随机分为两组:IH组(试验组,n=20)和假训练组(对照组,n=20)。试验组接受10 min低氧(氧浓度13%,模拟海拔3 800 m)间隔5 min常氧(氧浓度21%),共4个循环,总持续时间为55 min的IH暴露干预,2次/d,连续干预5 d。对照组接受同时长的常压常氧干预。IH干预训练结束后的第1天,受试者进入模拟高原低氧环境6 h,设置氧浓度为12%(相当于海拔4 400 m)。采用路易斯湖评分(LLS)评估受试者急性高原病(AMS)的严重程度。收集受试者基线、急性高原低氧环境模拟前、急性高原低氧环境模拟6 h后外周血氧饱和度(SpO2)、脑组织氧饱和度(ScO2)和颅内压(ICP)。
急性高原低氧环境模拟6 h后,试验组AMS发生率及LLS总分低于对照组(P<0.05)。急性高原低氧环境模拟6 h后试验组SpO2高于对照组(P<0.05)。组内比较结果显示,两组受试者在急性高原低氧环境模拟6 h后的SpO2及ScO2均较基线及急性高原低氧环境模拟前下降(P<0.05),试验组的急性高原低氧环境模拟6 h后较急性高原低氧环境模拟前SpO2下降幅度小于对照组〔(9.30±4.31)%与(13.10±6.66)%,P=0.039〕。对照组急性高原低氧环境模拟6 h后ICP较急性高原低氧环境模拟前升高(P<0.05)。
IH训练可以提高机体的耐缺氧能力,有效降低急性高原反应发生率及严重程度。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
现在越来越多的平原居住者因旅游、工作等原因进入高原地区,高原地区气压及氧含量较平原地区明显下降,会引发一系列的生理反应[1]。急进高原时对高原环境适应能力不足引起的一系列急性低氧应激反应,称为急性高原病(AMS)[2]。AMS多发生于非习服人群快速进入海拔2 500 m以上地区后,可表现为不同程度的头痛、恶心、嗜睡、头晕、眩晕、疲劳、虚弱和失眠等,严重者可能发展为高原肺水肿(HAPE)、高原脑水肿(HACE)等,其发生风险取决于个体易感性、海拔高度及登高速度等[3]。非习服者在2 500~3 000 m海拔的AMS发病率为10%~20%,在4 500~5 000 m海拔可达50%~85%[4]。AMS发病急且进展快,危及进入高原地区人员身体健康,同时直接影响工作及生活质量[5]。目前用于AMS预防和治疗的药物种类较多,主要包括口服乙酰唑胺、地塞米松等[2,6,7]。但有研究表明,急进高原时,乙酰唑胺对AMS的预防作用有限[8],地塞米松也因其不良反应较大而应用受限。
间歇性低氧(IH)训练是指在常氧状态下间歇性接受低氧暴露训练,造成体内适度缺氧,导致一系列有利于提高有氧代谢能力的抗缺氧生理、生化适应,提高机体的代谢能力。既往研究发现,短期IH可增加低氧化学敏感性、减少长期缺氧引起的炎症反应及血脂异常等[9,10]。越来越多的证据表明,短期IH可用于改善脊髓损伤患者的运动功能、提高运动员运动耐力等[11,12]。因此,本研究采用随机对照双盲的方法,通过模拟高海拔低氧环境,探讨IH对急性低氧损伤的保护作用。
于2022-08-01—10-31在北京小汤山医院采用公开募集的方式招募受试者40名为研究对象,将受试者随机分为两组:IH组(试验组,n=20)和假训练组(对照组,n=20)。纳入标准:(1)年龄18~45周岁;(2)安静状态下外周血氧饱和度(SpO2)≥90%,脑组织氧饱和度(ScO2)58%~82%,心率60~100次/min,血压90~139/60~89 mmHg(1 mmHg=0.133 kPa),呼吸频率16~20次/min;(3)常年居住平原地区,近6个月未曾到过海拔>1 500 m地区。排除标准:(1)处于经期、妊娠或哺乳期女性;(2)既往存在神经系统、心血管系统、呼吸系统疾病等,如脑血管疾病、高血压、冠心病、睡眠呼吸暂停综合征等;(3)既往有胸闷、胸痛病史;(4)存在明显出凝血机制和/或肝肾功能异常;(5)既往药物或酒精滥用史;(6)既往4周内参加过其他药物或医疗器械临床试验;(7)存在研究者认为不适宜试验的情况。本研究获得北京小汤山医院伦理委员会批准([2022]伦审第77号),受试者均自愿参与本研究并签署知情同意书。
本研究通过面罩式低氧设备实现受试者的IH暴露。常压环境下,该设备将环境空气与氮气混合以获得所需的吸入氧分压(FiO2),受试者通过面罩式呼吸器吸入氧气浓度降低的气体,达到模拟低氧环境的效果。在恢复期,受试者摘下面罩呼吸环境空气(正常氧)。在IH干预期间,受试者仰卧在床上休息,并在安静的环境中保持清醒,如出现头晕、头痛和心悸等明显的低氧相关不适症状,可摘下面罩。IH方案包括10 min低氧(氧浓度13%,模拟海拔3 800 m)间隔5 min常氧(氧浓度21%),共4个循环,总持续时间为55 min。试验组接受IH干预2次/d,对照组接受同时长的常压常氧干预,连续干预5 d。IH训练/假训练的氧浓度设置由经过培训的专业人员负责并完成。两组受试者均不知道自己接受哪种训练,采集和评估受试者信息的研究人员对受试者的训练情况不知情。
北京小汤山医院配备常压低氧舱,可通过设定氧浓度模拟海拔高度。IH干预训练结束后的第1天,受试者进入模拟高原低氧环境6 h,设置氧浓度为12%(相当于海拔4 400 m)。采用路易斯湖评分(LLS)评估受试者AMS的严重程度。LLS评估内容包括头痛、头晕、疲劳、消化道不适症状4个条目,每个条目按照无、轻、中、重划分为0~3分,共计12分,总分≥3分且有头痛症状者被认为存在AMS[13,14]。
采集受试者一般资料(年龄、身高、体质量、血压、心率、呼吸),并计算BMI。分别收集基线、急性高原低氧环境模拟前、急性高原低氧环境模拟6 h后受试者SpO2、ScO2和颅内压(ICP)。
受试者出现以下情况时研究终止:(1)SpO2<70%基础值,持续10 s;(2)心率>140次/min,持续10 s;(3)血压≥180/100 mmHg;(4)呼吸频率>30次/min;(5)心肌缺血的心电图表现伴胸痛、胸闷等临床症状;(6)恶性心律失常;(7)其他无法耐受的不适,如气促、头晕、头痛等。
采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以( ±s)表示,两组间比较采用独立样本t检验,组内干预前、后各指标比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
±s)表示,两组间比较采用独立样本t检验,组内干预前、后各指标比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
40名受试者均完成研究,两组受试者年龄、BMI、收缩压、舒张压、心率比较,差异无统计学意义(P>0.05),见表1。
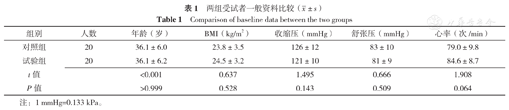
两组受试者一般资料比较( ±s)
±s)
Comparison of baseline data between the two groups
两组受试者一般资料比较( ±s)
±s)
Comparison of baseline data between the two groups
| 组别 | 人数 | 年龄(岁) | BMI(kg/m2) | 收缩压(mmHg) | 舒张压(mmHg) | 心率(次/min) |
|---|---|---|---|---|---|---|
| 对照组 | 20 | 36.1±6.0 | 23.8±3.5 | 126±12 | 83±10 | 79.0±9.8 |
| 试验组 | 20 | 36.1±6.2 | 24.5±3.2 | 121±10 | 81±9 | 84.6±8.7 |
| t值 | <0.001 | 0.637 | 1.495 | 0.666 | 1.908 | |
| P值 | >0.999 | 0.528 | 0.143 | 0.509 | 0.064 |
注:1 mmHg=0.133 kPa。
急性高原低氧环境模拟6 h后,试验组AMS发生率及LLS总分低于对照组,差异有统计学意义(P<0.05),见表2。

两组受试者AMS发生率及LLS比较
Comparison of AMS incidence and LLS between the two groups
两组受试者AMS发生率及LLS比较
Comparison of AMS incidence and LLS between the two groups
| 组别 | 人数 | AMS发生率〔名(%)〕 | LLS总分(分) |
|---|---|---|---|
| 对照组 | 20 | 10(50) | 2.30±1.89 |
| 试验组 | 20 | 2(10) | 1.30±0.98 |
| χ2(t)值 | 7.619 | 2.097a | |
| P值 | 0.006 | 0.045 |
注:AMS=急性高原病,LLS=路易斯湖评分;a表示t值。
基线、急性高原低氧环境模拟前两组受试者SpO2、ScO2、ICP比较,差异无统计学意义(P>0.05)。急性高原低氧环境模拟6 h后两组受试者ScO2、ICP比较,差异无统计学意义(P>0.05);试验组SpO2高于对照组,差异有统计学意义(P<0.05)。
组内比较结果显示,两组受试者在急性高原低氧环境模拟6 h后的SpO2及ScO2均较基线及急性高原低氧环境模拟前下降,差异有统计学意义(P<0.05),试验组的急性高原低氧环境模拟6 h后较急性高原低氧环境模拟前SpO2下降幅度小于对照组,差异有统计学意义〔(9.30±4.31)%与(13.10±6.66)%,P=0.039〕。对照组急性高原低氧环境模拟6 h后ICP较急性高原低氧环境模拟前升高,差异有统计学意义(P<0.05),见表3。
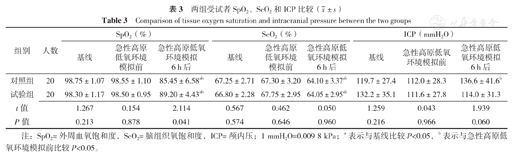
两组受试者SpO2、ScO2和ICP比较( ±s)
±s)
Comparison of tissue oxygen saturation and intracranial pressure between the two groups
两组受试者SpO2、ScO2和ICP比较( ±s)
±s)
Comparison of tissue oxygen saturation and intracranial pressure between the two groups
| 组别 | 人数 | SpO2(%) | ScO2(%) | ICP(mmH2O) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 基线 | 急性高原低氧环境模拟前 | 急性高原低氧环境模拟6 h后 | 基线 | 急性高原低氧环境模拟前 | 急性高原低氧环境模拟6 h后 | 基线 | 急性高原低氧环境模拟前 | 急性高原低氧环境模拟6 h后 | ||
| 对照组 | 20 | 98.75±1.07 | 98.55±1.10 | 85.45±6.58ab | 67.25±2.71 | 67.30±3.20 | 64.10±3.37ab | 119.7±27.4 | 112.0±28.3 | 136.6±41.6b |
| 试验组 | 20 | 98.30±1.17 | 98.50±0.95 | 89.20±4.43ab | 66.80±2.28 | 67.75±2.95 | 64.05±2.95ab | 132.2±35.1 | 111.6±27.8 | 114.0±31.3 |
| t值 | 1.267 | 0.154 | 2.114 | 0.567 | 0.462 | 0.050 | 1.259 | 0.043 | 1.939 | |
| P值 | 0.213 | 0.878 | 0.041 | 0.574 | 0.646 | 0.960 | 0.216 | 0.966 | 0.060 | |
注:SpO2=外周血氧饱和度,ScO2=脑组织氧饱和度,ICP=颅内压;1 mmH2O=0.009 8 kPa;a表示与基线比较P<0.05,b表示与急性高原低氧环境模拟前比较P<0.05。
IH是指周期性的接受常氧-低氧交替暴露。根据缺氧刺激的程度、缺氧循环时间及频率的不同,IH可对人体产生有益或不利影响[11]。长期慢性IH可能造成高血压、脑血管和/或冠状动脉疾病,导致发育迟缓、认知障碍以及由于持续缺氧发作的累积效应导致的神经系统退化[15]。但短期(5~10 min/次)、低频次(3~15次/d)、轻中度低氧(氧浓度9%~16%)的IH可通过激活低氧信号通路、抗氧化应激、减轻炎性损伤等,增加对低氧损伤的抵抗能力,发挥保护作用[16]。作为一种有前景的训练方法,IH训练可用于提高机体适应潜能,改善运动员的运动耐力[17,18]。随着对IH保护作用认识的深入,现已开展了一系列关于IH预防急性高原反应的研究[19,20]。尽管目前存在多种预防急性高原反应方案,但是关于IH适应的模式、参数尚未形成统一标准,且缺乏相关的理论支持。
本研究通过随机、对照、双盲的临床试验方法,采用短期、轻中度、低频率的IH训练模式,模拟高海拔低氧环境,并对SpO2、ScO2和ICP进行监测,证实IH可提高机体耐缺氧能力,减少急性高原反应的发生并减轻其严重程度。本研究40名受试者全部完成了IH干预/假干预,以及6 h的模拟高海拔低氧环境暴露,未出现HAPE、HACE。IH干预过程中,未报道不能耐受的低氧相关症状,IH训练前后,受试者的SpO2、ScO2无明显下降、ICP无显著升高,说明IH训练的安全性。
AMS是常见高原病,是由于对环境的习服适应机制尚未建立而发生的急性低氧损伤[3,21]。AMS症状可早至进入高原1~2 h内发生,有时也可延迟至6~12 h,高原低氧暴露时间较长会增加发生重型高原病的风险[22]。因此本研究采用6 h模拟高海拔低氧环境暴露作为观察终点,以LLS评估受试者AMS发生率及症状的严重程度。结果发现,试验组AMS发生率及严重程度明显低于对照组。
SpO2是机体缺氧的敏感指标,其变化反映了机体对低氧的耐受性[2,23]。在高原低氧环境下,由于吸入气体的氧分压降低,致使肺毛细血管与肺泡之间的氧分压差明显低于平原环境,导致在短时间内氧气不能完全弥散到毛细血管中,机体的SpO2呈现逐步下降的趋势。SpO2降低到一定程度可引起各器官组织氧供不足,从而产生功能或器质性变化而出现缺氧症状。研究表明,经过一段时间的低氧预习服后,机体对缺氧产生了一定的适应性,SpO2呈现逐渐升高的趋势[20]。本研究通过对受试者SpO2的监测发现,在6 h模拟高海拔低氧环境暴露下,试验组SpO2水平高于对照组,且与基线相比,试验组SpO2的下降幅度低于对照组,说明IH可提高受试者对低氧的耐受力[24]。急性低氧环境下降低的SpO2会减少机体组织的氧输送和氧利用,进而导致ScO2下降,其可作为临床监测脑自动调节功能的指标[25];但本研究未发现6 h的低氧暴露引起ScO2明显下降,可能是因为一定时间内脑组织相对周围组织可以维持更好的摄氧率,从而未引起局部脑血管对缺氧的反应性。
急性低氧会引起ICP升高,出现头痛、恶心、呕吐等症状,严重者出现脑水肿,可导致昏迷[26]。本研究发现,试验组在急性低氧暴露后ICP升高约2.4 mmH2O(1 mmH2O=0.009 8 kPa),对照组ICP升高约24.6 mmH2O。而与基线相比,IH训练未引起ICP增高,反而使其下降约20.6 mmH2O,因此该IH训练方案是安全可行的,对受试者生理功能可能存在有益影响。
本研究存在以下局限性:(1)受试者较少,且为单中心试验;(2)模拟高原环境为常压低氧环境,未增加低压因素;(3)模拟高原低氧环境暴露时间相对较短;(4)未能对IH的保护机制进行深入探讨。本课题组将在以后的研究中进一步扩大样本量,模拟高原低压低氧环境,多维度评估高原低氧损伤,深入探讨IH的保护作用机制。
综上所述,IH训练方案为10 min低氧(氧浓度13%,模拟海拔3 800 m)间隔5 min常氧(氧浓度21%),共4个循环,总持续时间为55 min,干预2次/d,连续干预5 d可有效降低急性高原低氧环境模拟6 h的4 400 m海拔低氧环境下AMS发生率和严重程度。此外,IH训练可减少由急性低氧暴露引起的SpO2、ScO2降低并有效减少ICP的增高。综上,IH训练对急性高原低氧损伤具有保护作用。
黄丹,张琪涵,宋歌,等.间歇性低氧训练预防急性低氧损伤有效性和安全性的研究[J].中国全科医学,2023,26(29):3640-3644. DOI:10.12114/j.issn.1007-9572.2023.0164. [www.chinagp.net]
HUANG D,ZHANG Q H,SONG G,et al. Efficacy and safety of intermittent hypoxic training in the prevention of acute hypoxic injury[J]. Chinese General Practice,2023,26(29):3640-3644.
本文无利益冲突。



























