
心力衰竭(HF)由于其高发病率、高死亡率和不良预后,是心血管领域急需解决的主要难题之一。探寻最佳的风险评估方法是目前本领域的研究方向。近年来研究发现炎症是HF发生和发展的重要病理生理机制之一,多种炎性指标的检测和评估可能是预测HF转归的重要方法,探究简便易行、综合性能最佳的炎性预测指标逐渐成为人们关注的重点。
探讨外周血(中性粒细胞+单核细胞)/淋巴细胞比值(NMLR)对HF患者住院死亡的预测价值。
纳入2020年1月—2022年9月濮阳市油田总医院住院的HF患者583例。根据患者是否出现住院死亡分为生存组(n=564)与死亡组(n=19),收集患者基线资料包括人口学特征、合并症、HF原发疾病、实验室检查结果;采用多因素Cox比例风险回归分析探究HF患者住院死亡的影响因素,采用限制性立方样条(RCS)确定NMLR与HF患者住院死亡的关系;绘制受试者工作特征(ROC)曲线探究NMLR对HF患者住院死亡的预测价值并计算最佳截断值;采用Kaplan-Meier法绘制不同NMLR水平患者的生存曲线。
死亡组入院时NMLR〔8.36(3.15,9.55)〕高于生存组〔5.00(3.23,8.72)〕(P<0.05)。多因素Cox比例风险回归分析结果显示,NMLR是HF患者住院死亡的影响因素〔HR=1.003,95%CI(1.001,1.005),P<0.05〕。NMLR预测HF患者住院死亡的ROC曲线下面积为0.704〔95%CI(0.652,0.757)〕,最佳截断值为7.93。RCS显示NMLR与HF患者住院死亡风险呈非线性正相关(P<0.05)。NMLR≥7.93者的住院生存率低于NMLR<7.93者(χ2=111.843,P<0.001)。
入院时NMLR升高可能是HF患者住院死亡的独立预测因素。

本刊2023年版权归中国全科医学杂志社所有
未经编辑部许可,不得任意转载和摘编
本刊所发表作品仅为作者观点,并不代表编委会和编辑部意见
如有印装质量问题请向本刊发行部调换
心力衰竭(HF)是指心脏结构或功能异常导致心室收缩或充盈障碍,并引起各种症状和体征的复杂临床综合征。根据《2022ACC/AHA/HFSA指南:心力衰竭的管理》[1]及《年慢性心力衰竭加重患者的综合管理中国专家共识2022》[2],截止到2017年美国HF患者约120万;中国25岁及以上人群中HF患者达1 205万人[1,2]。由于全球人口老龄化加剧、并存疾病、危险因素的增加以及心肌梗死后患者生存时间延长,HF患病率呈逐年增加趋势[3]。虽然过去10年HF的治疗策略不断改进,仍有多达1/3的患者确诊后生存期不超过1年[4]。所以尽早发现HF及准确的临床评估非常重要。目前常用的临床指标有C反应蛋白、脑钠肽、白介素6、肌钙蛋白T,但存在医保基金负担重、结果耗时长等缺点。
研究发现,炎症反应是HF发生及发展的重要机制之一,(中性粒细胞+单核细胞)/淋巴细胞比值(NMLR)是一种炎性指标,指外周血中性粒细胞和单核细胞计数总和与淋巴细胞计数的比值。研究证明,NMLR是心肌梗死住院死亡的独立预测因素[5],且可能是慢性心血管疾病死亡的独立预测因子[6]。到目前为止尚未发现NMLR评估及预测HF患者近、远期预后的大规模临床研究。本文通过收集分析本院HF患者的相关数据,探讨NMLR对HF患者住院死亡风险的预测价值。
收集2020年1月—2022年9月因HF入住濮阳市油田总医院583例患者的临床资料。纳入标准:(1)因HF入院,HF诊断标准遵循《中国心力衰竭诊断和治疗指南2018》 [7],多次入院者纳入首次入院数据;(2)年龄≥18周岁;(3)入院24 h内有血常规、肝肾功能等相关检验结果;(4)能够完成随访。排除标准:(1)基本信息、生命体征等信息缺失者;(2)肿瘤患者。
收集患者首次入院24 h内的数据(如有多个数据,则取其平均值),包括人口统计学特征(年龄、性别)、生命体征(心率、平均动脉压、呼吸频率、体温)、合并症(感染、糖尿病、高血压、慢性阻塞性肺疾病、肺循环障碍、心律失常、瓣膜病、外周血管病、脑血管病、肾衰竭、肝病、肥胖症)、HF原发疾病(风湿性心脏病、冠心病、肺源性心脏病)、实验室检查结果(阴离子间隙、肌酐、葡萄糖、血红蛋白、凝血酶原时间、钠、钾、尿素氮);中性粒细胞计数、单核细胞计数、淋巴细胞计数,计算NMLR。为减少分析数值偏倚,删除缺失>20%的值的变量;缺失的变量值≤20%且呈正态分布的连续变量用平均值或中位数代替。
研究终点是住院期间全因死亡。根据是否发生住院死亡将患者分为死亡组(n=19)和生存组(n=564)。
采用SPSS 24.0软件进行统计分析,采用R 4.2.1软件计算并绘制限制性立方样图(RCS)。采用Kolmogorov-Smirnov(K-S法)检验对连续变量进行正态分布检验。符合正态分布的连续变量采用( ±s)表示;非正态分布的连续变量用M(P25,P75)表示,组间比较采用秩和检验;分类变量以百分比表示,组间比较采用χ2检验。采用单因素和多因素Cox比例风险回归分析确定HF患者住院死亡的影响因素;采用受试者工作特征(ROC)曲线分析中性粒细胞、单核细胞、淋巴细胞、NMLR预测HF患者住院死亡的价值;根据约登指数确定最佳截断值,采用Delong检验比较不同指标的预测价值;基于之前建立的多变量Cox回归模型,采用RCS评估NMLR与HF患者住院死亡的关系。根据通过ROC曲线计算出的NMLR最佳截断值(7.93)分组,绘制Kaplan-Meier曲线(生存曲线)并比较两组生存率的差异。以P<0.05为差异有统计学意义。
±s)表示;非正态分布的连续变量用M(P25,P75)表示,组间比较采用秩和检验;分类变量以百分比表示,组间比较采用χ2检验。采用单因素和多因素Cox比例风险回归分析确定HF患者住院死亡的影响因素;采用受试者工作特征(ROC)曲线分析中性粒细胞、单核细胞、淋巴细胞、NMLR预测HF患者住院死亡的价值;根据约登指数确定最佳截断值,采用Delong检验比较不同指标的预测价值;基于之前建立的多变量Cox回归模型,采用RCS评估NMLR与HF患者住院死亡的关系。根据通过ROC曲线计算出的NMLR最佳截断值(7.93)分组,绘制Kaplan-Meier曲线(生存曲线)并比较两组生存率的差异。以P<0.05为差异有统计学意义。
本研究共纳入583例患者,其中男328例(56.3%),女255例(43.7%);患者中位年龄72.9(65.1,80.6)岁。两组患者合并感染比例、糖尿病比例、肺循环障碍比例、周围血管病比例、脑血管病比例、肾衰竭比例、心率、呼吸频率、血红蛋白、阴离子间隙、尿素氮、肌酐、中性粒细胞计数、单核细胞计数、淋巴细胞计数、NMLR比较,差异均有统计学意义(P<0.05),见表1。
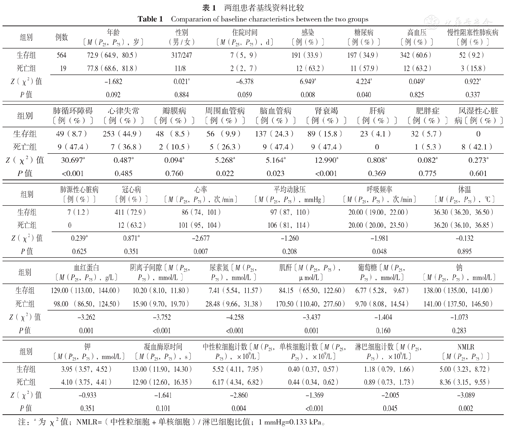
两组患者基线资料比较
Compararion of baseline characteristics between the two groups
两组患者基线资料比较
Compararion of baseline characteristics between the two groups
| 组别 | 例数 | 年龄〔M(P25,P75),岁〕 | 性别(男/女) | 住院时间〔M(P25,P75),d〕 | 感染〔例(%)〕 | 糖尿病〔例(%)〕 | 高血压〔例(%)〕 | 慢性阻塞性肺疾病〔例(%)〕 |
|---|---|---|---|---|---|---|---|---|
| 生存组 | 564 | 72.9(64.9,80.5) | 317/247 | 7(5,9) | 191(33.9) | 197(34.9) | 342(60.6) | 52(9.2) |
| 死亡组 | 19 | 77.8(68.6,81.8) | 11/8 | 2(2,7) | 12(63.2) | 11(57.9) | 12(63.2) | 3(15.8) |
| Z(χ2)值 | -1.682 | 0.021a | -6.378 | 6.949a | 4.224a | 0.049a | 0.922a | |
| P值 | 0.092 | 0.884 | 0.059 | 0.008 | 0.040 | 0.825 | 0.337 |
| 组别 | 肺循环障碍〔例(%)〕 | 心律失常〔例(%)〕 | 瓣膜病〔例(%)〕 | 周围血管病〔例(%)〕 | 脑血管病〔例(%)〕 | 肾衰竭〔例(%)〕 | 肝病〔例(%)〕 | 肥胖症〔例(%)〕 | 风湿性心脏病〔例(%)〕 |
|---|---|---|---|---|---|---|---|---|---|
| 生存组 | 49(8.7) | 253(44.9) | 48 (8.5) | 56 (9.9) | 137(24.3) | 89(15.8) | 23(4.1) | 32(5.7) | 0 |
| 死亡组 | 9(47.4) | 7(36.8) | 2(10.5) | 5(26.3) | 9(47.4) | 9(47.4) | 0 | 1(5.3) | 8(42.1) |
| Z(χ2)值 | 30.697a | 0.487a | 0.094a | 5.268a | 5.164a | 12.990a | 0.808a | 0.082a | 0.273a |
| P值 | <0.001 | 0.485 | 0.760 | 0.022 | 0.023 | <0.001 | 0.369 | 0.775 | 0.601 |
| 组别 | 肺源性心脏病〔例(%)〕 | 冠心病〔例(%)〕 | 心率〔M(P25,P75),次/min〕 | 平均动脉压〔M(P25,P75),mmHg〕 | 呼吸频率〔M(P25,P75),次/min〕 | 体温〔M(P25,P75),℃〕 |
|---|---|---|---|---|---|---|
| 生存组 | 7(1.2) | 411(72.9) | 86(74,101) | 97(87,110) | 20.00(19.00,22.00) | 36.30(36.20,36.50) |
| 死亡组 | 0 | 12(63.2) | 101(95,104) | 106(81,114) | 20.00(20.00,23.50) | 36.20(36.10,36.85) |
| Z(χ2)值 | 0.239a | 0.871a | -2.677 | -1.260 | -1.981 | -0.132 |
| P值 | 0.625 | 0.351 | 0.007 | 0.208 | 0.048 | 0.895 |
| 组别 | 血红蛋白〔M(P25,P75),g/L〕 | 阴离子间隙〔M(P25,P75),mmol/L 〕 | 尿素氮〔M(P25,P75),mmol/L 〕 | 肌酐〔M(P25,P75),μmol/L〕 | 葡萄糖〔M(P25,P75),mmol/L〕 | 钠〔M(P25,P75),mmol/L〕 |
|---|---|---|---|---|---|---|
| 生存组 | 129.00(113.00,144.00) | 10.20(8.10,11.80) | 7.41(5.54,11.57) | 84.15 (65.50,122.60) | 6.77(5.28, 9.67) | 138.00(135.00,141.00) |
| 死亡组 | 98.00 (86.50,124.50) | 15.90(9.70,19.70) | 28.48(9.66,31.38) | 170.50(110.40,277.60) | 9.70(8.08,14.54) | 141.00(137.50,146.50) |
| Z(χ2)值 | -3.262 | -3.752 | -4.258 | -3.437 | -1.404 | -1.073 |
| P值 | 0.001 | <0.001 | <0.001 | 0.001 | 0.160 | 0.283 |
| 组别 | 钾〔M(P25,P75),mmol/L〕 | 凝血酶原时间〔M(P25,P75),s〕 | 中性粒细胞计数〔M(P25,P75),×109/L〕 | 单核细胞计数〔M(P25,P75),×109/L〕 | 淋巴细胞计数〔M(P25,P75),×109/L〕 | NMLR〔M(P25,P75)〕 |
|---|---|---|---|---|---|---|
| 生存组 | 3.95(3.57,4.52) | 13.00(11.90,14.30) | 5.52(4.11,7.95) | 0.40(0.37,0.57) | 1.18(0.79,1.66) | 5.00(3.23,8.72) |
| 死亡组 | 4.10(3.75,4.41) | 12.90(12.60,16.35) | 6.17(4.34,6.82) | 0.44(0.34,0.62) | 0.89(0.73,1.73) | 8.36(3.15,9.55) |
| Z(χ2)值 | -0.933 | -1.641 | -2.860 | -1.369 | -2.005 | -3.089 |
| P值 | 0.351 | 0.101 | 0.004 | <0.001 | 0.045 | 0.002 |
注:a为χ2值;NMLR=(中性粒细胞+单核细胞)/淋巴细胞比值;1 mmHg=0.133 kPa。
以是否发生住院死亡(赋值:是=1,否=0)为因变量,以2.1中差异有统计学意义的变量感染、糖尿病、肺循环障碍、周围血管病、脑血管病、肾衰竭(以上赋值:是=1,否=0)、心率、呼吸频率、血红蛋白、阴离子间隙、尿素氮、肌酐、中性粒细胞计数、单核细胞计数、淋巴细胞计数、NMLR(以上赋值:实测值)为自变量,进行单因素Cox比例风险回归分析,结果显示,感染、肺循环障碍、周围血管病、肾衰竭、心率、血红蛋白、阴离子间隙、尿素氮、中性粒细胞、单核细胞、淋巴细胞、NMLR是HF患者住院死亡影响因素(P<0.05);将单因素分析中有意义的变量纳入多因素Cox比例风险回归分析,结果显示,血红蛋白、阴离子间隙、中性粒细胞、单核细胞、淋巴细胞、NMLR等是HF患者住院死亡的影响因素(P<0.05),见表2。
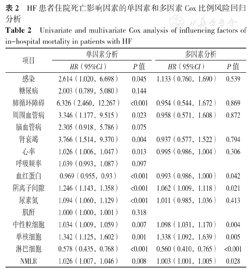
HF患者住院死亡影响因素的单因素和多因素Cox比例风险回归分析
Univariate and multivariate Cox analysis of influencing factors of in-hospital mortality in patients with HF
HF患者住院死亡影响因素的单因素和多因素Cox比例风险回归分析
Univariate and multivariate Cox analysis of influencing factors of in-hospital mortality in patients with HF
| 项目 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 感染 | 2.614(1.020,6.698) | 0.045 | 1.133(0.760,1.690) | 0.539 |
| 糖尿病 | 2.003(0.789,5.080) | 0.144 | ||
| 肺循环障碍 | 6.326(2.460,12.267) | <0.001 | 0.954(0.544,1.672) | 0.869 |
| 周围血管病 | 3.346(1.177,9.515) | 0.023 | 0.958(0.571,1.608) | 0.872 |
| 脑血管病 | 2.305(0.918,5.786) | 0.075 | ||
| 肾衰竭 | 3.766(1.514,9.370) | 0.004 | 0.937(0.577,1.522) | 0.794 |
| 心率 | 1.026(1.006,1.047) | 0.013 | 0.995(0.986,1.004) | 0.306 |
| 呼吸频率 | 1.039(0.993,1.087) | 0.097 | ||
| 血红蛋白 | 0.969(0.955,0.93) | <0.001 | 0.993(0.986,1.000) | 0.042 |
| 阴离子间隙 | 1.246(1.143,1.358) | <0.001 | 1.062(1.009,1.118) | 0.021 |
| 尿素氮 | 1.094(1.060,1.129) | <0.001 | 1.011(0.985,1.036) | 0.413 |
| 肌酐 | 1.000(1.000,1.001) | 0.318 | ||
| 中性粒细胞 | 1.034(1.009,1.059) | 0.007 | 1.098(1.031,1.170) | 0.004 |
| 单核细胞 | 1.342(1.125,1.602) | 0.001 | 1.338(1.092,1.639) | 0.005 |
| 淋巴细胞 | 0.578(0.435,0.768) | <0.001 | 0.560(0.410,0.765) | <0.001 |
| NMLR | 1.026(1.007,1.046) | 0.008 | 1.003(1.001,1.005) | 0.028 |
NMLR预测HF患者住院死亡的ROC曲线下面积(AUC)为0.704〔95%CI(0.652,0.757)〕,最佳截断值为7.93;单核细胞计数预测HF患者住院死亡的AUC为0.585〔95%CI(0.525,0.646)〕;中性粒细胞计数预测HF患者住院死亡的AUC为0.620〔95%CI(0.563,0.676)〕;淋巴细胞计数预测HF患者住院死亡的AUC为0.341〔95%CI(0.289,0.393)〕;NMLR预测HF患者住院死亡的AUC高于中性粒细胞计数,差异有统计学意义(Z=3.75,P<0.05),见图1、表3。
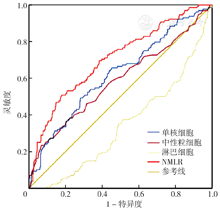

注:NMLR=(中性粒细胞+单核细胞)/淋巴细胞比值。
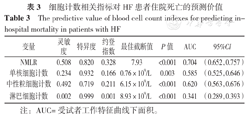
细胞计数相关指标对HF患者住院死亡的预测价值
The predictive value of blood cell count indexes for predicting in-hospital mortality in patients with HF
细胞计数相关指标对HF患者住院死亡的预测价值
The predictive value of blood cell count indexes for predicting in-hospital mortality in patients with HF
| 变量 | 灵敏度 | 特异度 | 约登指数 | 最佳截断值 | P值 | AUC | 95%CI |
|---|---|---|---|---|---|---|---|
| NMLR | 0.508 | 0.820 | 0.328 | 7.93 | <0.001 | 0.704 | (0.652,0.757) |
| 单核细胞计数 | 0.234 | 0.932 | 0.166 | 0.76×109/L | 0.003 | 0.585 | (0.525,0.646) |
| 中性粒细胞计数 | 0.492 | 0.719 | 0.211 | 6.15×109/L | <0.001 | 0.620 | (0.563,0.676) |
| 淋巴细胞计数 | 0.002 | 0.999 | 0.001 | 8.93×109/L | <0.001 | 0.341 | (0.289,0.393) |
注:AUC=受试者工作特征曲线下面积。
NMLR与HF住院死亡风险存在非线性正相关关系(P<0.05);当NMLR>7.93时,随着NMLR的增大HF患者住院死亡风险也会迅速增大,见图2。
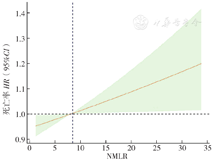

注:图中HR以红色实线表示,95%CI以绿色阴影区域表示。
通过ROC曲线计算出来的NMLR的最佳截断值(7.93)将患者分为高NMLR者(NMLR≥7.93)和低NMLR者(NMLR<7.93),绘制Kaplan-Meier曲线(生存曲线),结果显示高NMLR者的生存率低于低NMLR者,差异有统计学意义(χ2=111.843,P<0.001),见图3。
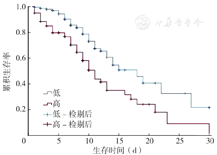

HF作为各种心脏疾患的终末阶段,表现为极高的死亡率和极差的临床预后。本研究结果显示,患者首次住院死亡率为3.3%。既往文献报道2%~17%的患者在第1次住院期间死亡;而超过50%的患者则在5年内死亡[8],本研究结果与之一致。近年来对于HF患者的规范化管理有很多研究,但其死亡率和住院负担并未明显减轻[9]。因此,准确评估HF患者的再住院、死亡风险及近远期预后仍是未来相当长一段时间内临床工作中亟待解决的关键问题。所以,积极探寻有效的预测指标评估HF患者死亡风险具有重要的临床意义。
NMLR是一种新型的可以预测炎症和免疫反应相关疾病预后的炎症指标。一项对派姆单抗治疗的细胞程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)高表达非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者的研究证实了NMLR作为炎症指标对患者生存结果的预测价值[10]。LIAO等[11]发现,NMLR对接受肝切除术的肝癌患者术后预后有很好的预测价值,且比其他免疫参数具有更准确的预测能力。另外一项对523例80岁以上心肌梗死患者的研究发现,不同白细胞亚型是老年心肌梗死患者死亡的独立预测因子,NMLR预测价值高于其他白细胞亚型[6]。而WANG等[5]通过大量数据证实,入院时NMLR升高是急性心肌梗死患者住院死亡风险升高的独立预测因素,且其效能优于其他相关指标。以上研究均表明,NMLR不仅对免疫性疾病、肿瘤具有预测价值,而且在心血管疾病中也有一定的预测价值。中性粒细胞、单核细胞和淋巴细胞组成的白细胞集合是免疫功能和炎症反应的关键标志物,覆盖较全面,所以基于以上相关研究,本研究探讨了NMLR对HF患者住院死亡的预测价值。本研究结果显示,合并症、实验室检查结果可能是潜在的危险因素;多因素Cox比例风险回归分析结果提示,NMLR是HF患者住院死亡的影响因素。
本研究基线资料分析结果显示,HF患者死亡组NMLR高于生存组。有研究表明,HF的发生、发展与炎症反应相关,而炎症反应的发生与中性粒细胞、淋巴细胞数量异常相关[12]。中性粒细胞计数可以代表系统炎症反应的恶化程度,中性粒细胞绝对值越高一般提示心肌组织破坏越严重、左心室射血功能越差、患者预后也就越差[13],因为中性粒细胞介导的免疫相关性血栓形成是导致HF的关键机制[14];淋巴细胞计数减少提示了机体对应激反应的程度,该值越低表明机体应激的程度越高、心肌的耗氧量越大、心功能不全的发生及加重的可能性越大[13]。VADUGANATHAN等[15]发现,淋巴细胞计数降低与HF患者死亡率增加独立相关。本研究中死亡组患者淋巴细胞计数低于生存组,与既往研究结果一致[15],同时死亡组中性粒细胞计数高于生存组,提示淋巴细胞计数及中性粒细胞计数与HF患者的死亡相关;多因素Cox比例风险回归分析结果显示,淋巴细胞计数及中性粒细胞计数可能是HF患者住院死亡的影响因素。有研究报道,单核细胞数量增加与HF严重程度及HF远期预后密切相关[16,17];本研结果提示,单核细胞计数可作为HF死亡的独立预测因素,这可能与单核细胞活化后会促进氧化应激及炎症反应相关[18]。相关研究发现,在入院治疗的慢性HF患者中,风湿性心脏病、肺源性心脏病及冠心病是其主要和常见的原发病[19]。但本研究发现HF原发病(风湿性心脏病、慢性肺源性心脏病、冠心病)比例在两组中比较,差异均无统计学意义,这可能与样本量偏少相关。本文Cox比例风险回归分析结果显示,无论混杂因素是否调整,NMLR都是HF患者住院死亡的独立相关因素。在临床实践中,血液生物标志物作为预后因素具有争议性和限制性的问题之一是确定最佳截断值。本研究ROC曲线结果显示,NMLR预测HF患者住院死亡的AUC(0.704)明显高于其他外周血白细胞计数相关的指标,其最佳截断值为7.93,灵敏度为0.508,特异度为0.820,说明NMLR对住院死亡具有相对较高的预测价值。RCS显示,NMLR与住院死亡呈非线性正相关,而Kaplan-Meier曲线(生存曲线)显示NMLR越高者HF住院死亡率越高。
本研究得益于本院较为充分的原始资料,在一定程度上减小了数据偏差,因而结果较为可信。鉴于NMLR相比于C反应蛋白、脑钠肽等指标可更容易、更快速获得,因此可用作对HF患者的快速评估。本研究不足之处为单中心研究,可能受某些数据不完善使用中位数或平均数替代可能造成结果偏差等,将来需要更多完整数据及前瞻性研究验证其结果。另外,后续研究需要收集更多出院后随访数据补充完善;如果对本文数据进行进一步的分层研究,结果可能对临床医师更具指导价值。
本研究结果提示,入院时NMLR可能是HF患者住院死亡的预测因素;且NMLR与HF患者住院死亡呈非线性正相关。
马艳艳,任付先,王宇,等. (中性粒细胞+单核细胞)/淋巴细胞比值对心力衰竭患者住院死亡的预测价值研究[J].中国全科医学,2023,26(30):3791-3796. DOI:10.12114/j.issn.1007-9572.2023.0198.[www.chinagp.net]
MA Y Y,REN F X,WANG Y,et al. The prediction value of(neutrophil+monocyte)/lymphocyte ratio on in-hospital mortality of heart failure patients[J]. Chinese General Practice,2023,26(30):3791-3796.
本文无利益冲突。































