
肿瘤和肿瘤治疗相关的呼吸道瘘比较罕见,对病情的预后产生重大的影响。本文通过分析1例弥漫大B细胞淋巴瘤患者化疗后出现多发气管/支气管-纵隔瘘的临床资料及诊治过程。检索中英文数据库,对肿瘤和肿瘤治疗相关的呼吸道瘘情况进行分析总结。本病例为76岁男性,呼吸困难20余天,CT提示:纵隔多发淋巴结肿大,气管、右侧主支气管受压狭窄,双肺多发结节,脾巨大占位性病变。右锁骨上淋巴结活检确诊弥漫大B细胞淋巴瘤,使用甲强龙及1个疗程环磷酰胺联合阿霉素化疗后,复查胸部CT及气管镜,发现多发气管/支气管-纵隔瘘。患者放弃进一步治疗,并于出院后2个月死亡。可继发呼吸道瘘的肿瘤相关治疗方式主要包括手术、化疗、靶向治疗及化疗或靶向治疗联合放疗。大部分通过消解肿瘤组织引起相邻器官之间的瘘道,而贝伐珠单抗更多的是通过引起食管炎、食管狭窄、食管糜烂等,最终导致气管食管瘘。新发的呼吸道瘘往往合并肿瘤进展,患者预后极差。在治疗前评估患者治疗相关呼吸道瘘发生的概率,对方案选择及患者的预后具有重要意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
化疗是晚期实体肿瘤、血液系统肿瘤治疗的重要手段[1,2,3]。瘤体减小甚至消失是化疗有效的重要表现。但在罕见情况下,瘤体消减可能带来其他的治疗难题,如气管、支气管瘘。本文报道1例化疗后气管/支气管-纵隔瘘患者,并进行文献复习。本研究内容符合《赫尔辛基宣言》原则。
患者男,76岁,因"呼吸困难20余天"于2018年4日26日入院。患者20余天前无明显诱因出现呼吸困难,为活动后呼吸困难,无咳嗽、发热、胸痛等。外院胸部CT提示:纵隔多发淋巴结肿大,气管、右侧主支气管受压变窄,上腔静脉癌栓形成可能,右肺动脉主干受压变窄,双肺多发结节。右侧胸腔积液,心包少量积液。脾内占位,大小约80 mm×67 mm,考虑恶性肿瘤可能。近期体质量下降约5 kg。吸烟史10余年,10支/d,已戒10余年。查体:体温36.4 ℃,脉搏120次/min,呼吸频率24次/min,血压136/90 mmHg(1 mmHg=0.133 kPa),体质量56.5 kg,体力活动状态(performance status,PS)评分1分。右侧锁骨上可扪及一大小约2 cm淋巴结,质硬,活动差,心肺体查未见异常,腹软,无压痛、反跳痛,脾肋下可扪及,双下肢无浮肿。入院诊断考虑:肺占位并纵隔多发淋巴结肿大,脾占位性病变。
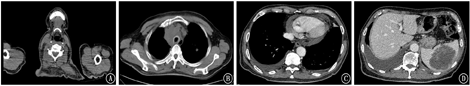
入院完善相关检查。胸腹部CT(2018年5月4日)提示:纵隔、右侧锁骨上窝、腹膜后、盆腔右侧及右侧腹股沟区多发肿大淋巴结,双肺多发结节,脾脏多发占位,考虑恶性肿瘤性病变,淋巴瘤可能性大,请结合临床;其中纵隔病灶侵犯上腔静脉、气管及支气管。左肺少许炎症。双肺胸腔少量积液,双肺下叶局部膨胀不全。心包少量积液。考虑左侧声带麻痹可能性大,建议必要时进一步检查(图1)。右锁骨上淋巴结活检免疫组织化学:CK(-),EMA(-),CD20(+++),CD3(-),CD5(-),CD22(+++),Ki67(几乎100%+),EBERs(-),CD23(-),CD10(-),CD21(肿瘤细胞弱阳性),ALK(5A4)(-),Bcl6(+++),CD138(-),MUMI(+++),Bcl2(-),Cyclin D1(-),Cmyc(70%+)。病理诊断:(右锁骨上淋巴结)非霍奇金淋巴瘤,弥漫大B细胞淋巴瘤,间变亚型,非生发中心B细胞样型免疫表型亚群。结合患者其他检查结果,患者诊断为:非霍奇金淋巴瘤(弥漫大B细胞型,ⅣB期,IPI 4分)。

考虑患者肿瘤负荷重、症状明显,诊断明确后,2018年5月3日始予甲强龙80 mg静滴,2次/d,减轻肿瘤负担和对症支持治疗。经处理后,患者气促症状仍较明显,予完善床边支气管镜检查,排查气管狭窄情况。床边支气管镜提示:气管中下段及左右支气管可见灰白色组织,未见明显气道狭窄,未排除瘘道形成。纤维支气管镜冲洗液找到产气肠杆菌;气管隆突活检病理:送检物为少许坏死物及细菌菌团,考虑为放线菌。胃镜提示:(1)慢性浅表性胃炎伴糜烂HP阴性;(2)胃息肉(已钳除);(3)食管溃疡,未见明确气管食管瘘。因支气管镜找到产气肠杆菌及放线菌,予左氧氟沙星500 mg静滴,1次/d,联合多西环素100 mg口服,2次/d抗感染治疗。考虑到患者为老年男性,且肿瘤侵犯气道,于2018年5月15日予环磷酰胺400 mg静滴+阿霉素50 mg静滴治疗,减轻肿瘤负荷,并予水化、碱化尿液、护胃、止呕、抗感染、营养支持、补充白蛋白、利尿等治疗。化疗后患者咳嗽、咳痰较前缓解,咳血痰3次,考虑肿瘤消散所致,予糖皮质激素减量、祛痰治疗。
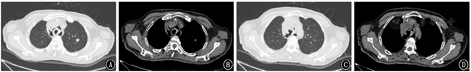
2018年5月23日复查胸部CT提示:淋巴瘤治疗后,气管瘘、纵隔瘘;纵隔、右侧锁骨上窝多发肿大淋巴结,双肺多发结节,脾脏占位,符合淋巴瘤,部分较前减小;双肺感染较前加重,双肺下叶膨胀不全;新增双侧胸腔积液;心包少量积液,较前相仿(图2)。2018月5月25日支气管镜见气道内弥漫白斑、黏膜糜烂,气管中段见巨型气管-纵隔瘘,左主支气管见3个瘘口,右上叶见1个瘘口(图3)。患者治疗过程中新发气管、支气管-纵隔瘘,考虑为原淋巴瘤浸润,累及纵隔及邻近的气管、支气管;化疗后,肿瘤组织消减,导致气管、支气管与纵隔间出现相通的窦道。患者气道弥漫性糜烂、多发巨型瘘口,难以自行愈合。目前气道内介入治疗方法,如气道支架、封堵器等不能解决瘘口问题,且支架、封堵器等机械压迫可能使原有气管/支气管瘘扩大。考虑患者气管/支气管-纵隔瘘虽存在,但纵隔内气体尚未引起心脏和纵隔大血管压迫;且瘘口未与食道相通,未引起难治性肺部感染等危及生命情况,决定采取保守治疗方式,继续予抗感染(产气肠杆菌和放线菌)及对症支持治疗。患者症状好转于2018年6月5日出院。但患者因个人因素,放弃进一步治疗,并于出院后2个月去世。

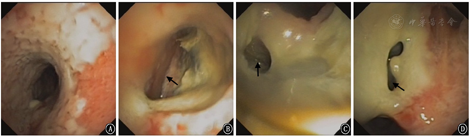

注:箭头示瘘口位置
呼吸道瘘是气管、支气管、外周气道与周围脏器之间出现的异常通道[4]。气管/支气管-食道瘘和气管/支气管-胸膜瘘等是常见的呼吸道瘘[5]。气管/支气管瘘中少部分产生于先天性发育异常[4,6],大部分产生于获得性因素,如感染、气管插管压迫、外伤、医源性和肿瘤等[4,7,8,9,10]。
肿瘤所致的瘘分为原发肿瘤或转移瘤浸润所致的瘘口和肿瘤相关治疗所致的瘘口。Barata等[11]报道1例胃小肠瘘作为首发表现的非小细胞肺癌。该例患者诊断时已出现非小细胞肺癌小肠转移,转移灶浸润引起胃小肠瘘。理论上,肿瘤所致的呼吸道瘘,从发病机制上分类,亦可分为原发肿瘤或转移瘤浸润所致的瘘口和肿瘤相关治疗所致的瘘口。可是笔者检索PubMed数据库,尚未找到肿瘤诊断的同时发现呼吸道瘘的报道。大部分是经过针对肿瘤的治疗后,出现新发症状并进一步检查发现的新发呼吸道瘘。其原因可能是肿瘤的浸润进展、坏死后出现空腔;也可能是原正常的组织已被肿瘤破坏,而肿瘤相关治疗消减了肿瘤的体积,肿瘤组织消减后缺乏正常组织维持原来的结构,在相邻器官间出现异常的瘘道。
现代肿瘤治疗方式多样,包括手术、化疗、放疗、靶向治疗、激素类似物治疗等。食道癌术后气管-食道瘘是临床上最常见的肿瘤治疗方式相关性呼吸道瘘[5]。化疗后气管/支气管瘘较为罕见。肺癌化疗后出现支气管瘘的报道,其病理类型均为鳞状细胞肺癌。Korpanty等[12]报道了1例ⅢB期鳞状细胞肺癌患者,经3个周期卡铂+吉西他滨化疗后出现支气管-食管瘘。ⅢA期鳞状细胞肺癌患者,使用紫杉醇联合卡铂化疗1个周期后出现支气管-心包瘘的情况亦有报道[13]。这可能与鳞状细胞肺癌好发于中心气道有关。
淋巴瘤化疗后出现呼吸道瘘亦有相关报道。Benmoussa等[14]报道1例24岁摩洛哥女性,确诊原发性纵隔大B细胞非霍奇金淋巴瘤,化疗后呼吸困难症状加重,并出现进食后呛咳,食管镜检查发现气管-食管瘘。虽经化疗及内镜下植入支架治疗,患者最终仍死亡。Hendarsih等[15]报道1例43岁男性患者,确诊为非霍奇金淋巴瘤并行1个疗程CHOP方案化疗后,出现呼吸困难和咳嗽,X线胸片发现自发性支气管胸膜瘘,经胸腔置管引流治疗1个月,患者气胸好转,并可继续进行后续疗程化疗。本例患者为弥漫大B细胞性非霍奇金淋巴瘤化疗后出现多发气管/支气管-纵隔瘘,未检索到同样的病例,故作报道。
靶向药物的出现是现代肿瘤治疗的一个里程碑。尤其在肺癌的治疗中,靶向治疗颠覆了肺癌治疗的架构,改变了肺癌患者的预后[16]。但靶向治疗也有其不良反应及并发症。常见的不良反应包括皮疹、消化道症状等[16],罕见的不良反应如呼吸道瘘。呼吸道瘘可出现于单独使用靶向药物后,也可出现于靶向药物联合化疗、放疗后[17,18]。贝伐珠单抗是人源化抗血管内皮生长因子单克隆抗体,被广泛应用于非小细胞肺癌、卵巢癌、转移性结直肠癌治疗。贝伐珠单抗通过与血管内皮生长因子特异性结合,阻止其余受体相互作用,使现有的肿瘤血管退化,抑制肿瘤新生血管生产,从而抑制肿瘤细胞的生长和转移[19,20]。Schreiber等[21]报道1例右主支气管腺癌并多发转移患者,使用紫杉醇、卡铂联合贝伐珠单抗治疗1个疗程,治疗后3周,患者症状加重,并发现右主支气管-食管瘘。虽然放置了气管-支气管支架和食道支架,但患者最终因大咯血死亡。Spigel等[17]进行了两项贝伐珠单抗治疗小细胞肺癌和非小细胞肺癌的Ⅱ期临床研究。两项研究在诱导期使用含贝伐珠单抗的同步放化疗方案,维持期使用含贝伐珠单抗的联合化疗方案。结果在入组的29例小细胞肺癌患者中,2例在诱导期即出现食管炎,其中1例在进入维持期1个月后出现食道狭窄,2例均在维持期出现气管-食管瘘;1例通过放置食管支架缓解症状,1例在治疗过程中死亡。5例入组的非小细胞肺癌患者中,2例出现食管炎、食管狭窄,需要扩张治疗,且最终均产生气管-食管瘘,需放置支架治疗,在之后10个月随访期内仍存活。这两项临床试验,因产生严重气管-食管瘘并发症提前终止,并因此修改了贝伐珠单抗的适应证范围。从中我们可以看到,与上述单纯化疗后出现呼吸道瘘的机制不同,贝伐珠单抗治疗后出现的气管-食管瘘,除了肿瘤组织消解外,更多的是通过引起食管炎、食管狭窄、食管糜烂等,最终出现气管-食管瘘。在甲状腺癌治疗中,卡博替尼治疗作为三线治疗方案,治疗后在原无肿瘤侵犯,但放疗辐射范围内区域出现了气管-食管瘘;舒尼替尼作为一线治疗,在甲状腺癌浸润区域出现了气管-肿瘤瘘[18]。
在有限的检索范围内,尚未见单独放疗引起呼吸道瘘的报道。呼吸道瘘可出现在放疗联合化疗、放化疗联合靶向治疗的病例中[17,22]。Abugroun等[23]报道1例Ⅳ期鳞状细胞肺癌患者联合放化疗治疗1年后肿瘤加重,再次使用辅助放疗2周,出现气管食管瘘的病例。放疗引起的呼吸道瘘可能具有迟发型,或者二次打击后更容易出现。
糖皮质激素类似物方面,有乳腺癌患者使用他莫昔芬治疗后出现上矢状窦动静脉双向瘘的报道[24],但在呼吸道瘘方面尚无相关资料。
治疗方面,肿瘤治疗过程中出现的呼吸道瘘,仅极少部分一般状况好的患者可接受手术治疗,大部分患者使用气道或食道支架(气管/支气管-食道瘘情况下)治疗[17]。而相当部分患者,如本文介绍病例,由于瘘口局部周围情况不允许,没有放置支架或封堵器等介入治疗机会。新发的呼吸道瘘往往合并肿瘤进展,该类患者预后差,多在诊断新发呼吸道瘘后2~3个月内死亡,少部分患者随访期可到10个月以上[17]。因此,在治疗前评估患者治疗相关呼吸道瘘发生的概率,对方案选择及患者的预后具有重要意义。
所有作者均声明不存在利益冲突



























