
结节病是一种原因不明的多系统性肉芽肿性疾病,其组织学特征为非干酪性肉芽肿,最常累及肺部,临床症状常无特异性。淋巴管平滑肌瘤病(LAM)是肺部弥漫性囊性病变为特征的罕见疾病,主要发生在育龄期女性,可累及多个系统,肺部最易受累,临床特点主要表现为复发性气胸、进行性呼吸困难、顽固性乳糜胸等,在临床工作中易误诊、漏诊。本文报道诊治结节病患者伴发LAM 1例。同时检索了国内外报道的结节病合并LAM的病例,讨论结节病和LAM的特点及相关性。结节病患者出现薄壁肺气囊或有关LAM的临床表现时,需要警惕LAM可能。尽早诊断以减少此类疾病的误诊、漏诊率,提高对该疾病的进一步认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
淋巴管平滑肌瘤病(lymphangioleiomyomatosis,LAM)是与结节硬化症等相关的罕见疾病,结节病多数起病隐匿,临床上表现多样性。但结节病伴发LAM在国内外文献中暂无报道。本文报道1例48岁的结节病女性患者逐步出现LAM的完整过程,并对国内外结节病合并LAM的文献进行复习,探讨此类疾病的临床特征和相关性。以提高结节病伴有LAM的诊治经验。
患者女,48岁,2001年在外院行纵隔淋巴结病理检查考虑诊断为"结节病",给予糖皮质激素类药物(泼尼松7.5 mg/d)治疗半年后自行停药,于2012年9月11日开始我院门诊复诊,胸部CT示:双肺门及纵隔淋巴结肿大,考虑结节病;首次发现右上肺气囊(图1A),此后多次复查胸部CT发现肺气囊稍有增加,未行诊治。之后于2016年11月5日患者无明显诱因出现自发性气胸至我院门诊行胸部CT示:右侧气胸,肺压缩约50%;双肺多发肺囊肿,双肺门淋巴结肿大(图2A),双肺弥漫分布为主(图1B),行胸腔闭式引流后复查胸部CT可见右侧气胸基本吸收。出院后又多次来我院门诊复诊查胸部CT仍可见双肺弥漫性肺气囊且数目逐渐增多,肺门淋巴结肿大较前略有缩小,遂调整为口服泼尼松(2.5 mg/d)维持,肺部气囊仍未行诊治。直至2019年5月11日至我院门诊复诊行泌尿系平扫CT又发现左肾乏脂肪错构瘤及右肾错构瘤(图1C),免疫病理:Melan-A(+),HMB-45(散在+),SMA(+),S-100(+),CD34(血管+),Desmin(局灶+),Ki-67(LI约10%+),H-Caldesmon(+),PCK[AE1/AE3](-)。综合考虑诊断为"右肾血管平滑肌瘤",给予抗感染、解痉及对症治疗,术后恢复可。术后规律复诊行胸部CT示:双侧肺气肿或肺气囊逐渐增多(图1D),考虑淋巴管平滑肌瘤病(lymphangiomyomatosis,LAM)可能,肺门淋巴结肿大较前明显缩小(图2B)。为求进一步明确诊断患者于2019年12月前往北京协和医院就诊,双肺CT示:双肺弥漫多发囊性病变,符合淋巴管平滑肌瘤;双肺门和纵隔淋巴结肿大,符合结节病表现;行68CA-NEB PET-CT符合肺淋巴管肌瘤病表现,行肺功能检查提示中度阻塞性通气功能障碍(FEV1/FVC 69.59%)弥散功能降低(DLCO SB 68.5%,DLCOCSB 68.5%),舒张试验阴性;ACE 21 U/L;VEGF-D 542 ng/L。综合考虑为"淋巴管平滑肌瘤病结节病",北京协和医院给予口服泼尼松2.5 mg(1次/d)、西罗莫司2 mg(1次/d)等治疗后稍好转,服用西罗莫司2个月后自行停用,继续口服泼尼松2.5 mg/d维持。于2020年5月6日患者因逐渐出现"气喘"和"呼吸困难"收入我院呼吸内科。查体:意识清楚、精神欠佳,双肺呼吸粗,双肺未闻及干湿性啰音。既往无吸烟,否认家族遗传病史。
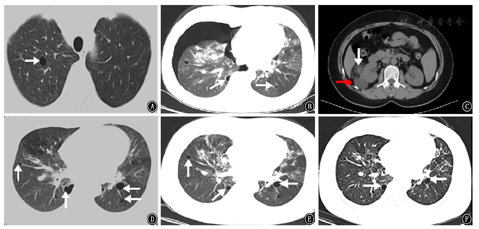

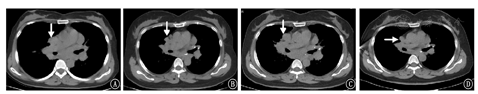

入院诊断:淋巴管平滑肌病结节病。诊疗经过:入院后实验室检查:白细胞为4.99×109/L,中性粒细胞百分比79.2%,淋巴细胞百分比5.6%,可溶性抗原(ENA):抗核抗体(ANA-IgG)阳性,其他实验室检查结果均显示阴性。胸部三维成像CT仍可见双侧肺气囊,大小不一(图1E),双肺多发斑片影、双肺门淋巴结较以往增多、增大,考虑结节病进展?(图2C),支气管镜及病原学检测均未见异常。予以波尼松30 mg,1次/d口服治疗3周,每3周减少10 mg,直至维持量10 mg,1次/d,继续服用西罗莫司2 mg,1次/d治疗。治疗7天后复查肺功能:中度阻塞性通气功能障碍(FEV1/FVC为62%,FEV1%pred为82%,轻度弥散功能下降DLCO%pred为75%,DLCO/VA为91%)较之前外院复查肺功能稍有恶化。遗憾的是患者拒绝行肺气囊活检。2020年6月16日开始来我院门诊复诊,胸部CT示:双肺斑片状实变灶较前减少,肺部感染病灶较前大部分吸收(图1F)。肺门淋巴结肿大较前缩小(图2D),气喘症状改善。
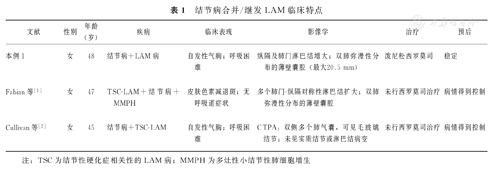
文献检索发现国外共报道了结节病合并LAM 2例[1,2],2种疾病多为同时发现或LAM后继发结节病。本文描述了国内首例结节病后继发LAM的患者,查阅国内外文献均无结节病伴发LAM的报道。本文清晰地展示了结节病患者逐步出现淋巴管平滑肌瘤病的完整过程,并且有趣的是本文患者的结节病出现进展可能源于LAM病的发生,两者的联系值得探索。回顾性分析这些病例的特征见表1。
结节病合并/继发LAM临床特点
结节病合并/继发LAM临床特点
| 文献 | 性别 | 年龄(岁) | 疾病 | 临床表现 | 影像学 | 治疗 | 预后 |
|---|---|---|---|---|---|---|---|
| 本例1 | 女 | 48 | 结节病+LAM病 | 自发性气胸;呼吸困难 | 纵隔及肺门淋巴结增大;双肺弥漫性分布的薄壁囊腔(最大20.5 mm) | 泼尼松西罗莫司 | 稳定 |
| Fabian等[1] | 女 | 47 | TSC-LAM+结节病+MMPH | 皮肤色素减退斑;无呼吸道症状 | 多个肺门-纵隔对称性淋巴结扩大;双肺弥漫性分布的薄壁囊腔 | 未行西罗莫司治疗 | 病情得到控制 |
| Cullivan等[2] | 女 | 45 | 结节病+TSC-LAM | 自发性气胸;呼吸困难 | CTPA:双侧多个肺气囊,可见毛玻璃结节;未见实质结节或淋巴结病变 | 未行西罗莫司治疗 | 病情得到控制 |
注:TSC为结节性硬化症相关性的LAM病;MMPH为多灶性小结节性肺细胞增生
临床医师首先应明确这些临床表现、病理和影像学等异常参数是否由LAM、结节病、还是其他疾病的综合引起,同时评估两种疾病严重程度,随访中需注意是否出现疾病进展,这将对未来的治疗选择有重要的影响。
结节病可发生在任何年龄,临床表现常有呼吸道症状,无任何特异性,最常见受累器官是纵隔淋巴结和肺部,病程进展和预后也可表现不同[3]。LAM是主要发生在育龄期女性的一种罕见疾病,包括结节性硬化症(tuberous sclerosis complex,TSC)相关性LAM(TSC-LAM)和散发性LAM,认为TSC1或TSC2基因的突变激活雷帕霉素(mTOR)信号通路相关,TSC-LAM更可能伴随血管平滑肌瘤并涉及一个以上的额外肺区域,本例累及肾血管平滑肌,但本例患者并未行基因检测,尚不能排除有结节硬化症合并此病。临床医生在确诊LAM病同时还应该警惕结节硬化症合并此类疾病的可能。LAM病的临床特点主要表现为复发性气胸、进行性肺囊性改变、顽固性乳糜胸等,早年研究发现约50%的患者是以自发性气胸为首发症状,而且整个病程中患者多合并有肾淋巴管平滑肌瘤的现象[4]。目前国外报道的结节病合并LAM的2例中也有1例是以自发性气胸为首发症状,随后出现肾血管平滑肌瘤,与文献报道相符。
LAM的影像学多表现为弥漫性分布的薄壁囊腔,多个肺叶的囊肿为特征,通常为双侧,一般无肺内结节影和间质纤维化特征,可伴发有气胸、胸腔积液及肺外血管平滑肌瘤等表现[5]。而结节病典型病理特征为非干酪性上皮细胞样肉芽肿,有可能仅表现出胸部影像异常,也可表现肺纤维化及呼吸衰竭的症状[6]。本文1例及国外报道的2例均符合上述影像学特征。有研究报道囊性肺疾病通常是发生在晚期纤维化的上肺门区域,可发生在结节病中,但这并不常见[7]。根据典型的影像学特征,首先推测本例的囊性肺病主要是由LAM引起。随后根据相关病理性特点,免疫组织化学染色显示平滑肌细胞阳性及特征性HMB45等均显示阳性,综合影像学表现及肺功能异常均是符合LAM病,但确诊仍还需要组织病理检查。激素联合免疫抑制剂治疗后复查肺功能及肺部气囊均无明显变化。考虑本例女性患者发病年龄较晚,LAM进展速度慢,继续随访观察。
通过检索同时患有结节病合并LAM 2例发现结节病和LAM可能存在共同的分子机制,早期就有报道mTOR信号的失调与巨噬细胞肉芽肿的形成和结节病的进展有关[8],推测mTOR通路的失调有可能在结节病的发病机制中发挥重要的作用。随后研究进一步明确组织蛋白酶K在肺LAM的上皮样细胞以及结节病的肉芽肿中表现出强烈的免疫反应性,其调节可能是通过mTOR途径得以实现[9]。又对mTOR的信号通路展开研究发现此通路与促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)有一定的整合作用。例如:血管内皮生长因子,可以诱导Akt、mTOR、s6k、S6和MAPK-Erk的磷酸化引起慢性炎症疾病的发生,这也可能发生在结节病中[10],这也为结节病中持续产生的几种炎性细胞因子提供了解释,如TNF-α和IL-12。Linke等[8]发现TSC2缺乏引起mTORC1的激活会导致小鼠和人类肉芽肿性疾病,包括结节病。则发现若用mTOR抑制剂阻止TSC中良性肿瘤和LAM的进展,有可能会改善结节病的征象。但目前并没有足够的证据支持mTOR抑制剂治疗其他呼吸性疾病,还需要更多的研究来明确这些药物的作用。
总之,LAM是一种病因还不明确的罕见疾病,结节病患者伴发LAM在临床上易误诊、漏诊。通过回顾性分析结节病合并LAM 3例,认为目前还不能证实LAM和结节病的共同机制,但是可以推测mTOR通路的失调在LAM和肺结节病之间存在联系。未来也需要进一步的报告来证明以上假设。
所有作者均声明不存在利益冲突



























