
肺部1H质子密度极低,导致传统1H磁共振成像(MRI)的成像质量较差。惰性气体经过超极化,极化度增高,气体MRI信号敏感度增强。新兴超极化气体MRI成像技术不仅可以显示肺结构形态学改变,还可以纵向检测肺通气和气体交换功能,具有非侵入、可视化、无辐射的独特优势,有助于慢性气道疾病的早期功能评估、高危人群筛查、病情监测及疗效评估。本文就超极化气体MRI成像技术在哮喘、慢性阻塞性肺疾病及肺间质性疾病中的研究进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,由于吸烟、空气污染等多方面因素,我国呼吸道慢性疾病的发病率逐年上升。支气管哮喘(哮喘)、COPD是气道炎症、重塑、气流受限等为特征的慢性气道疾病。肺部气道疾病的早期诊断成为医学界研究的重点与难点。这不仅需要更好地了解气道病理生理,还需要增强对疾病进展和肺功能的检测能力。常规的肺功能检查主要检测肺通气功能和肺气体弥散功能。该检查方法存在局限性,不能早期检测出小气道受限、细微病变及复杂病变等。最常用的X线胸片和胸部CT影像学方法虽能清晰地显示肺空间结构形态学变化,但是对正常组织有一定的放射损伤,且不能完全提取患者的肺通气及气体交换等肺功能的信息。超极化气体磁共振成像(magnetic resonance imaging,MRI)是一种新的成像方法,通过单次屏住呼吸采集,实现可视化的肺通气和气体交换的三维绘图,能够采集肺泡组织密度、肺通气、灌注和气血屏障厚度等多项生理参数[1],这是其他传统方法一次成像中无法实现的[2]。本文重点介绍新兴技术超极化气体MRI的成像原理及其在肺气道疾病中的应用进展。
肺部主要是由支气管、肺泡及结缔组织构成,富含大量气体,1H质子密度极低,因此传统1H MRI不敏感,成像质量差。而超极化气体MRI成像,是利用多核的惰性气体作为造影剂,提供了一种直接可视化、灵敏地测量肺通气障碍的新兴影像学技术手段。超极化气体MRI是利用自旋交换光学泵原理将氦(3He)或氙(129Xe)惰性气体超极化[3],惰性气体超极化后极化度升高、磁共振信号增强。3He的旋磁比是129Xe的3倍,具有更高的空间分辨率和信噪比,但是资源极其稀缺;而129Xe成本低,资源丰富,获取简单,成本低,且溶于组织、血液,有化学位移特点[4],可以用来评估肺气血交换功能。这2种惰性气体都是核自旋量子数为1/2的惰性气体,因此需要使用带有特制的宽频带谱仪和射频线圈才能进行多核成像[5](表1)。超极化气体以纯净状态制备与氮气或氧气混合后被患者吸入,患者屏气期间采集MRI信息。

3He、129X的主要理化参数
3He、129X的主要理化参数
| 稀有气体 | 旋磁比 | 核自选量子数 | 天然丰度 | 溶解相 |
|---|---|---|---|---|
| 3He | 32.43 | 1/2 | 稀缺 | 不溶于组织、血液 |
| 129Xe | 11.77 | 1/2 | 丰富 | 溶于组织、血液 |
哮喘是大、小气道均参与,由气道堵塞、炎症和重塑引起的可逆性气流受限的慢性疾病。第1秒用力呼气容积(forced expiratory volume in the first second,FEV1)对外周气流变化不敏感,很难去评估小气道气流受限情况。超极化气体MRI可提供高分辨率的肺通气三维图像,并且能够在空间上评估大小气道的通气状况。没有通气信号的区域原因可能是黏液堵塞引起的气道阻塞、平滑肌收缩或气道重塑。Marshall等[6]对33例控制不好的中重度哮喘患者进行3He超极化气体MRI扫描,发现肺近端区域(靠近肺门的2/3区域)比外周区域通气好。吸入支气管舒张剂后,外周区域要比近端区域更敏感,通气量增幅更大。与常规肺功能检测相比,超极化气体MRI对支气管舒张剂更敏感(58%比33%)。
3He MRI可以用来筛选哮喘高危人群。许多哮喘患者的肺功能用支气管舒张剂的可逆性保持稳定,而部分患者可能会经历肺功能持续下降,最终丧失支气管舒张剂后的可逆性。最近的流行病学研究表明,10%的哮喘患者,气道疾病可能会演变成持续性气流阻塞和COPD[7]。Eddy等[8]研究发现,3He MRI可以帮助预测轻中度哮喘向COPD患者过度的风险。
哮喘控制差可能与MRI通气异质性有关。哮喘通气异质性也可通过包括超极化气体MRI在内的肺成像方法加以识别。Svenningsen等[9]对18例控制不佳的重度哮喘患者MRI通气障碍百分比(percentage of ventilatory disorders,VDP)、肺清除指数(lung clearance index,LCI)和生活质量之间关系的相关性进行分析,发现哮喘控制问卷评分>2分及哮喘生活质量问卷评分>5分的哮喘患者VDP显著较差,但是与LCI无相关性,提示超极化气体MRI通气异质性与哮喘患者病情控制、加重及生活质量相关。超极化气体MRI有助于指导患者治疗和管理,从而提高哮喘控制水平。
COPD的早期诊断仍然是医学难题。一般情况下,支气管舒张实验FEV1/FVC<70%即诊断为COPD,但FEV1主要反映较大的气道功能障碍,可能会漏诊小气道(直径<2 mm)活动性的病变。临床有些使用支气管舒张剂的COPD患者尽管FEV1改善较小,症状却得到明显改善,超极化气体MRI能够解释这一现象,超极化气体MRI能够捕捉到FEV1发现不了的小气道病变[10]。
超极化气体MRI指标表观扩散系数与定量CT、常规肺功能检测在COPD诊断性能上具有较高的相关性[11]。Myc等[12]研究表明,在34例COPD患者和11名健康志愿者中,报告了129Xe MRI量化的气流异常指标VDP与FEV1%pred呈负相关,气体向红细胞的转移能力与DLCO呈正相关,并且129Xe MRI肺通气与SPECT/CT肺通气相关性较高,具有更高的时空分辨率[13]。
动态超极化气体MRI成像可以识别COPD患者侧支通气和延迟通气现象。目前,超极化气体MRI在肺部的应用主要是屏气期的静态成像。静态成像可能无法捕获呼吸周期不同阶段的肺功能动态,这可能导致无法识别出存在严重通气问题的肺部区域,例如可能存在侧支通气病理结构改变。侧支通气与COPD疾病严重程度之间尚未发现有明确的关系,但是考虑到严重COPD肺过度扩张患者进行治疗选择(例如支气管内瓣膜放置或手术肺切除)的可能性时,评估侧支通气至关重要[14]。近期,Chen等[15]提出了一种快速动态超极化129Xe MRI方法,能够无创检测和量化COPD患者的延迟通气,并在整个呼吸周期内提供有关区域肺功能的生理信息。超极化气体MRI对肺膨胀水平敏感。与在功能残余容量时采集MRI信息相比,超极化气体MRI在总肺容量时成像与定量CT通气成像更有相关性[16]。
超极化气体MRI能够帮助小儿造血干细胞移植(haematopoietic stem-cell transplantation,HSCT)患者肺部并发症的早期诊断。HSCT的肺部并发症占HSCT患者的60%,是移植术后死亡的重要原因,并且在移植物抗宿主病患者中发病率最高[17]。闭塞性细支气管炎综合征是HSCT最常见、最严重的迟发性肺部并发症,是由免疫介导的炎症和小气道纤维化共同导致的阻塞性肺部疾病,是一种以气流阻塞为表现的综合征。在闭塞性细支气管炎综合征常规肺功能检测确诊前,患者肺功能其实早已下降。而对小儿HSCT患者来说,肺功能试验的依从性较差。Walkup等[18]在一项横断面研究中,首次在FEV1正常的无症状HSCT患者中通过129Xe MRI检测到通气不足,这与先前在其他轻度阻塞性肺疾病中进行129Xe MRI的研究一致。129Xe MRI与常规肺功能检测相比,对无症状受试者的早期肺部病变具有更好的敏感性。因此,129Xe MRI能够较早地发现无症状患者的肺通气不足,及早进行干预从而延缓病程进展,提高患者生活质量。
CF是家族常染色体隐性遗传的先天性疾病。在北美洲白人中最常见,其他人种则极少见。在过去的几十年中,CF患者的总体生存率和肺功能已得到显著改善[19]。但是CF的常规肺功能检测往往不能识别早期肺功能改变。这就迫切需要更灵敏的肺功能检测方法,及时识别肺功能早期改变,及时进行干预,改善患者预后和提高生活质量。
基于影像学的超极化气体MRI肺功能测量可以更好地了解疾病的病灶性质并能检测早期的细微病理改变。超极化气体MRI能够检测出早期亚临床的CF患儿[20]。Marshall等[21]对19例临床稳定的轻度CF患儿和10名健康对照儿童进行了超极化3He MRI、LCI、低剂量CT和常规肺功能检测比较,发现超极化MRI是CF肺通气功能最灵敏的检测方法(敏感度89%),而CT敏感度为68%,LCI敏感度为47%。
超极化气体MRI可以纵向监测儿童CF肺疾病的病情进展。CF在儿童期常规肺功能检测正常,即使在成年期,FEV1的下降率也很低[22];而重复呼吸氮冲洗法与超极化气体MRI则能够灵敏地检测出幼儿CF随时间的进展情况。超极化气体MRI对于疾病进展纵向监测可能比重复呼吸氮冲洗法更灵敏[23]。
超极化气体MRI具有儿童CF抗生素疗效评估价值。CF的肺部症状对使用抗生素治疗的效果千差万别。LCI是重复呼吸氮冲洗法的一项指标。尽管LCI对早期CF较敏感,但是只能评估全肺的通气不均匀性。Rayment等[24]研究发现,129Xe MRI能够监测小儿CF肺部加重抗生素治疗后疗效的变化,观察到VDP明显降低(-42.1%,95%CI:-52.1~-31.9,P<0.01)。这表明129Xe MRI有望作为监测CF中治疗效果的新兴影像生物标志物。
肺功能测试包括FVC和DLCO,是评估特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)进展和治疗疗效的基础,但对肺功能纵向变化不敏感[25,26]。FVC%pred下降到≥10%是IPF疾病进展的主要终点指标,可以预测病死率。评估IPF患者的肺功能受损、治疗反应和疾病进展仍具有挑战性,超极化气体MRI可能成为IPF患者疾病进展和治疗反应的强有力的检测手段[27]。
Weatherley等[28]发现,在IPF患者中,即使DLCO在12个月内变化不明显,来自红细胞的129Xe信号相对于组织/血浆信号也会减弱,说明与常规肺功能检测FVC和DLCO相比,IPF患者的红细胞与肺间质及血浆信号峰值之比对肺弥散功能变化高度敏感。129Xe穿过肺泡间质进入肺毛细血管。超极化气体MRI光谱技术能够检测到肺泡、组织/血浆信号和红细胞中的129Xe信号[29],可以检测到IPF患者肺弥散功能受限。IPF患者与健康志愿者相比,红细胞与肺间质及血浆信号峰值比值有所降低,这表明129Xe MRI光谱能够检测出IPF患者的肺间质增厚[27,30],气体交换减少[31],见图1,图2,图3[27]。
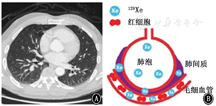

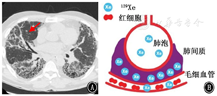

注:IPF为特发性肺纤维化
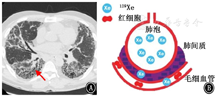

注:IPF为特发性肺纤维化
超极化气体MRI技术是一种无放射、非侵入的可视化影像技术,具有可重复性和纵向观察的特点,能够提取患者肺部通气、灌注、弥散、气体交换等肺功能信息。由于3He旋磁比大及资源极其稀缺等短板,而129Xe具有化学位移特点,不仅可以充填肺泡,也可以溶于组织血液,具有评估肺气气交换、气血交换等优势,因而129Xe应用更加广泛。
超极化气体MRI在肺气道疾病中具有早期诊断价值,能够评估肺通气、气体交换和检测微观结构的细微变化,可用于高危人群的筛查、疾病病情进展和治疗反应的评估。该技术在各种肺部疾病患者中耐受性良好,没有电离辐射,特别适合小儿孕妇等特殊人群。如今超极化气体MRI还未广泛应用于临床,成本高、程序复杂是其主要原因。由于129Xe旋磁比低,超极气MRI敏感度有待于进一步提高[32]。超极化气体MRI现阶段应用较多的是静态成像,高质量MRI扫描让患者屏气时间较长,也给患者带来了依从性的挑战。
所有作者均声明不存在利益冲突



























