
通过观察骨形成蛋白-7(BMP-7)对炎症因子IL-1β刺激大鼠软骨细胞后对软骨细胞代谢的影响。
细胞增殖-毒性检测(CCK-8)法检测不同浓度BMP-7(50、100、200 ng/ml)、氨基葡糖(5%、10%、20%)对炎症情况下(IL-1β刺激24 h)软骨细胞增殖的影响;实时荧光定量PCR及免疫荧光检测BMP-7(100 ng/ml)、氨基葡糖(10%)以及BMP-7(50 ng/ml)联合氨基葡糖(10%)对炎症情况下(IL-1β刺激24 h)软骨细胞Ⅱ型胶原、蛋白聚糖、MMP-13 mRNA和蛋白表达的影响。进行单因素方差分析,组间两两比较方差齐采用LSD法,方差不齐采用Tamhane,T2法检验。
炎症情况下,软骨细胞的增殖受到明显抑制[(993±53)个,P<0.05],Ⅱ型胶原、蛋白聚糖mRNA的表达下调(0.42±0.04和0.82±0.06,P<0.05),MMP-13 mRNA表达上调(1.01±0.09,P<0.05),Ⅱ型胶原、蛋白聚糖蛋白表达减少(1.26±0.11和1.38±0.11,P<0.05);BMP-7能够改善IL-1β对软骨细胞增殖的影响(4 052±140,P<0.05)和逆转Ⅱ型胶原、蛋白聚糖mRNA水平(1.46±0.19和1.60±0.07,P均<0.05)和Ⅱ型胶原、蛋白聚糖及MMP-13蛋白水平的表达(0.94±0.23、1.58±0.11及0.89±0.07,P均<0.05)。
BMP-7能够改善IL-1β对软骨细胞代谢的影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
OA是一种常见的累及关节的风湿性疾病,它以关节软骨退变为主,并伴有滑膜、关节周围软组织的病理改变。目前,OA的病因和发病机制不清楚,普遍认为与关节软骨的退变相关,其主要原因为关节内促进软骨合成代谢和分解代谢调节因子之间的平衡被打破,使分解代谢超过了合成代谢的代偿。当OA进入到分解代谢阶段时,软骨基质降解酶如MMP-1、MMP-13将增加,而细胞外基质产物如蛋白聚糖和Ⅱ型胶原将减少[1]。由此推测,阻止关节软骨的进一步退变是防治OA的本质。近年来研究发现,OA是一种由软骨、骨、滑膜等参与的炎症性疾病[1,2,3],其炎症通路是由多种细胞因子[如IL-1、TNF、TGF、胰岛素样生长因子、骨形成蛋白-7(bone morphogenetic proteins-7,BMP)家族等]共同参与OA关节软骨的破坏与修复,但关于它们的释放、激活及作用机制仍不清楚。
BMP-7作为软骨组织工程领域的生长因子备受关注,它属于TGF-β超家族成员,参与骨髓基质干细胞向成骨细胞、软骨细胞、脂肪细胞的分化[4,5,6],以及成熟组织的修复。那么,BMP-7与软骨细胞代谢物之间有什么关联,又是通过什么方式或途径影响关节软骨的代谢?基于国外侧重于在动物水平研究OA,在细胞水平研究较少,本研究采用体外实验,从软骨细胞着手,通过IL-1β制造炎症模型,予BMP-7进行干预,探讨BMP-7对软骨细胞合成代谢(Ⅱ型胶原、蛋白聚糖)及分解代谢(MMP-13)产物的影响。
3~4周龄清洁级SD大鼠50~100 g,雄性,购买于第三军医大学大坪医院实验动物中心。细胞增殖-毒性检测(CCK-8试剂盒,日本同仁)、Ⅱ型胶原、聚焦蛋白聚糖(aggrecan)多克隆抗体(Abcam公司);FITC荧光二抗(Solarbio科技有限公司);实时荧光PCR(Life Technologies公司);Ⅱ型胶原酶(Sigma公司);BMP-7试剂(Prospec公司);IL-1β(Prospec公司);荧光定量PCR扩增仪(Bio Rad,美国)等。
3~4周龄SD大鼠经水合氯醛(1 ml/100 g)腹腔麻醉后,予75%乙醇浸泡5 min,置于超净工作台内,取包含关节的组织,置入培养皿中,予PBS(含青霉素、链霉素各100 U/L)冲洗3遍,眼科剪剪取软骨并剪成1~3 mm3碎块,PBS冲洗2次,移入离心管,加入0.25%胰蛋白酶消化30 min,1 000 r/min离心半径13.5 cm,离心5 min;弃上清,加入2 g/L Ⅱ型胶原酶,37 ℃消化振荡4~6 h,200目尼龙筛过滤,将滤液吸入离心管,1 000 r/min离心半径13.5 cm,离心10 min,弃上清,予含10%胎牛血清DMEM/F12的培养液重悬细胞后,细胞按2×105个/ml密度接种25 cm2培养瓶内,置于37 ℃、体积分数为5%CO2的培养箱内培养。2 d后首次换液,以后隔天换液,倒置显微镜观察、照相记录贴壁生长情况和细胞形态。待细胞贴壁生长面积达75%~90%时传代,取第3代软骨细胞进行实验。
原代软骨细胞经胰酶消化后种板,待细胞贴壁后,PBS洗涤3次,予4%多聚甲醛溶液固定20 min后,行1%甲苯胺蓝染液染色20 min,PBS洗涤3~5次,镜下观察拍照。
软骨细胞以5×103个/ml种板,待细胞贴壁后,PBS洗涤3次,予4%多聚甲醛固定20 min。PBS洗涤3次,予0.25% Triton室温通透20 min,PBS洗涤3次,予10%山羊血清封闭1h后,加入Ⅱ型胶原一抗(兔抗大鼠1∶100)后4 ℃过夜,次日弃去一抗,PBS洗涤3次后加入羊抗兔FITC标记的二抗(1∶100)37 ℃孵育50 min后弃去二抗,PBS洗涤3次,予4,6-联脒-2-苯基吲哚二盐酸盐(DAPI)(5 μg/ml)细胞核染色10 min后,PBS洗涤3次,荧光显微镜下观察拍照。
取第3代软骨细胞按2×104个/100 μl,接种于96孔板,分为5组,待细胞贴壁,予PBS洗涤2次后,IL-1β(10 ng/ml)作用24 h,然后加入干预剂作用48 h后,加入CCK-8溶液(CCK-8体积∶溶液体积=1∶10),37 ℃孵育2.5 h,酶标仪测A450值。
实验分组:A组:含10%胎牛血清的DMEM/F12培养基,B组:IL-1β+含10%胎牛血清的DMEM/F12培养基,C组:IL-1β+含10%胎牛血清的DMEM/F12培养基+BMP-7,D组:IL-1β+含10%胎牛血清的DMEM/F12培养基+氨基葡糖,E组:IL-1β+含10%胎牛血清的DMEM/F12培养基+氨基葡糖+BMP-7,其中BMP-7浓度分别取0、50(C1)、100(C2)、200(C3)ng/ml,氨基葡糖浓度分别取0、5%(D1)、10%(D2)、20%(D3),共17个小组。
根据CCK-8法检测结果,筛选出BMP-7和氨基葡糖对软骨细胞增殖影响最佳浓度分别为BMP-7 100 ng/ml、氨基葡糖10%,联合组:氨基葡糖10%+BMP-7 50 ng/ml,并选择最佳浓度进行后续实验。实验分组:BMP-7组:100 ng/ml,氨基葡糖组:10%,联合组:BMP-7 50 ng/ml+氨基葡糖10%,正常对照组(不加干预剂及IL-1β)及炎症模型组(只加IL-1β),具体步骤如下:软骨细胞按5×103个/ml种板,待细胞贴壁后,PBS洗涤3次,予IL-1β(10 ng/ml)作用24 h,然后加入各组干预剂作用48 h后,予4%多聚甲醛固定20 min。PBS洗涤3次,予0.25%Triton室温通透20 min,PBS洗涤3次,予10%山羊血清封闭1 h后,加入Ⅱ型胶原或蛋白聚糖一抗(兔抗大鼠1∶100)后4 ℃过夜,次日弃去一抗,PBS洗涤3次后加入羊抗兔FITC标记的二抗(1∶100)37 ℃孵育50 min后弃去二抗,PBS洗涤3次,予DAPI(5 μg/ml)细胞核染色10 min后PBS洗涤3次,荧光显微镜下观察并拍照。
根据CCK-8法检测结果,筛选出BMP-7和氨基葡糖对软骨细胞增殖影响最佳浓度分别为BMP-7 100 ng/ml、氨基葡糖10%,联合组:氨基葡糖10%+BMP-7 50 ng/ml,并选择最佳浓度进行后续实验。实验分组:BMP-7组:100 ng/ml,氨基葡糖组:10%,联合组:BMP-7 50 ng/ml+氨基葡糖10%,正常对照组(不加干预剂及IL-1β)及炎症模型组(只加IL-1β),具体步骤如下:软骨细胞按2×104个/ml接种在6孔板中,待细胞贴壁后,加入IL-1β(10 ng/ml)24 h后,予各组干预因子作用48 h后,参照Trizol试剂说明书提取总RNA,测定A260/A280判断纯度和浓度后取2 μl总RNA,使用cDNA反转录试剂盒进行反转录DNA。实验中所用引物由Life technologies工程有限公司设计并合成,引物信息如下(见表1)。PCR反应过程:反应体系20 μl,95 ℃预变性5 min,95 ℃变性30 s,55~59 ℃退火30 s,72 ℃延伸1 min,共40个PCR循环,最后72 ℃总延伸10 min。

PCR基因引物序列
PCR基因引物序列
| 基因 | 引物序列 | 产物大小(bp) | 退火温度(℃) |
|---|---|---|---|
| Ⅱ型胶原 | 正向引物:CTCCCAGAACATCACCTACCAC;反向引物:CCATCCTTCAGGGCAGTGTA | 156 | 55 |
| aggrecan | 正向引物:GTTGTATTCCACTACCGCCCG;反向引物:TCACACTGCTCATAGCCTGCC | 143 | 59 |
| MMP⁃13 | 正向引物:GTTGATAGACTCCGAGAAATGC;反向引物:GTTAAGTTTGTTTGGGACCATT | 164 | 57 |
| GAPDH | 正向引物:AAGTTCAACGGCACAGTCAAGG;反向引物:ACGCCAGTAGACTCCACGACAT | 140 | 57 |
注:aggrecan:聚焦蛋白聚糖
采用SPSS 17.0软件分析结果,实验数据以 ±s表示,进行单因素方差分析,组间两两比较方差齐采用LSD法,方差不齐采用Tamhane,T2法,以P<0.05为差异有统计学意义。
±s表示,进行单因素方差分析,组间两两比较方差齐采用LSD法,方差不齐采用Tamhane,T2法,以P<0.05为差异有统计学意义。
原代软骨细胞培养2 d可见大部分细胞贴壁生长,呈短不规则形、多棱角形(铺路石状)散在分布,胞核清晰,细胞外基质遮光性强,培养9 d后细胞基本长满瓶底,大部分呈较均匀分布生长,核质清晰;随着软骨细胞传代次数的增加,细胞逐渐呈分支状生长。
软骨细胞为多角形,核为椭圆形或圆形,大部分为单核,有时可见双核,细胞核与细胞质分界清晰,细胞核被染成深蓝色,胞质染成浅蓝色(见图1)。
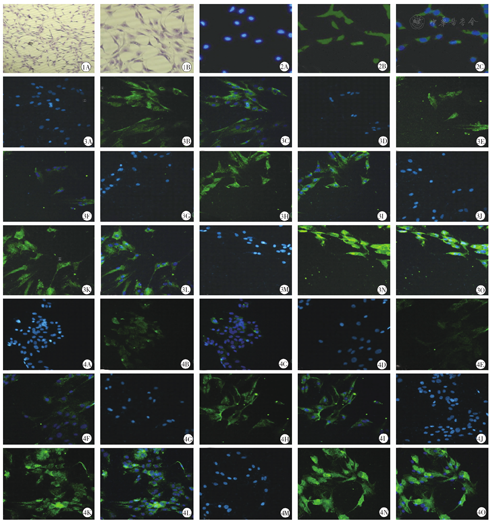

软骨细胞分泌的Ⅱ型胶原主要分布在胞膜和胞质,在荧光显微镜下呈绿色,胞核呈蓝色,将胞核与胞质合成后可见典型的软骨细胞形态(见图2)。
软骨细胞经IL-1β作用24 h后,再给予不同浓度的BMP-7、氨基葡糖作用48 h后,测A450值。结果显示BMP-7、氨基葡糖与正常对照组相比较均能改善IL-1β对软骨细胞的抑制作用,部分差异有统计学意义(P<0.05);BMP-7为50、100 ng/ml时改善IL-1β对软骨细胞的抑制作用呈剂量依赖性,但当BMP-7为200 ng/ml时,改善抑制作用较100 ng/ml时下降(表2)。
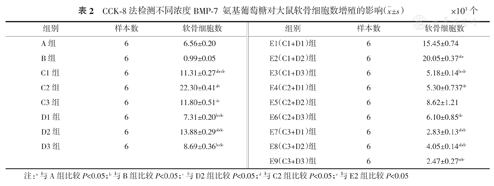
CCK-8法检测不同浓度BMP-7氨基葡萄糖对大鼠软骨细胞数增殖的影响( ±s)×103个
±s)×103个
CCK-8法检测不同浓度BMP-7氨基葡萄糖对大鼠软骨细胞数增殖的影响( ±s)×103个
±s)×103个
| 组别 | 样本数 | 软骨细胞数 | 组别 | 样本数 | 软骨细胞数 |
|---|---|---|---|---|---|
| A组 | 6 | 6.56±0.20 | E1(C1+D1)组 | 6 | 15.45±0.74 |
| B组 | 6 | 0.99±0.05 | E2(C1+D2)组 | 6 | 20.05±0.37abc |
| C1组 | 6 | 11.31±0.27abcde | E3(C1+D3)组 | 6 | 5.18±0.14bcde |
| C2组 | 6 | 22.30±0.41ab | E4(C2+D1)组 | 6 | 5.30±0.737de |
| C3组 | 6 | 11.80±0.51de | E5(C2+D2)组 | 6 | 8.62±1.21 |
| D1组 | 6 | 7.31±0.20bcde | E6(C2+D3)组 | 6 | 6.10±0.85de |
| D2组 | 6 | 13.88±0.29abde | E7(C3+D1)组 | 6 | 2.83±0.13abde |
| D3组 | 6 | 8.69±0.36bcde | E8(C3+D2)组 | 6 | 4.05±0.14abde |
| E9(C3+D3)组 | 6 | 2.47±0.27ade |
注:a与A组比较P<0.05;b与B组比较P<0.05;c与D2组比较P<0.05;d与C2组比较P<0.05;e与E2组比较P<0.05
从蛋白聚糖免疫荧光结果可以看出,蛋白聚糖主要表达于细胞的胞质和胞膜上,各组均有表达,组间比较差异均有统计学意义(P<0.01);IL-1β组蛋白聚糖平均A值与正常对照组及干预剂组相比明显降低(P<0.01);BMP-7组与正常对照组、IL-1β组、氨基葡糖组及联合组相比平均A值增加(P<0.01);联合组平均A较单独的氨基葡萄糖组增加,但较单独的BMP-7组降低,差异均有统计学意义(P<0.01)(见图3,表3)。
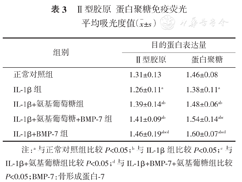
Ⅱ型胶原蛋白聚糖免疫荧光平均吸光度值( ±s)
±s)
Ⅱ型胶原蛋白聚糖免疫荧光平均吸光度值( ±s)
±s)
| 组别 | 目的蛋白表达量 | |
|---|---|---|
| Ⅱ型胶原 | 蛋白聚糖 | |
| 正常对照组 | 1.31±0.13 | 1.46±0.08 |
| IL⁃1β组 | 1.26±0.11a | 1.38±0.11a |
| IL⁃1β+氨基葡萄糖组 | 1.39±0.14ab | 1.48±0.06ab |
| IL⁃1β+氨基葡萄糖+BMP⁃7组 | 1.41±0.09ab | 1.54±0.14abc |
| IL⁃1β+BMP⁃7组 | 1.46±0.19abcd | 1.60±0.07abcd |
注:a与正常对照组比较P<0.05;b与IL-1β组比较P<0.05;c与IL-1β+氨基葡糖组比较P<0.05;d与IL-1β+BMP-7+氨基葡糖组比较P<0.05;BMP-7:骨形成蛋白-7
各组Ⅱ型胶原、蛋白聚糖的mRNA相对表达量比较:氨基葡糖组、BMP-7组及氨基葡糖+BMP-7组与IL-1β组相比较mRNA表达均呈上调趋势,组间比较差异均有统计学意义(P<0.05);其中,单独的BMP-7组上调最明显(见表4)。
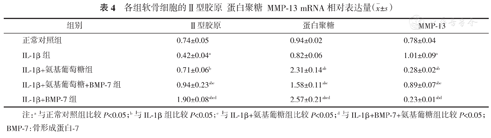
各组软骨细胞的Ⅱ型胶原蛋白聚糖MMP-13 mRNA相对表达量( ±s)
±s)
各组软骨细胞的Ⅱ型胶原蛋白聚糖MMP-13 mRNA相对表达量( ±s)
±s)
| 组别 | Ⅱ型胶原 | 蛋白聚糖 | MMP⁃13 |
|---|---|---|---|
| 正常对照组 | 0.74±0.05 | 0.94±0.02 | 0.78±0.04 |
| IL⁃1β组 | 0.42±0.04a | 0.82±0.06 | 1.01±0.09a |
| IL⁃1β+氨基葡萄糖组 | 0.71±0.06b | 2.31±0.14ab | 0.28±0.02ab |
| IL⁃1β+氨基葡萄糖+BMP⁃7组 | 0.94±0.23abc | 1.58±0.11abc | 0.89±0.07abc |
| IL⁃1β+BMP⁃7组 | 1.90±0.08abcd | 2.57±0.21abcd | 0.23±0.01abd |
注:a与正常对照组比较P<0.05;b与IL-1β组比较P<0.05;c与IL-1β+氨基葡糖组比较P<0.05;d与IL-1β+BMP-7+氨基葡糖组比较P<0.05;BMP-7:骨形成蛋白-7
各组MMP-13的mRNA相对表达量比较:正常对照组、BMP-7组及氨基葡糖联合BMP-7组与IL-1β组相比较mRNA表达均呈下调趋势,组间比较差异均有统计学意义(P<0.05);单独的BMP-7组下调最明显(见表4)。
软骨的退变是OA主要的病理特点,炎症反应可能参与了软骨退变的发生。BMP-7作为软骨组织工程领域的生长因子备受关注,它对软骨细胞的生物学效应包括促进合成代谢,抑制分解代谢。Hayashi等[7]发现BMP-7对兔OA模型有保护性作用。从本实验结果中可以看出,加入BMP-7组能够明显改善IL-1β对软骨细胞的抑制作用,其细胞数较氨基葡糖组要多,起初剂量依赖性,但当BMP-7浓度达200 ng/ml时,细胞增殖较100 ng/ml时有所下降,这是否与高浓度的BMP-7对软骨细胞有一定的毒副作用呢?有待证实。有学者研究了体外利用缓释系统的方法,BMP-7在低浓度50 ng/ml就足够改善软骨细胞的培养[8]。本实验BMP-7最佳浓度为100 ng/ml时对软骨细胞增殖最明显,这是否与本实验采用的是一次性干预相关呢?也有待证实。
蛋白聚糖和Ⅱ型胶原是软骨细胞外基质的主要组成成分,而MMP-13是细胞外基质胶原的主要降解酶。在本实验中,加入BMP-7组能够明显改善IL-1β对软骨细胞Ⅱ型胶原和蛋白聚糖免疫荧平均A的表达,且BMP-7组改善作用最明显(P<0.05),进一步证实了BMP-7具有促进软骨细胞外基质Ⅱ型胶原、蛋白聚糖的合成代谢,能够拮抗IL-1β对蛋白聚糖、Ⅱ型胶原的炎症耗损;在实时反转录PCR的结果中,炎症组与正常对照组相比较,Ⅱ型胶原、蛋白聚糖mRNA表达呈现下调趋势,MMP-13 mRNA表达呈现上调趋势,这与Sheu等[8]的研究结果一致;加入干预剂后,得到了和免疫荧光类似的结果,进一步从基因水平证实了BMP-7具有促进软骨细胞外基质Ⅱ型胶原、蛋白聚糖的合成代谢,能够拮抗IL-1β对蛋白聚糖、Ⅱ型胶原的耗损及MMP-13的生成的能力。但在免疫荧光和实时反转录PCR检测BMP-7与氨基葡萄糖联合组改善作用不及单独的BMP-7组,这是否与二者联合时对软骨细胞作用之间受体的竞争和有效药物浓度及其作用时间有关呢?也需进一步证实。OA发病机制的复杂性表明了对其进一步研究的必要性,有效地控制OA,探讨OA的发病机制,寻找OA治疗的新靶点已经成为全世界关注的课题。目前,治疗OA的药物可以减轻症状但不能阻止OA的进展,而手术的疗效较好,但也有其并发症且价格昂贵。因此基因治疗是目前研究的热点。Hayashi等[7]通过对兔OA模型关节内注入BMP-7,行免疫组织化学检测软骨组织时,在BMP-7治疗组Ⅱ型胶原及蛋白聚糖表达更多,且肉眼观察BMP-7组骨赘更小;在Hunter等[9]研究BMP-7的安全性和耐受性中发现,BMP-7治疗后患者疼痛方面得到改善、影像学没有异位骨形成、且没有剂量的毒性效应,只是其治疗的最佳治疗剂量及注射部位疼痛等不良事件有待进一步研究。
本实验中BMP-7能够改善IL-1β对软骨细胞的抑制作用,参与了软骨细胞Ⅱ型胶原、蛋白聚糖、MMP-13代谢物的表达,成为OA治疗的一个潜在靶向位点。在后续的研究中BMP-7有望在OA的诊断及治疗中开创出一条新的道路。



























