
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
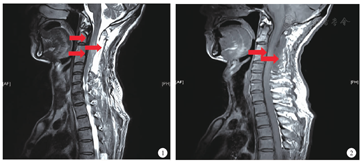
患者男,57岁,主因"颈部及双肩疼痛伴四肢麻木4年,左侧肢体活动受限,排便困难1年"入院。患者于2010年出现颈部及双肩部疼痛,伴四肢麻木,药物治疗效果不佳,于我院查颈胸段MRI示"颈胸段椎管内脊髓前方弥漫性条状低信号,增强扫描明显强化,相应水平脊髓受压,脊髓内见弥漫性长T1稍长T2信号影,C2~T8椎管内占位,淋巴瘤?炎性病变?(见图1,图2)" 。2010年3月于我院行"C1~5,T5~7前方肿物切除,椎板减压术" ,术中见"剪开背侧硬膜后脊髓外膨明显,右侧轻牵拉脊髓,见C1~4腹侧病变,质硬,红褐色,扁平与硬膜不能分开" ,病理提示"送检组织为慢性非特异性炎,纤维组织增生,灶状小血管增生,免疫组织化学CD3灶状(+),CD20灶状(+),CD4少数(+),CD8少数(+),CD117(-),s-100(-),CD10(-),EMA灶状(+),Ki-67少数(+),比较符合脑脊髓膜炎,不能除外炎性脑膜瘤" 。术后患者上述症状未好转,逐渐出现左侧肢体无力,活动受限,大小便排便费力,于2014年11月收入我院。既往抑郁病史,长期药物控制。查体:神志清楚,生命体征平稳,心、肺、腹查体未见明显异常。右侧肢体针刺觉减退,左上肢肌力Ⅲ级,左下肢肌力Ⅳ级,左下肢巴氏征阳性。辅助检查:血、尿、便常规及生化检查均未见异常,肿瘤标志物正常。ANA斑点胞质型1∶80,抗dsDNA抗体阴性,ANCA阴性,血清免疫球蛋白亚型IgG1~4均在正常范围。腰椎穿刺检查示脑脊液透明清亮,压力正常,脑脊液常规及生化正常。腹部B超示胆囊多发息肉,胰腺形态正常,胰管无扩张。颈胸段MRI示:C1~2,T5~7脊髓混杂长T2信号,范围较前扩大。头颅MRI脑白质轻度脱髓鞘,未见硬脑膜增厚。腰骶MRI示:L3~5,L5~S1椎间盘突出,未见椎管内占位。复核2010年手术病理切片加染IgG4免疫组织化学:组织挤压明显,可见较多淋巴细胞、浆细胞浸润,间质纤维化、局灶偶见席纹样改变,未见确切静脉炎改变,IgG4+细胞数量升高,个别区域达40/HP(IgG4+细胞浸润面积约占1/3),IgG4+/IgG+细胞比例<40%,病理学表现不足以确诊IgG4相关硬化病变。考虑诊断为特发性肥厚性硬脊髓膜炎(idiopathic hypertrophic spinal pachymeningitis,IHSP),予地塞米松10 mg,每日1次静脉输液1周后患者症状无明显改善,改为泼尼松60 mg,每日1次口服,加用吗替麦考酚酯(骁悉)500 mg,每日2次口服后出院。院外患者吗替麦考酚酯口服1个月后停药,泼尼松应用1年,逐渐减量至7.5 mg/d停用,长期口服B族维生素,1年后随访,患者左上肢肌力较前无明显改善,小便费力较前加重。

IHSP由Charcot及Joffory于1869年首次报道,是一种罕见的以硬脊膜弥漫或局部显著增厚为特征的慢性纤维化炎症性疾病,下颈段及上胸段受累最常见(86%)[1],椎管腹侧较背侧更易受累,根性疼痛及脊髓病为其主要表现[2]。正常硬脊膜厚度为1.5~2.0 mm,增厚的硬脊膜压迫邻近血管神经及脊髓可造成进行性神经功能缺损。第一阶段表现为进行性加重的局部压迫性神经根性疼痛,第二阶段表现为肌力下降及废用性肌萎缩,第三阶段表现为膀胱及肠道自主神经功能紊乱、肢体瘫痪及膈肌、肋间肌去神经化导致的呼吸困难[3]。MRI表现为受累节段椎管外局部肿块或硬脊膜条带样增厚,增厚的硬脊膜在T1加权像为等信号或低信号,T2加权像为低信号[4],增强MRI可见硬膜周边线样或结节样强化。组织病理学可见硬膜增厚,纤维化,淋巴细胞及浆细胞浸润。IHSP为排除性诊断,须除外各种继发性原因,如感染性疾病:结核、神经梅毒;自身免疫病:RA、肉芽肿性多血管炎、结节病、血栓性静脉炎;肿瘤性疾病:原发性脑膜瘤、淋巴瘤以及外伤、药物(β受体阻滞剂,鞘内注药)[1,5]等原因。
近年来研究发现部分IHSP属于IgG4相关性疾病(IgG4-RD)。IgG4相关硬化性疾病本世纪初才逐渐为学者认识,多见于50~70岁男性,全身多处脏器可受累,包括硬化性胰腺炎、硬化性涎腺炎、硬化性泪腺炎、间质性肺炎、腹膜后纤维化、硬化性胆管炎、小管间质性肾病等。有病例报道IgG4硬化性疾病可导致中枢神经系统受累,表现为垂体炎[6,7],Chan等[8]提出部分IHSP或脊膜炎属于IgG4相关硬化性疾病范畴。目前针对胰腺外IgG4相关性疾病诊断标准尚未达成一致意见。根据自身免疫性胰腺炎亚洲标准及美国梅奥医学中心的HISORt标准(基于病理学、影像学、血清学、其他器官受累情况及激素治疗效果五方面的诊断),考虑到硬膜不同于其他实质性脏器,本身为寡细胞成分而富纤维结构,Lindstrom等[6]提出组织病理学上IgG4+细胞>10/HPF,IgG4+/IgG+细胞30%~50%以助于诊断。多学科专家对IgG4相关硬化性疾病(包括IgG4相关硬膜炎)诊断标准共识为:IgG4硬化性疾病三大特征性病理学表现(大量IgG4+淋巴浆细胞浸润,血栓性静脉炎及席纹状纤维化)须至少满足2条,如仅1条满足,须其他条件:如血清IgG4升高,组织内IgG4+/IgG+细胞比例升高,有典型临床表现的多脏器受累来支持诊断[9]。治疗上及时手术切除病灶减轻神经压迫症状,术后应用激素加用放疗及免疫抑制剂为目前大部分文献推荐的治疗方法[1,4,9]。考虑到神经受压产生的严重后果,文献[9]推荐IgG4相关肥厚性硬膜炎起始采用激素冲击治疗(甲泼尼龙1 000 mg/d× 3 d),再逐渐减量,激素效果不佳可辅以免疫抑制剂如硫唑嘌呤、环磷酰胺、吗替麦考酚酯、甲氨蝶呤等,也可使用生物制剂如利妥昔单抗,但其疗效有待大规模临床试验结果证实。Ruiz-Sandoval等[10]及Bosman等[11]报道了皮下注射及口服甲氨蝶呤(每周12.5 mg)治疗肥厚性硬脑膜炎病例,6周后症状缓解,并推荐该方法用于激素禁忌或效果不佳肥厚性硬膜炎患者。目前IgG4相关肥厚性硬膜炎治疗上仍以经验性治疗为主,大部分文献未对治疗细节做出具体描述及总结[9]。但是,疾病终末期硬膜肥厚、严重纤维化,炎症反应消退,药物治疗效果不佳,可遗留不可逆性神经功能损害。一般认为术前较重的硬膜炎性反应,包括ESR增快、脑脊液蛋白升高、CRP升高是肥厚性硬膜炎预后不良因素[1]。
本例患者属IgG4硬化性疾病好发人群,组织病理学IgG4+细胞个别区域达40/HP,可见席纹征,考虑其肥厚性硬膜炎可能与IgG4相关。但患者在行手术时国内医生尚对IgG4相关硬膜炎认识不足,病理科医生未及时对病理组织行IgG4免疫组织化学染色,患者在诊断及激素治疗方面失去最佳时期,治疗效果不佳。由此可见,对于影像学表现为硬脑膜、脊髓膜肥厚的患者,详尽的临床病史资料,影像学检查(增强MRI)以及早期手术解除神经压迫并取得完整的组织病理学标本进行IgG4免疫组织化学染色,尽早应用激素及免疫抑制剂治疗对疾病的预后至关重要。


























