
患者为31岁青年男性,确诊白塞病2年,予激素及免疫抑制剂治疗并维持。随后患者出现右下肢血栓及胫前皮肤溃疡,溃疡逐渐增大并多发。治疗上尝试大剂量激素、免疫抑制剂、抗凝药物、静脉丙种球蛋白、干扰素等药,效果均不佳。检索文献发现JAK通路活化与白塞病相关,尝试使用托法替布治疗取得显著效果。随访至今,患者情况稳定。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,31岁,于2015年无明显诱因下反复出现口腔溃疡、生殖器溃疡、皮肤脓丘疹,期间出现突发视力下降,同年9月就诊于眼科,诊断为"右眼葡萄膜炎",予"类固醇激素"治疗后好转。但反复口腔、生殖器溃疡及皮肤脓丘疹仍存在,并伴有低热,多关节肿痛,腕、肘,膝关节可受累,非对称性。2016年查ANA阴性,ENA阴性,ANCA阴性,HLA-B27阴性,抗CCP抗体阴性,RF阴性,ESR 97mm/1 h,CRP 58 mg/L,诊断为白塞病(Behçet′s disease)(根据2014年白塞病的国际分类标准),给予"泼尼松10 mg每日1次、硫唑嘌呤(AZA)100 mg每日1次、沙利度胺100 mg每日1次"治疗,病情好转,激素逐渐减停。2016年9月出现下肢红斑伴局部皮肤破溃,来我科就诊,继续前方案治疗有效,下肢皮肤破溃逐渐愈合。2017年3月患者出现右下肢肿胀,行血管超声检查提示:小腿肌间静脉血栓形成,加用华法令抗凝治疗,1个月后复查下肢血管超声及下肢血管CT血管造影(CTA)均未见明显异常。2018年1月患者出现右下肢胫骨前外侧皮肤坏死改变(见图1A),大小3 cm×6 cm,继而发展为溃疡(见图1B)。治疗上先后给予"甲泼尼龙、环磷酰胺(CTX)、甲氨蝶呤(MTX)、硫唑嘌呤、环孢素A(CsA)、沙利度胺"治疗,期间因反复出现感染,应用了抗感染、静脉丙种球蛋白(IVIG)注射,但效果不明显。查γ干扰素释放实验(IGRAs)结果呈阳性,不能排除潜在结核感染(LTB),遂予4个月的异烟肼、利福平联合的预防性抗结核方案[1],但患者未规律服用,复查IGRAs检查结果仍阳性,且下肢溃疡呈加重趋势,进一步行皮肤溃疡活检(见图2),病理并未发现干酪样坏死及结核分枝杆菌的证据,故仍考虑为潜在结核感染(LTB),继续正规预防性抗结核治疗3个月后停用。2018年5月曾使用干扰素(IFN-γ)1个月,但原溃疡周围又出现1个新发小溃疡(见图1C),遂停用IFN-γ。2018年8月患者出现白细胞减少及贫血,予"甲泼尼龙1.0 g/d"冲击治疗3 d,调整了免疫抑制剂,但下肢溃疡仍未见明显改善(见图1D)。2018年9月开始,给予患者托法替布(5 mg,每日2次口服),联合环磷酰胺(0.1 g,隔日1次口服),类固醇激素逐渐减量,用药1个月后右下肢溃疡愈合好转(见图1E),3个月后激素减停。之后每3个月随诊1次,复查肝功能、肾功能及血常规变化,除了有轻度的ALT升高以外,没有发现其他不良反应。2019年6月随访下肢溃疡未见复发,局部皮肤可见色素缺失(见图1F)。
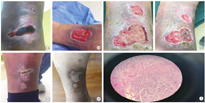

白塞病是一种多系统受累的慢性炎症性疾病,具有复杂的遗传背景,伴随固有免疫和获得性免疫的促炎因子的激活。临床表现中皮肤黏膜表现尤为突出,最常见的是口腔溃疡,但外阴溃疡比口腔溃疡更具特异性。皮肤溃疡发生率低,但却是白塞病的特点之一[2]。Jung等[3]认为白塞病引起的下肢溃疡虽然少见,通常与血管炎症反应或深静脉血栓相关,对传统免疫抑制剂反应不佳。有研究认为TNF-α拮抗剂可能对下肢溃疡有效[4]。本例患者是典型的白塞病合并下肢巨大溃疡,应用多种免疫抑制剂联合类固醇激素治疗效果不佳,因存在LTB,放弃使用英夫利西单抗,选择托法替布治疗,获得了满意的治疗效果。
白塞病的皮肤溃疡考虑血管病变[3],但不同于其他血管炎,静脉受累多于动脉,存在显著的血栓倾向,这种倾向往往与血管局部炎症相关,不能单纯以凝血异常因素来解释[5]。本例病理报告未发现血管炎的改变可能是因为在发生溃疡后没有及时行病理检查,经过半年的激素及免疫抑制剂治疗,导致病理报告没有阳性发现,但仍帮我们排除了结核直接感染的可能。下肢静脉血栓形成可以被认为是白塞病血管受累的一个标志[6]。患者下肢溃疡形成的可能原因包括血栓形成和血管炎。该患者在溃疡形成前有明确的下肢静脉血栓病史,下肢溃疡形成过程中没有出现过间断性跛行和疼痛,考虑该患者的下肢溃疡是静脉血管受累后出现的并发症。下肢静脉血栓形成导致局部皮肤缺血缺氧,同时局部的血管炎症仍然存在,两者相互作用,共同促进了皮肤溃疡的形成和发展。
白塞病与结核感染在发病机制上也有密切关系。结核菌可模拟溃疡以及结节性红斑等皮肤表现,活动性结核在白塞病患者中也常见,抗结核治疗后这些症状得到缓解[7]。结核分枝杆菌可能通过分子模拟触发疾病,另一方面,白塞病患者细胞介导免疫受损可能会增加结核病的易感性[8],而使用糖皮质激素、免疫抑制剂也会增加结核病复发的风险。因此,在白塞病患者中识别结核感染非常重要。结核菌素皮肤试验(TST)原本是筛查结核感染的有效方法之一,针刺反应阳性的白塞病患者可导致TST假阳性,这使得临床上使用TST对白塞病患者进行结核感染筛查的结果受到影响[9]。IGRAs与卡介苗接种及非结核性分枝杆菌感染没有交叉反应,显示出比TST更高的特异性,阳性的IGRAs对白塞病患者的潜在结核感染具有强烈的提示作用。该患者自2018年1月出现皮肤溃疡以来,先后2次检测IGRAs结果均呈阳性,皮肤溃疡活检及其他检查未发现活动性结核感染依据,故排除结核分枝杆菌直接导致的皮肤溃疡,但考虑患者存在LTB,因此进行了预防性抗结核治疗。白塞病患者轻度的皮肤病变可使用秋水仙碱,类固醇激素往往用于秋水仙碱无效的患者[3]。有回顾性研究报道,免疫抑制剂的使用可以减少血管白塞的复发,延长患者的生存率[10]。对于伴有血栓形成的患者来说,抗凝治疗并没有额外的效果。抗凝治疗目前对于白塞病的血管病变还存在争议。2018年EULAR关于白塞病的指南还提到其他治疗药物,包括IFN-α和TNF-α拮抗剂,临床上也取得了非常好的疗效。但该患者对上述治疗应答均不明显。另该患者在2018年6月因溃疡加重,曾试图考虑使用英夫利西治疗,因患者存在LTB,考虑到患者长期接受免疫抑制治疗,LTB再激活的风险增加,使用TNF-α拮抗剂风险升高,临床医生最终放弃了该类药物的选择。
研究已经发现Ⅰ/Ⅱ型细胞因子与细胞因子受体结合通过Janus激酶/信号转导及转录激活因子(signaltransducersandactivators oftranscription,JAK-STAT)通路在感染、肿瘤和免疫性疾病中发挥作用。Tulunay等[11]研究发现JAK-STAT通路与RA、炎性肠病、PsA等疾病相关,并证实了白塞病患者体内通过升高血辅助性T细胞(Th)1/Th17细胞因子的表达激活JAK1/STAT3信号通路。鲍华芳等[12]发现STAT3通路激活可能通过介导白塞病患者Th1和Th17活化而与白塞病活动性相关。也有报道发现白塞病合并眼部病变的患者与JAK1基因的3个可变区相关[13]。以调控JAK-STAT通路为目标的治疗未来可能成为白塞病治疗的新选择,如托法替布(JAK1/3抑制剂)。本例患者出现溃疡长达10个月,使用目前已有的方法均没有收到效果。但因为潜在结核感染再激活的风险,未选择TNF-α抑制剂,而尝试了托法替布。我们的治疗经验提示托法替布在本例患者的治疗过程中效果奇好,起效快,加用1个月后溃疡开始明显的愈合好转,且不良反应较少。联合托法替布治疗有助于类固醇激素的平稳减撤。使用托法替布10个月内无口腔溃疡、外阴溃疡、眼部病变及皮肤溃疡的复发,提示维持治疗也能达到较好的效果,但患者的减药方案及用药疗程目前还需进一步观察和探讨。
总之,目前还没有托法替布治疗白塞病引起的难治性下肢皮肤溃疡的报道。未来以JAK-STAT通路为目标的治疗可能成为白塞病难治性下肢皮肤溃疡治疗的一个新选择。
所有作者均声明不存在利益冲突



























