
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
活体共焦显微镜(IVCM)检查是一种无创检查技术,以激光为光源,具有高分辨率(1 μm),高清晰度的优点,通过连续共焦扫描,可以清晰获取活体角膜各层组织和细胞的图像,是临床从细胞水平深入探讨疾病病理机制的重要研究手段之一[1]。本研究收集了2014年8月至2015年5月间临床诊断为病毒性角膜炎的患者50例,通过应用角膜共焦显微镜(HRT),观察治疗前后上皮型角膜炎、基质型角膜炎和内皮型角膜炎患者各层细胞的形态学改变,为深入探讨角膜炎的发病机制和转归提供形态学依据。
本研究为回顾性分析。2014年8月至2015年5月在北京大学第三医院眼科门诊临床诊断为病毒性基质型角膜炎的50例患者,其中男23例,女27例,年龄17~76(55±11)岁。
患者诊断标准[2,3]:(1)既往有或无病毒性角膜炎病史;(2)典型临床表现:角膜溃疡、角膜基质水肿、大量新生血管的长入、前房反应等;(3)单眼发病。排除标准:(1)经眼科常规检查、上皮细胞刮片检查、HRT、细菌培养、真菌培养等诊断为角膜细菌、真菌、阿米巴感染的患者;(2)合并眼部其他疾病如流行性角结膜炎、虹膜炎等;(3)角膜变薄,有穿孔可能;(4)近期有眼内手术史和(或)有穿透性眼外伤史;(5)糖尿病、免疫系统疾病及合并全身疾病患者;(6)高龄,存在严重的可能阻碍随访的健康问题(如严重心、肺、肾脏疾病等);(7)双眼角膜炎;(8)依从性差的患者。
所有患者进行裂隙灯显微镜检查(日本Topcon,SL-3G,放大倍率:16倍)。
所有患者的HRT检查(德国海德堡视网膜激光断层扫描系统Ⅲ代-Rostock角膜模块)由同一名眼科医师完成。共焦显微镜激光波长670 nm,观察视野400 μm×400 μm,放大倍率800倍,分辨率1 μm。采用Section模式逐层扫描病变角膜全层,观察就诊时、治疗2周后、治疗1个月后的各层组织和细胞形态特征,对侧正常眼同时进行检查,作为对照。
(1)上皮型角膜炎:更昔洛韦眼用凝胶2~4次/d,小牛血去蛋白眼用凝胶2次/d。(2)基质型角膜炎:更昔洛韦眼用凝胶4~6次/d;口服更昔洛韦胶囊0.5~1.0 g/次,3次/d;醋酸泼尼松龙滴眼液2~4次/d;复方托吡卡胺滴眼液2次/d。(3)内皮炎型角膜炎:更昔洛韦眼用凝胶4~6次/d,醋酸泼尼松龙滴眼液4次/d,妥布霉素地塞米松眼膏1次/晚。上述眼药水用量1~2滴/次,眼用凝胶0.5 ml/次。
药物治疗1~2周,如角膜溃疡较前缩小,结膜充血及前房反应减轻,糖皮质激素滴眼液逐渐减量,抗病毒药物不减。所有患者角膜上皮和基质水肿消失,角膜后沉积物(keratic precipitate,KP)吸收,梯度逐渐停用糖皮质激素滴眼液和抗病毒药物。所有患者的随访时间为2~3个月。
采用统计软件SPSS 19.0分析数据,符合正态分布的计量资料以 ±s表示,计数资料用例数和百分率表示,采用描述性统计分析。
±s表示,计数资料用例数和百分率表示,采用描述性统计分析。
共50例患者,其中男23例,占46.0%,女27例,占54.0%。上皮型角膜炎10例,基质型角膜炎20例,内皮炎型角膜炎20例。
3种类型病毒性角膜炎患者均表现为上皮下神经纤维丛密度明显减低甚至消失(图1A),神经纤维变细,与对侧正常眼(图1B)上皮型神经纤维丛密度情况比较,基底细胞层可见活化的树突状朗格汉斯细胞聚集(图1C),随着治疗好转树突状朗格汉斯细胞密度下降(图1D)。但不同类型还有各自的特点,见表1。
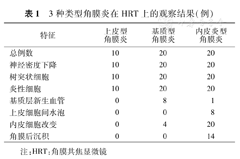
3种类型角膜炎在HRT上的观察结果(例)
3种类型角膜炎在HRT上的观察结果(例)
| 特征 | 上皮型角膜炎 | 基质型角膜炎 | 内皮炎型角膜炎 |
|---|---|---|---|
| 总例数 | 10 | 20 | 20 |
| 神经密度下降 | 10 | 20 | 20 |
| 树突状细胞 | 10 | 20 | 20 |
| 炎性细胞 | 10 | 20 | 20 |
| 基质层新生血管 | 0 | 8 | 1 |
| 上皮细胞间水泡 | 0 | 0 | 8 |
| 内皮细胞改变 | 0 | 4 | 20 |
| 角膜后沉积 | 0 | 0 | 14 |
注:HRT:角膜共焦显微镜
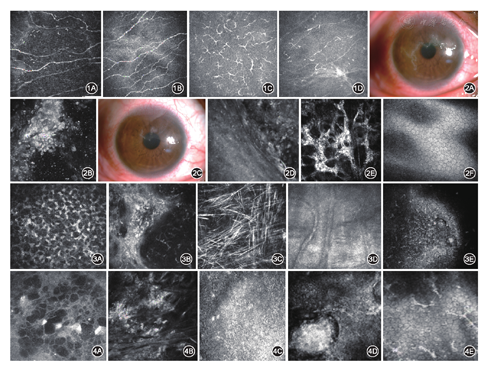

裂隙灯下右眼上皮树枝状角膜溃疡(图2A),在HRT上表现为上皮细胞肿胀,反光增强,其间可见多量炎性细胞浸润(图2B)。治疗2周后可见溃疡逐渐缩小(图2C),炎性细胞浸润逐渐减少(图2D)。病程较长者浅基质角膜基质细胞活化,细胞体明显肿胀,反光增强(图2E)。内皮层内皮细胞大小、形态一般正常,不受影响(图2F)。
基质细胞肿胀,其间可见多量炎性细胞浸润(图3A),随着治疗好转炎性细胞浸润逐渐减少,角膜基质细胞胞体肿胀减轻,核边界清晰。病程较长者,基质内可见不规则高反光瘢痕形成(图3B),病情反复复发的患者基质内可见大量不规则松针样瘢痕形成(图3C),并可见新生血管形成(图3D)。角膜内皮细胞改变一般不明显。但是部分患者若不及时治疗,可出现内皮细胞肿胀,失去多边形结构,边界模糊的现象(图3E)。
角膜上皮细胞肿胀,细胞间隙增宽,严重者上皮细胞间出现水泡或大泡(图4A),经过治疗后,角膜上皮细胞形态可基本恢复正常。基质细胞肿胀(图4B),反光增强,病程较长者基质内可见多量炎性细胞浸润及瘢痕形成。极少数反复发作的患者可出现基质深层的新生血管。角膜内皮细胞肿胀,失去多边形结构,边界模糊(图4C),计数减少,内皮细胞间可见KP(图4D~E),随着治疗和病变恢复,KP可逐渐被吸收,角膜内皮细胞可重新覆盖原来缺损的区域,形态也逐渐恢复正常。
50例中有27例用药后7 d角膜水肿基本消退,但可见到明显的KP,42例患者在连续治疗2周后角膜可恢复透明,内皮面KP明显减少或消退。5例合并继发性青光眼的患者均于7 d内眼压降至正常范围,停用降压药物后未见升高。通过活体角膜激光共焦显微镜观察发现基质型的20例患者中有8例患者基质层出现了新生血管的长入,其中6例血管在治疗后消退;4例患者出现了内皮细胞的改变。
目前治疗病毒性角膜炎较为统一的治疗方法是抗病毒治疗和糖皮质激素联合使用。但是,如何准确而客观地根据病情调整用药及选择停药时间是临床医师关心的重要问题。本研究通过应用HRT观察炎性细胞浸润、角膜上皮层、基质层和内皮层细胞的损害程度,病毒性角膜炎患者各层细胞随病情发展的形态改变及其随治疗的变化,为临床角膜炎的诊断、治疗及预后提供了依据和指导。
目前研究发现,多种眼表及全身疾病,如圆锥角膜、干眼症、糖尿病等,均可出现角膜上皮下神经纤维密度不同程度减少,甚至消失,其确切原因尚不清楚[4,5,6,7]。本研究观察发现50例(100%)患者病灶区出现上皮下神经纤维丛密度明显减低,甚至消失,提示角膜炎时神经纤维可直接受到不同程度的破坏。对于共焦显微镜上皮下神经密度明显降低的患者要警惕在后期治疗中出现神经营养不良性角膜病变的可能,加用角膜上皮保护类药物,并注意减少含防腐剂类的眼部用药。
在治疗过程中我们发现对于病程较短或及时治疗角膜基质层受累的病例,虽然可以看到角膜基质细胞肿胀,其间多量炎性细胞浸润,但角膜可无明显瘢痕和(或)新生血管形成,相反如果病程迁延不愈或反复发作,活化的角膜基质细胞可向成纤维细胞转化,促使瘢痕形成[8,9],还可能会出现内皮细胞的改变。Hillenaar等[10]研究发现,对内皮型角膜炎患者延期应用皮质类固醇激素会加重角膜内皮数的丢失。而且,通过对内皮层的观察我们还发现KP可直接突破内皮细胞间的连接,使内皮细胞出现缺损区,加重角膜水肿。因此,我们更应进行早期及时有效的治疗,可防止炎症的迁延,减少瘢痕、新生血管的形成及内皮细胞的改变。


























