
研究温州地区近三年呼吸道非结核分枝杆菌(NTM)的分离率、菌种分布及其变化趋势。
收集2014年1月至2016年12月疑似肺结核的患者,送检痰或肺泡灌洗液进行分枝杆菌培养,分枝杆菌阳性菌株进一步采用基因芯片、16S rRNA和hsp65基因测序进行菌种鉴定。采用SPSS 19.0软件对数据进行分析。
剔除重复菌株后,共分离3 295株,包括结核分枝杆菌复合群(MTB)3 032株、NTM 238株、戈登氏菌属20株、诺卡氏菌属3株和束村氏菌属2株。2014至2016年NTM占分枝杆菌构成比分别为8.5%(86/1 006)、6.7%(72/1 079)和6.8%(80/1 185)(χ2=2.459,P>0.05);NTM总分离率为7.3%(238/3 270),NTM菌种类别达15种,前三位菌种分别为胞内分枝杆菌(52.5%, 125/238)、脓肿分枝杆菌(22.7%,54/238)和鸟分枝杆菌(10.1%,24/238),其他NTM仅占14.7%(35/238)。鸟分枝杆菌从2014年的第五位上升至2016年的第二位(χ2=18.259,P<0.01),而脓肿分枝杆菌占NTM构成比从2014年的34.9%(30/86)下降至2016年的17.5%(14/80) (χ2=7.335,P<0.01)。分离出NTM的患者,男性占56.7%(135/238),年龄>45岁占79.8%(190/238)。
近三年温州地区NTM分离率呈平稳趋势。菌种以胞内分枝杆菌、脓肿分枝杆菌和鸟分枝杆菌为主,鸟分枝杆菌分离呈持续上升趋势,而脓肿分枝杆菌分离出现下降趋势,值得临床医师关注。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,在疑似肺结核患者的呼吸道标本中,非结核分枝杆菌(NTM)的分离呈增多趋势,其与临床的相关性日益受到重视。呼吸道分离NTM最常见的菌种以胞内分枝杆菌、鸟分枝杆菌和脓肿分枝杆菌为主,但NTM分离率及其菌种分布因不同国家和地区而异[1,2,3,4]。最近报道,在疑似肺结核患者的抗酸阳性分离株中,亦鉴定出弱抗酸细菌,如戈登氏属、诺卡氏菌和束村氏菌属,值得临床关注[5,6]。目前温州地区疑似肺结核患者呼吸道NTM的流行情况不详,因此,有必要对NTM分离株进行菌种鉴定,进一步了解温州地区呼吸道NTM分离率、菌种分布及其变化趋势,为全省的NTM流调以及临床诊治提供参考。温州市中心医院是结核病定点医院以及耐多药结核病诊疗中心,温州各区县定点医院培养到的分枝杆菌阳性菌株常规送往该单位进行鉴定及药物敏感试验。本研究对温州地区2014至2016年分枝杆菌阳性菌株进行鉴定分析。
连续收集2014年1月至2016年12月疑似为肺结核的患者,送检痰或肺泡灌洗液进行分枝杆菌培养,分枝杆菌培养阳性菌株经抗酸染色确认后,阳性株进一步进行菌种鉴定,所有菌株来源于温州市中心医院结核病实验室以及各区县定点医院结核病实验室(除乐清市人民医院外,各区县定点医院培养到的分枝杆菌阳性菌株均常规送至温州市中心医院鉴定)。
温州市中心医院采用快速全自动分枝杆菌培养/药敏检测系统(Bactec MGIT system),各区县定点医院主要采用改良罗氏培养法。
结核分枝杆菌(MTB)与NTM分群初筛主要采用MPB64抗原检测或/和PNB/TCH生长试验进行鉴别。
采用SPSS 19.0软件进行数据分析。NTM分离率和各年度构成的趋势分析采用χ2检验,以P<0.05为差异具有统计学意义。
温州中心医院结核病实验室收到7 430份呼吸道标本进行分枝杆菌培养,各区县定点医院送检2 867份分枝杆菌培养阳性的临床标本至温州市中心医院行进一步鉴定和药敏试验,共收集温州地区10 297份临床标本。分枝杆菌培养阳性菌株经抗酸染色确认4 599株,予MPB64抗原检测或PNB/TCH生长试验初筛鉴定MTB和NTM分别为4 186株和413株。剔除未菌种鉴定的初筛NTM(58株)以及重复菌株(1 246株)(同一患者多次分离鉴定为同一菌种,按一株计算)后,共有3 295株。菌种鉴定发现62株初筛鉴定有误,其中46株原鉴定为NTM,最终菌种鉴定为MTB 26株、戈登氏菌属16株、诺卡氏菌属2株和束村氏菌属2株;发现16株原鉴定为MTB有误,最终菌种鉴定为NTM 11株、戈登氏菌属4株和诺卡氏菌属1株。菌种鉴定为NTM共238株(已剔除重复菌株83株),占分枝杆菌的7.3%(238/3 270)。
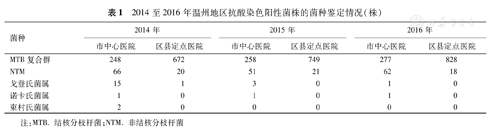
抗酸染色阳性菌株行菌种鉴定,主要为MTB和NTM。此外,亦鉴定出弱抗酸细菌,如戈登氏属、诺卡氏菌和束村氏菌属。近三年温州地区NTM分离率分别为8.5%(86/1 006)、6.7%(72/1 079)和6.8%(80/1 185)(χ2=2.459,P>0.05),近三年温州市中心医院NTM分离率分别为21.0%(66/314)、16.5%(51/309)和18.3%(62/339)(χ2=0.757,P>0.05),而区县定点医院NTM分离率分别为2.9%(20/692)、2.7%(21/770)和2.1%(18/846)(χ2=0.926,P>0.05)。近三年温州市中心医院NTM总分离率高于区县定点医院(χ2=259.205,P<0.01)(表1)。
2014至2016年温州地区抗酸染色阳性菌株的菌种鉴定情况(株)
2014至2016年温州地区抗酸染色阳性菌株的菌种鉴定情况(株)
| 菌种 | 2014年 | 2015年 | 2016年 | |||
|---|---|---|---|---|---|---|
| 市中心医院 | 区县定点医院 | 市中心医院 | 区县定点医院 | 市中心医院 | 区县定点医院 | |
| MTB复合群 | 248 | 672 | 258 | 749 | 277 | 828 |
| NTM | 66 | 20 | 51 | 21 | 62 | 18 |
| 戈登氏菌属 | 15 | 1 | 3 | 0 | 1 | 0 |
| 诺卡氏菌属 | 1 | 0 | 1 | 0 | 1 | 0 |
| 束村氏菌属 | 2 | 0 | 0 | 0 | 0 | 0 |
注:MTB. 结核分枝杆菌;NTM. 非结核分枝杆菌
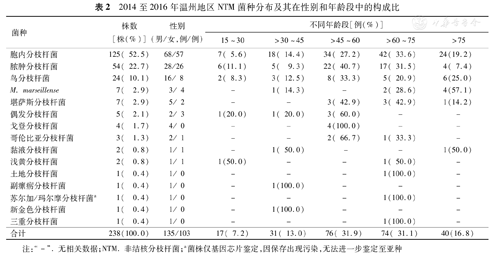
共鉴定NTM 238株,菌种分布达15种,以胞内分枝杆菌(52.5%,125/238)、脓肿分枝杆菌(22.7%,54/238)和鸟分枝杆菌(10.1%, 24/238)为主,其他NTM仅占14.7%(35/238)。分离出NTM的患者,男性占56.7%(135/238),女性占43.3%(103/238)。患者的年龄为15~90岁,中位年龄为59岁,>45岁占79.8%(90/238)(表2)。
2014至2016年温州地区NTM菌种分布及其在性别和年龄段中的构成比
2014至2016年温州地区NTM菌种分布及其在性别和年龄段中的构成比
| 菌种 | 株数 [株(%)] | 性别 (男/女,例/例) | 不同年龄段[例(%)] | ||||
|---|---|---|---|---|---|---|---|
| 15~30 | >30~45 | >45~60 | >60~75 | >75 | |||
| 胞内分枝杆菌 | 125( 52.5) | 68/57 | 7( 5.6) | 18( 14.4) | 34( 27.2) | 42( 33.6) | 24(19.2) |
| 脓肿分枝杆菌 | 54( 22.7) | 28/26 | 6(11.1) | 5( 9.3) | 22( 40.7) | 17( 31.5) | 4( 7.4) |
| 鸟分枝杆菌 | 24( 10.1) | 16/ 8 | 2( 8.3) | 3( 12.5) | 8( 33.3) | 5( 20.9) | 6(25.0) |
| M. marseillense | 7( 2.9) | 3/ 4 | - | 1( 14.3) | - | 2( 28.6) | 4(57.1) |
| 堪萨斯分枝杆菌 | 7( 2.9) | 5/ 2 | - | - | 3( 42.9) | 3( 42.9) | 1(14.2) |
| 偶发分枝杆菌 | 5( 2.1) | 2/ 3 | 1(20.0) | 1( 20.0) | 3( 60.0) | - | - |
| 戈登分枝杆菌 | 4( 1.7) | 4/ 0 | - | - | 4(100.0) | - | - |
| 哥伦比亚分枝杆菌 | 3( 1.3) | 2/ 1 | - | - | 2( 66.7) | 1( 33.3) | - |
| 黏液分枝杆菌 | 2( 0.8) | 1/ 1 | - | 1( 50.0) | - | - | 1(50.0) |
| 浅黄分枝杆菌 | 2( 0.8) | 1/ 1 | 1(50.0) | - | - | 1( 50.0) | - |
| 土地分枝杆菌 | 1( 0.4) | 1/ 0 | - | - | - | 1(100.0) | - |
| 副瘰疬分枝杆菌 | 1( 0.4) | 1/ 0 | - | 1(100.0) | - | - | - |
| 苏尔加/玛尔摩分枝杆菌a | 1( 0.4) | 1/ 0 | - | - | - | 1(100.0) | - |
| 新金色分枝杆菌 | 1( 0.4) | 1/ 0 | - | 1(100.0) | - | - | - |
| 三重分枝杆菌 | 1( 0.4) | 1/ 0 | - | - | - | 1(100.0) | - |
| 合计 | 238(100.0) | 135/103 | 17( 7.2) | 31( 13.0) | 76( 31.9) | 74( 31.1) | 40(16.8) |
注:"-" . 无相关数据;NTM. 非结核分枝杆菌;a菌株仅基因芯片鉴定,因保存出现污染,无法进一步鉴定至亚种
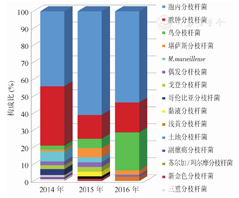
NTM中前三位的菌种分布排序,2014年依次为胞内分枝杆菌44.2%(38/86),脓肿分枝杆菌34.9%(30/86)和M.marseillense 5.8%(5/86);2015年依次为胞内分枝杆菌61.1%(44/72)、脓肿分枝杆菌13.9%(10/72)以及堪萨斯分枝杆菌和鸟分枝杆菌均占5.5%(4/72);2016年依次为胞内分枝杆菌53.8%(43/80)、鸟分枝杆菌22.5%(18/80)和脓肿分枝杆菌占17.5%(14/80)。鸟分枝杆菌分离有上升趋势,从2014年的第五位上升至2016年的第二位(χ2=18.259,P<0.01);而脓肿分枝杆菌分离呈下降趋势(χ2=7.335,P<0.01);鸟胞内分枝杆菌复合群(MAC)占分离的NTM构成比从2014年的55.8%(48/86)迅速升至2016年76.3%(61/80),有上升趋势(χ2=7.833,P<0.01)(图1)。

温州地区属于浙江省MTB高发病率地区,而近三年温州市中心医院单家医院NTM总分离率接近20%,因NTM对抗结核药物高度耐药,易误诊为耐药结核。因体外药敏试验与体外疗效相关性尚未确定,首先应确定分离菌种有无临床意义,再考虑是否进行药敏试验,不建议对疑似NTM肺病进行经验性治疗[10,11]。迄今尚无针对所有NTM菌种的标准化药敏试验方法,美国临床实验室标准化协会 (CLSI) 对一些NTM菌种有推荐的药敏试验方法和药物临界浓度[10,11]。MGIT 960药敏只针对MTB药敏,对NTM药敏结果尚不可靠,如有条件的实验室,建议按照CLSI的推荐开展特定菌种的NTM药敏试验方法,以指导临床治疗。另需注意,快速生长分枝杆菌MGIT 960药敏结果绝大多数在4 d内会报错,往往会想到NTM,极少数可能会4 d后报阳(可能与稀释浓度或培养基营养状态有关);而慢生长分枝杆菌药敏结果一般7 d后才开始报阳。因此,对耐药菌株,除复核结果的可靠性外,如对菌落形态有疑问,或报耐多药,应进行基因鉴定菌种水平以免误诊。
温州地区近三年NTM分离率处于稳定趋势,与北方地区报道相一致[12,13],而我国大部分地区NTM呈逐年上升趋势[4,14,15,16]。我国NTM分离率从北向南亦呈增加趋势,可能与气候和地理环境有关[17]。值得注意的是,温州市中心医院NTM分离率显著高于各区县医院,可能与采用的培养系统不同有关,Bactec MGIT系统不论对MTB或NTM的检出率均显著高于改良罗氏培养基,Bactec MGIT肉汤培养基营养丰富,可增加分枝杆菌分离率[18,19,20,21],也可分离出更多弱抗酸细菌,如戈登氏菌属、诺卡氏菌属和束村氏菌属,需注意鉴别是否污染或致病菌。
该地区菌种分布较广,最常见NTM菌种以胞内分枝杆菌、脓肿分枝杆菌和鸟分枝杆菌为主,与杭州地区相一致,但胞内分枝杆菌构成比高于杭州地区[14],而低于山东地区[13];上海市NTM菌种以堪萨斯分枝杆菌、胞内分枝杆菌和龟/脓肿分枝杆菌复合群为主,所占比例分别为45.0%、20.8% 和14.9%[4];广州市以龟/脓肿分枝杆菌复合群占优势(43.18%),其次为MAC(18.24%),第三位为戈登分枝杆菌(8.53%)[16];中国台湾地区NTM菌种也存在地理分布差异,北部以MAC为主(44.19%),而南部以脓肿分枝杆菌为主(44.8%)[22]。韩国以MAC和脓肿分枝杆菌/马赛分枝杆菌复合群为呼吸道NTM最常见菌种,各占53%和25%[2]。日本一项基于全国多中心的NTM流行学调查发现MAC为NTM肺病最常见致病菌,占93.3%,但日本地区不同菌种分布亦差异较大[23]。美国俄勒冈州和北卡罗来纳州中部等多数地区呼吸道NTM菌种以MAC最为常见,可高达86%[3,24]。意大利、英国、荷兰和法国等多数欧洲国家以MAC最常见,约占35~60%[25,26,27,28],欧洲其他国家如克罗地亚、希腊和比利时最常见的呼吸道NTM菌种为戈登分枝杆菌[29,30,31]。澳大利亚昆士兰州呼吸道NTM以MAC为最常见菌种,占52.43%[32]。南非的一项研究发现,疑似肺结核患者最常见的NTM菌种为戈登分枝杆菌,其次是堪萨斯分枝杆菌和MAC[33]。因此,菌种分布因地理环境不同而相差较大,全球以MAC为最常见。
NTM菌种分布变化趋势,亦因地区不同而异。上海市2008至2012年前三位菌种分布变化较大,2008年前三位依次为堪萨斯分枝杆菌(55.2%)、胞内分枝杆菌(25.9%)、龟/脓肿分枝杆菌(6.9%)和偶发分枝杆菌(6.9%),2012年为堪萨斯分枝杆菌(35.3%)、龟/脓肿分枝杆菌(28.9%)和胞内分枝杆菌(15.8%),其中龟/脓肿分枝杆菌持续上升[4],与本研究相反。本研究中MAC的分离率逐年上升,由原来的55.8%升至76.3%,与我国北方地区、北美和日本的MAC所占构成比接近[3,13,23],明显高于杭州和上海地区。鸟分枝杆菌逐年持续升高可能与当地饮水系统、医院供水系统、采样标本时接触自来水以及暴露等因素有关[34,35,36]。
本研究仍存在一些局限性:(1)属于回顾性分析,缺乏本地区所有鉴定菌株相关患者的临床资料,因多数是门诊患者和区县送检菌株,大多数疑似肺结核患者仅送检一次培养或仅分离一次NTM,甚至未送检,难以跟踪随访直至确诊或排除,因此,无法评估本地区疑似肺结核患者人群中NTM肺病的真正发病率及其变化趋势,有待进一步基于人群的多中心研究;(2)各区县定点医院和温州市中心医院采用的培养系统不同,故NTM分离率以及菌种分布多样性可能与实际分离有一定差异,待本地区所有定点医院采用Bactec MGIT培养系统后,有待进一步研究其流行趋势;(3)本研究采用两种菌种鉴定方法,2014至2015年均采用16S rRNA和hsp65基因测序,但2016年开始以基因芯片鉴定为主,因基因芯片鉴定菌种数量有限,如其他NTM或弱抗酸细菌无法鉴定,可能导致漏检,故2016年菌种分布多样性不如2014和2015年,可能与其有关。尽管存在一些不足,但本研究首次对温州地区各定点医院培养到的分枝杆菌阳性菌株进行鉴定分析,比较全面客观了解本地区呼吸道NTM的分离率、菌种分布及其变化趋势,为临床诊治提供参考价值。
温州地区NTM分离率处于平稳趋势,菌种分布以MAC和脓肿分枝杆菌为主。MAC占NTM构成比呈逐年上升趋势,特别是鸟分枝杆菌分离显著增加,原因不清,需进一步研究其分离菌株与当地环境,特别是饮水系统的相关性。另分离出弱抗酸细菌,临床上需警惕,以免误诊。因此,除常规开展基因芯片外,测序法鉴定至菌种水平具有重要意义。
利益冲突 无



























