
探讨腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术的临床疗效及经验。
采用回顾性横断面研究方法。收集2010年6月至2016年8月浙江大学医学院附属邵逸夫医院收治的94例行腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术患者的临床病理资料。腹腔镜下建立可操作手术空间,根据肝硬化程度、肿瘤大小、与重要血管毗邻关系、剩余肝脏体积等个体化选择行非解剖性与解剖性肝切除术。术中精准定位肿瘤、确定肝切除平面,选择合适肝脏离断器械及肝门血流阻断技术。观察指标:(1)手术及术后恢复情况。(2)术后病理学检查结果。(3)随访及生存情况。采用门诊和电话方式进行随访,了解患者生存情况。随访时间截至2017年6月。正态分布的计量资料以 ±s表示,偏态分布的计量资料以M(四分位数间距)表示。采用Kaplan-Meier法计算生存率。
±s表示,偏态分布的计量资料以M(四分位数间距)表示。采用Kaplan-Meier法计算生存率。
(1)手术及术后恢复情况:94例患者均顺利完成手术,无围术期死亡患者,73例行非解剖性肝切除术,21例行解剖性肝切除术。14例患者中转开腹。27例患者行肝门血流阻断。94例患者中位手术时间为187.5 min(75.0 min),中位术中出血量为200 mL(200 mL),15例患者予术中输血。18例患者发生术后并发症,其中胸、腹腔积液各6例,切口感染、腹腔感染、静脉血栓、出血、凝血功能障碍、肝功能不全各1例;并发症Clavien-Dindo分级:Ⅰ、Ⅱ、Ⅲ、Ⅳ级分别为11、1、5、1例。所有并发症经积极对症处理后好转。94例患者中位术后住院时间为7 d(6 d)。(2)术后病理学检查结果:94例患者肿瘤病理学类型:肝细胞癌45例,胆管细胞癌5例,转移性肝癌9例,肝脏良性肿瘤35例。(3)随访及生存情况:59例恶性肝肿瘤患者均获得术后随访。随访时间为6.0~52.0个月,中位随访时间为42.6个月。59例恶性肝肿瘤患者术后1、3年总体生存率为98.3%、84.7%。
在有经验的中心开展腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术安全可行,疗效确切。腹腔镜下可操作手术空间的建立、精准肿瘤定位及肝切除平面确定、采用合适肝脏离断器械及肝门血流阻断技术是手术成功的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自1991年Reich等[1]完成了全世界首例腹腔镜肝切除术后,经过20余年发展,腹腔镜肝切除技术日臻成熟,腹腔镜器械日益完善,在世界范围内得到极大推广与普及。与传统开腹手术比较,腹腔镜肝切除术具有创伤小、术中出血量少、术后并发症发生率低、术后住院时间短等优势,并与开腹手术具有相似的肿瘤学疗效[2,3,4,5]。2015年第2次世界腹腔镜肝切除术专家共识研讨会中,小范围腹腔镜肝切除术已形成标准操作步骤共识[6];而位于肝脏特殊部位(如Ⅶ、Ⅷ段)的肿瘤切除术,因术中视野暴露困难、手术设备难以到达及出血不易控制等原因,临床上仍处于探索阶段[7,8,9,10,11]。本研究回顾性分析2010年6月至2016年8月我科收治的94例行腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术患者的临床病理资料,探讨该手术的临床疗效及经验。
采用回顾性横断面研究方法。收集94例行腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术患者的临床病理资料,男57例,女37例;年龄为(52±14)岁。94例患者BMI为(24±3)kg/m2;29例患者既往有腹部手术史;肿瘤部位:肝脏Ⅶ段45例,Ⅷ段40例,Ⅶ、Ⅷ段交界9例;肿瘤数目:单发81例,多发13例;肿瘤中位直径为4.0 cm(2.8 cm);23例患者合并不同程度肝硬化;肝功能Child-Pugh A级93例,B级1例;美国麻醉医师协会(ASA)分级:Ⅰ级34例,Ⅱ级51例,Ⅲ级9例。本研究通过我院伦理委员会审批。患者及家属术前均签署手术知情同意书。
纳入标准:(1)肿瘤位于肝脏Ⅶ和(或)Ⅷ段。(2)肿瘤直径≤10.0 cm。(3)无失代偿期肝硬化及门静脉高压症,肝功能Child-Pugh分级为A、B级,术前评估肝脏储备功能良好,剩余肝脏体积能够耐受手术。(4)一般情况良好,心、肺等重要器官功能能够耐受手术。(5)临床病理资料完整。
排除标准:(1)肝脏恶性肿瘤合并门静脉、肝静脉或胆管癌栓,或侵犯膈肌、远处器官。(2)肝硬化失代偿期,合并门静脉高压症。(3)肝功能Child-Pugh分级为C级,肝脏储备功能欠佳或剩余肝脏体积不足以耐受手术。(4)心、肺功能差,难以耐受手术。(5)行腹腔镜右半肝及肝右后叶切除术。(6)临床病理资料缺失。
完善术前检查。采用气管插管全身麻醉,患者取头高足低位,右侧抬高30~45°。主刀医师站于患者左侧。采用4孔法行腹腔镜手术。根据剑突与脐部的距离,于脐上或脐下置入30°腹腔镜探头,剑突稍右侧置入12 mm Trocar作为主操作孔,右季肋区腋前线和锁骨中线肌缘下2~3 cm分别置入5 mm和12 mm Trocar,宁高勿低。主刀医师左手持超声刀,右手持吸引器,充分游离肝周韧带(图1),暴露肝脏Ⅶ、Ⅷ段及肝后下腔静脉(图2),建立可操作手术空间。
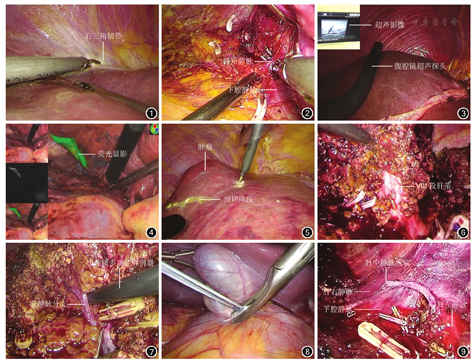

术中采用超声检查(图3)及吲哚菁绿分子荧光显像(图4)探查肝脏,明确肿瘤部位、数目、大小及与血管的关系。根据肝硬化程度、肿瘤大小、与重要血管毗邻关系、剩余肝脏体积等个体化选择行非解剖性与解剖性肝切除术。行非解剖性肝切除术者,结合术前影像学检查、肝脏三维重建、术中超声检查及荧光显像等结果,距肿瘤边缘1~2 cm处采用腹腔镜多功能解剖器拟定切除边界(图5);行解剖性肝切除术者,采用术中超声定位肝中静脉和肝右静脉,循肝静脉入路切开肝实质,找到Ⅶ、Ⅷ段肝蒂(图6),阻断相应区段入肝血流,根据缺血线或采用荧光反染色确定切除边界。助手向两侧牵拉保持一定张力,采用超声刀或腹腔镜多功能解剖器切开肝脏浅层,切开5 mm后采用刮吸解剖法解剖肝内管道(图7),离断肝实质。若采用荧光显像,可沿荧光显像界限离断肝实质。对直径<3 mm的较细管道,采用电凝处理;对直径≥3 mm的较粗管道,采用可吸收夹夹闭。对不易控制的出血,行间断第一肝门阻断(图8),每次阻断时间≤15 min,间隔5 min。术毕,冲洗肝脏创面(图9),检查有无出血和胆汁漏。视术中情况决定是否放置腹腔引流管。将标本置入标本袋,经腹下区切口取出。
(1)手术及术后恢复情况:手术方式、中转开腹例数及原因、行肝门血流阻断例数、手术时间、术中出血量、术中输血例数、术后并发症情况、术后住院时间。(2)术后病理学检查结果:肿瘤病理学类型。(3)随访及生存情况:患者生存情况。
采用门诊和电话方式进行随访,了解患者生存情况。随访时间截至2017年6月。
应用SPSS 22.0统计软件进行分析。正态分布的计量资料以 ±s表示,偏态分布的计量资料以M(四分位数间距)表示。采用Kaplan-Meier法计算生存率。
±s表示,偏态分布的计量资料以M(四分位数间距)表示。采用Kaplan-Meier法计算生存率。
94例患者均顺利完成手术,无围术期死亡患者,73例行非解剖性肝切除术(肿瘤部位:Ⅶ段30例,Ⅷ段34例,Ⅶ、Ⅷ段交界9例),21例行解剖性肝切除术(肿瘤部位:Ⅶ段15例,Ⅷ段6例)。14例患者中转开腹,原因:腹腔粘连及暴露困难11例,出血2例,气体栓塞1例;80例患者完成腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术。27例患者行肝门血流阻断。94例患者中位手术时间为187.5 min(75.0 min),中位术中出血量为200 mL(200 mL),15例患者予术中输血。18例患者发生术后并发症,其中胸、腹腔积液各6例,切口感染、腹腔感染、静脉血栓、出血、凝血功能障碍、肝功能不全各1例;并发症Clavien-Dindo分级:Ⅰ、Ⅱ、Ⅲ、Ⅳ级分别为11、1、5、1例。所有并发症经积极对症处理后好转。94例患者中位术后住院时间为7 d(6 d)。
94例患者肿瘤病理学类型:肝细胞癌45例,胆管细胞癌5例,转移性肝癌9例,肝脏良性肿瘤35例。
59例恶性肝肿瘤患者均获得术后随访。随访时间为6.0~52.0个月,中位随访时间为42.6个月。59例恶性肝肿瘤患者术后1、3年总体生存率为98.3%、84.7%。
根据Ban等[7]的腹腔镜肝切除术难度评分系统,肝脏Ⅶ、Ⅷ段手术因其特殊的解剖位置,难度较高,评分≥5分,属中、高等难度手术范畴。尽管腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术适应证与开腹手术基本相同,但对于选择行腹腔镜或开腹手术、解剖性肝切除术或非解剖性切除术,需根据各中心腹腔镜肝切除技术条件,并结合患者疾病特点进行个体化选择。尽管近年来腹腔镜解剖性肝切除术治疗恶性肿瘤越来越多,但尚无充分证据显示其能明显提高患者总体生存率。因肝脏Ⅶ、Ⅷ段位置的特殊性,行解剖性肝切除术仍存在一定困难。本研究94例患者中,21例行解剖性肝切除术。
笔者认为:手术入路的个体化选择及可操作手术空间的建立是顺利开展腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术的基础。合适的患者体位及布孔方式尤为重要。目前,国内外学者一般采用头高足低仰卧位,左倾15~45°;脐上或脐下置入30°腹腔镜探头,4个Trocar一般沿右侧肋弓及肿瘤所在肝段呈扇形分布;需行肝门血流阻断时,于脐周置1个Trocar便于放置肝门阻断带[12,13]。此外,亦有学者采用头低足高截石位,左倾15~25°,主刀医师站于患者两腿之间;脐上或脐下置入30°腹腔镜探头,2个5~10 mm Trocar置于脐上3指水平的腹部两侧,并于剑突下放置5 mm Trocar[14]。上述两种常用体位及布孔方式,能够显露肝脏Ⅶ、Ⅷ段外侧病灶,利于肿瘤的根治及术中止血。亦有学者提出经胸腔入路,利用带有球囊的套管于右侧腋后线第9肋骨经胸腔穿过横膈进入腹腔,从而充分暴露肝右后叶及裸区,扩大腹腔镜下肝右后外侧操作范围,避免损伤右侧肝短静脉,降低中转开腹率,减少术中出血量,缩短手术时间[15,16]。但经胸腔入路腹腔镜手术存在胸腔器官损伤及术后气胸等问题,仅适用于肝脏Ⅶ、Ⅷ段局部切除术[17]。笔者中心采用的患者体位及布孔方式(见前文"1.3 手术方法"),获得了满意效果。
腹腔镜下精准的肿瘤定位及肝切除平面确定也是施行腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术的关键,尤其对于恶性肿瘤,精准切除并保证安全切缘是难点。笔者中心结合术前三维重建、术中超声检查和吲哚菁绿分子荧光显像对肿瘤精准定位,术中实时导航,目前已完成100余例肝脏三维重建。术者于术前即可直观了解肝脏肿瘤部位、大小、形态及与肝内外各管道关系、下腔静脉和腹腔血管间的关系,有助于腹腔镜下肝切除平面的把握。腹腔镜术中超声检查必不可少,但因肝脏Ⅶ、Ⅷ段肿瘤位置深在、膈下空间狭小且受肝脏膈顶凸面影响,常需非常充分的右肝周韧带游离,避免超声探查盲区。因此,可先采用腹腔镜下超声检查辨认肝中静脉、肝右静脉、肝内Glisson系统,受限于Trocar位置的方向,还需实时行超声探查肿瘤不同方位和肝脏不同切面,确保肿瘤完整切除及安全切缘。自2009年Ishizawa等[18]首次报道吲哚菁绿分子荧光显像应用于开腹肝癌切除术以来,该技术有望在腹腔镜下肝脏肿瘤精准定位及手术导航中发挥重要作用。本研究也采用了该技术,术中正常肝组织与预切除肝组织或肝脏肿瘤间呈现清晰分界线,对腹腔镜下深部肝脏切除平面的把握非常有帮助,可实时、精准导航,减少或避免接触和挤压瘤体。
腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术中,暴露困难,操作空间受限,肿瘤毗邻肝右静脉、下腔静脉,难以行区域性肝门血流阻断,术中易发生大出血及气体栓塞。因此,选择合适的肝脏离断器械及合理的肝门血流阻断技术至关重要。常用肝脏离断器械有超声刀、多功能手术解剖器、超声吸引刀等,使用各种器械的术中大出血发生率及术后并发症发生率比较,差异均无统计学意义[19,20]。笔者中心联合使用超声刀和腹腔镜多功能解剖器,后者集分离、解剖、吸引和电凝等功能于一体,避免频繁更换手术器械,消除电刀在渗血中无法电凝的弊端,使视野清晰并缩短手术时间[21]。基于以上优势,腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术中,笔者团队首先采用超声刀游离肝周韧带及周围粘连,充分暴露肿瘤,采用腹腔镜多功能解剖器结合刮吸解剖法行肝切除术,既能快速有效离断肝组织,又能吸除肝切除组织碎屑、渗血、渗液及烟雾。关于肝门血流阻断技术,笔者中心采用简单有效的Pringle法行全肝血流阻断:于腹腔镜下打开小网膜,采用消毒手套边作为阻断带,穿过网膜孔,环绕肝十二指肠韧带,提拉时即可达到阻断入肝血流的目的[22,23,24]。
腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术技术难度高,及时行中转开腹并不意味着手术失败。本研究中14例患者中转开腹,其中腹腔粘连及暴露困难为主要原因,这与患者既往有腹部手术史有关,且该部分病例基本集中于手术开展初期,尚处于探索阶段。18例患者发生术后并发症,以胸、腹腔积液为主,这与患者肝硬化及该部位手术操作刺激膈肌密切相关。
综上,笔者认为:手术入路的个体化选择及可操作手术空间的建立是顺利开展腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术的基础;腹腔镜下精准的肿瘤定位及肝切除平面确定是其关键;采用合适的肝脏离断器械及合理的肝门血流阻断技术是其安全保障。在有经验的中心开展腹腔镜Ⅶ、Ⅷ段肝肿瘤切除术安全可行。



 ±s. Measurement data with skewed distribution were described as M (interquartile range). Survival rate was caculated by the Kaplan-Meier method.
±s. Measurement data with skewed distribution were described as M (interquartile range). Survival rate was caculated by the Kaplan-Meier method.























