
探讨采用改良Lloyd-Davies截石位,不翻转体位行腹腔镜肛提肌外腹会阴联合切除术(ELAPE)治疗低位直肠癌的临床疗效。
采用回顾性横断面研究方法。收集2013年9月至2015年1月四川大学华西医院收治的27例行不翻转体位腹腔镜ELAPE的低位直肠癌患者的临床病理资料。行会阴部切除术时,不翻转患者体位为俯卧折刀位,而采用改良Lloyd-Davies截石位。观察指标:(1)手术情况。(2)术后恢复情况。(3)术后病理学检查情况。(4)随访和生存情况。采用门诊和电话方式进行随访,了解患者出院后并发症、生存和肿瘤复发、转移情况。随访时间截至2017年3月。正态分布的计量资料采用 ±s表示,偏态分布的计量资料采用M(范围)表示。
±s表示,偏态分布的计量资料采用M(范围)表示。
(1)手术情况:27例患者均完成不翻转体位腹腔镜ELAPE,手术时间为(198±51)min,术中出血量为(85±66)mL。27例患者中,5例发生术中并发症,其中肠穿孔1例,术中成功修补;骶前出血1例,术中采用纱布压迫,成功止血;左、右侧盆丛神经损伤1例,未予特殊处理;左侧盆丛神经+左侧髂内静脉损伤1例,神经损伤未予特殊处理,血管损伤术中成功修补;右侧血管神经束损伤1例,神经损伤未予特殊处理,血管损伤采用超声刀成功止血。术中无肿瘤部位穿孔发生。27例患者术中中位淋巴结清扫数目为14枚(9~22枚),其中≥12枚15例,<12枚12例。(2)术后恢复情况:27例患者术后肛门首次排气时间为(78±21)h,术后首次进流质食物时间为(83±21)h。27例患者中,8例发生术后并发症,其中Clavien-DindoⅠ级1例(会阴部渗液>100 mL),Ⅱ级7例(肺部感染3例、乳糜漏2例、会阴部切口感染1例、血尿1例),均予保守治疗好转。全组术后30 d内无患者死亡。27例患者术后中位住院时间为7 d(6~8 d)。(3)术后病理学检查情况:27例患者中,环周切缘阳性1例,阴性26例;环周切缘中位距离为0.7 cm(0.1~1.1 cm);肿瘤病理学T分期:T2期14例、T3期12例、T4期1例,N分期:N0期18例、N1期6例、N2期3例。(4)随访和生存情况:27例患者中,25例获得术后随访,随访时间为2~32个月,中位随访时间为24个月。随访期间,5例患者出院后发生并发症,其中持续肛周疼痛2例,未予特殊处理,无明显缓解;性功能障碍3例,未予特殊处理,随访观察。25例患者中,发生肿瘤相关死亡2例,非肿瘤相关死亡1例,其余22例患者均生存;无肿瘤局部复发患者;肿瘤远处转移8例,其中肺转移4例,肝转移3例,脑转移1例。
采用改良Lloyd-Davies截石位,不翻转体位行腹腔镜ELAPE治疗低位直肠癌安全可行,可一期关闭盆底腹膜。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全直肠系膜切除术概念自1982年提出后,被广泛应用于临床,其能明显降低直肠癌术后局部复发率并改善患者预后,已成为直肠癌根治术的标准手术方式[1,2,3]。对不能保留肛门的低位直肠癌,腹会阴联合切除术是目前采用的主要手术方式,同样须遵循全直肠系膜切除术原则[4]。但与低位前切除术比较,腹会阴联合切除术游离的直肠系膜自上而下呈缩窄型,至耻骨直肠环平面时直肠系膜消失。该部位手术标本上形成狭窄段,称"外科腰",是导致环周切缘阳性的主要原因。同时,在该部位游离时,易切入肠壁,甚至导致术中肿瘤穿孔。因此,行腹会阴联合切除术的低位直肠癌患者术后肿瘤局部复发率和远期生存均差于行低位前切除术的中高位直肠癌患者[5,6,7,8,9]。基于上述原因,Holm等[10]于2007年提出了肛提肌外腹会阴联合切除术(extralevator abdominoperineal excision,ELAPE)。目前,关于腹腔镜ELAPE的研究尚较少。同时,传统ELAPE行会阴部切除术时,需翻转患者体位成俯卧折刀位。对不翻转体位,直接采用改良Lloyd-Davies截石位行会阴部切除术的研究也较少。本研究回顾性分析2013年9月至2015年1月我科收治的27例行不翻转体位腹腔镜ELAPE的低位直肠癌患者的临床病理资料,探讨该手术方式的临床疗效。
采用回顾性横断面研究方法。收集27例行不翻转体位腹腔镜ELAPE的低位直肠癌患者的临床病理资料,男15例,女12例;年龄46~76岁,平均年龄62岁。27例患者中位BMI为23.0 kg/m2(21.1~25.7 kg/m2);10例伴发糖尿病;美国麻醉医师协会(ASA)分级Ⅱ级19例,Ⅲ级8例;肿瘤位于直肠前壁14例,后壁8例,侧壁2例,全周3例;肿瘤距肛门中位距离为3 cm(1~5 cm);术前行MRI检查肿瘤T分期:T2期2例、T3期16例、T4期6例、Tx期3例,N分期:N0期21例、N1期3例、N2期3例;术前行长程新辅助放化疗4例,行短程新辅助放化疗9例。本研究通过我院伦理委员会审批。患者及家属术前均签署手术知情同意书。
纳入标准:(1)肿瘤距肛门距离≤6 cm。(2)术前行MRI和(或)CT检查肿瘤T分期为T2~4期,无远处转移。(3)行腹腔镜ELAPE。(4)术后病理学检查确诊为直肠腺癌。(5)临床病理资料完整。
排除标准:(1)术前行MRI和(或)CT检查肿瘤T分期为T1期。(2)肿瘤复发或远处转移。(3)行腹腔镜ELAPE术中患者体位转换为俯卧折刀位。(4)临床病理资料缺失。
所有手术由同一外科医师团队完成。患者取头低、右侧低、大腿伸展截石位,臀部超出远端床沿4 cm,充分暴露尾骨。采用常规5孔法腹腔镜技术。在经典ELAPE[10]基础上略做改良。沿Toldt筋膜前方分离直肠系膜,紧贴直肠固有筋膜(图1),注意保护Toldt筋膜及后方的左侧输尿管。向上分离、暴露肠系膜下动脉,距血管根部1 cm处高位夹闭并离断肠系膜下动脉(图2)。向盆腔游离直肠系膜时,后方游离至尾骨尖平面,前方游离至精囊腺下方至离断Denonvilliers筋膜(男性,图3)或至直肠中下段(女性),侧方游离至两侧肛提肌起点(图4)。此过程需保护输尿管、腹下神经和盆丛神经(图5)。近端离断乙状结肠后行结肠造瘘术。
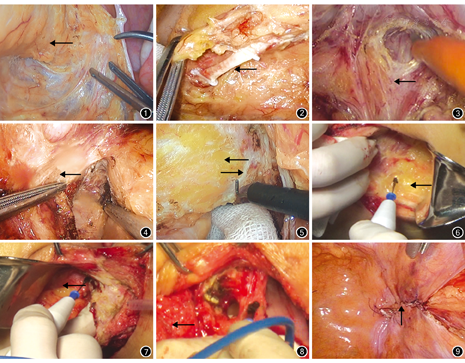

行会阴部切除术时,不翻转患者体位为俯卧折刀位,而采用改良Lloyd-Davies截石位。封闭肛门,沿肛门取弧形切口。在肛门外括约肌和肛提肌外缘与周围脂肪间隙之间分离至肛提肌起点(图6)。对直肠后壁肿瘤累及肛提肌者,可同时切除尾骨。自肛提肌起始处离断肛提肌,与腹腔会合(图7)。将标本拖出盆腔,前壁沿会阴体前方分离,在手指引下,先自直肠前正中上下会合(图8),采用超声刀分离直肠与前列腺或阴道外侧的粘连。移除标本后,在骶前间隙放置2根引流管,关闭会阴皮下脂肪及皮肤。
重建气腹,采用不可吸收缝线连续缝合盆底腹膜(图9),或将子宫后倾填塞盆腔。
(1)手术情况:手术时间、术中出血量、术中并发症情况、术中淋巴结清扫数目。(2)术后恢复情况:术后肛门首次排气时间、术后首次进流质食物时间、术后并发症情况、术后30 d内死亡情况、术后住院时间。(3)术后病理学检查情况:环周切缘阳性、环周切缘距离、肿瘤病理学T分期和N分期。(4)随访和生存情况。
采用门诊和电话方式进行随访,了解患者出院后并发症、生存和肿瘤复发、转移情况。随访时间截至2017年3月。
应用GraphPad Prism 6统计软件进行分析。正态分布的计量资料采用 ±s表示,偏态分布的计量资料采用M(范围)表示。
±s表示,偏态分布的计量资料采用M(范围)表示。
27例患者均完成不翻转体位腹腔镜ELAPE,手术时间为(198±51)min,术中出血量为(85±66)mL。27例患者中,5例发生术中并发症,其中肠穿孔1例,术中成功修补;骶前出血1例,术中采用纱布压迫,成功止血;左、右侧盆丛神经损伤1例,未予特殊处理;左侧盆丛神经+左侧髂内静脉损伤1例,神经损伤未予特殊处理,血管损伤术中成功修补;右侧血管神经束损伤1例,神经损伤未予特殊处理,血管损伤采用超声刀成功止血。术中无肿瘤部位穿孔发生。27例患者术中中位淋巴结清扫数目为14枚(9~22枚),其中≥12枚15例,<12枚12例。
27例患者术后肛门首次排气时间为(78±21)h,术后首次进流质食物时间为(83±21)h。27例患者中,8例发生术后并发症,其中Clavien-DindoⅠ级1例(会阴部渗液>100 mL),Ⅱ级7例(肺部感染3例、乳糜漏2例、会阴部切口感染1例、血尿1例),均予保守治疗好转。全组术后30 d内无患者死亡。27例患者术后中位住院时间为7 d(6~8 d)。
27例患者中,环周切缘阳性1例,阴性26例;环周切缘中位距离为0.7 cm(0.1~1.1 cm);肿瘤病理学T分期:T2期14例、T3期12例、T4期1例,N分期:N0期18例、N1期6例、N2期3例。
27例患者中,25例获得术后随访,随访时间为2~32个月,中位随访时间为24个月。随访期间,5例患者出院后发生并发症,其中持续肛周疼痛2例,术后即出现,可耐受,未予特殊处理,无明显缓解;性功能障碍3例,术后即出现,未予特殊处理,随访观察。25例患者中,发生肿瘤相关死亡2例,非肿瘤相关死亡1例,其余22例患者均生存;无肿瘤局部复发患者;肿瘤远处转移8例,其中肺转移4例,肝转移3例,脑转移1例。
我国结直肠癌发病率居所有肿瘤第4位,且呈快速上升趋势[11]。根治性手术是降低结直肠癌术后复发率、提高生存率、改善患者生命质量的首选治疗方式。低位直肠癌患者中,约1/5的患者需行腹会阴联合切除术才能达到根治目的[12]。与低位前切除术比较,腹会阴联合切除术易发生术中肿瘤穿孔和环周切缘阳性,是限制低位直肠癌疗效的重要原因[13]。现有研究结果表明:与腹会阴联合切除术比较,ELAPE可明显降低术中肠穿孔发生率和环周切缘阳性率,改善患者预后,差异均有统计学意义[14,15,16,17]。与腹会阴联合切除术不同,ELAPE要求在肛提肌外侧将肛提肌、直肠系膜及肛管整块切除[18]。ELAPE切除了更大范围的盆底组织,给重建盆底带来了新的问题;尽管已有许多不同方式处理,但目前尚无统一结论[19,20]。关于开腹ELAPE的报道较多[10,13,14,15,21,22]。随着腹腔镜技术的成熟,腹腔镜直肠癌根治术的安全性和有效性已被广泛认可[23]。
传统ELAPE需将患者体位自仰卧位转至俯卧折刀位完成会阴部切除术,需切除尾骨甚至部分骶骨达到对直肠前壁的直视显露,其主要技术优势为:(1)切除了肛提肌,增加了环周切缘安全性。(2)可在直视下完成直肠前壁分离,方便切除直肠前壁受侵犯的组织器官。(3)因避免了游离低位直肠这一主要技术难点,降低了远端直肠系膜残留风险。但传统ELAPE也存在以下缺点:(1)系膜肥大及肿瘤体积较大的患者,由于系膜翻出困难等原因,常需切除部分骶骨,扩大手术野,才能达到直视直肠前壁。切除骶尾骨后,部分患者发生长期骶尾部疼痛。文献数据显示:约50%的患者术后有会阴部疼痛表现[24]。(2)切除骶尾骨后,创面巨大,直接缝合较困难,会阴部切口并发症发生率高达30%~50%。故国外不少学者支持行肌皮瓣移植填充会阴部缺损,但并发症发生率仍较高[25,26]。(3)翻转体位后,难以关闭盆底腹膜,导致术后小肠常粘连于盆腔,增加肠梗阻发生风险,不利于术后放疗。
本研究中,笔者团队采用不翻转体位的ELAPE,对患者体位进行了调整,臀部应超出远端床沿距离≥4 cm,同时髋关节屈曲角度>90°。该体位优势为:(1)充分暴露会阴部,使拉钩在切口前、后、左、右方向上均能使用,从而达到良好暴露。(2)因尾骨尖也超出床沿,必要时也可在该体位下切除尾骨。(3)能够实现沿肛提肌分离至其起点附近,直肠前壁远端亦能获得较好的直视暴露。该体位的ELAPE能保证较好的手术切除质量,完整切除肛提肌,避免出现"外科腰"。本研究中27例患者在分期较晚的情况下,仅1例环周切缘阳性,环周切缘距离及术后生存情况均较好,这提示该手术能实现较好的局部R0切除。
改良的Lloyd-Davies截石位腹腔镜ELAPE不仅节约了翻转体位的时间,其另一主要优势在于移除标本后可关闭盆底腹膜。尽管翻转体位女性患者术中也可采用子宫填塞盆腔缺损,但男性患者盆腔完全开放带来的潜在影响仍不能忽视。本研究27例患者中,15例男性患者均在移除标本后成功完成盆底腹膜缝合。对腹膜缺损较大,或行放疗后存在腹膜纤维化增厚的患者,可将膀胱底向上牵拉,与2层腹膜行"Y"字形缝合,也可采用一侧腹膜与对侧盆壁层筋膜或下腹神经周围结缔组织缝合,游离直肠上段时刻意适当保留腹膜。因直肠手术后小肠可能粘连于盆腔,术后行辅助放疗导致放射性小肠炎的几率高达15%,关闭盆底腹膜能降低放疗所致肠梗阻和放射性肠炎。
患者仰卧体位下术者行ELAPE,会丧失对中低位直肠前间隙的直视操作。为克服该问题,笔者团队在腹腔镜下分离直肠至离断Denonvilliers筋膜。这有别于传统ELAPE。在前正中方向离断Denonvilliers筋膜后,即可进入直肠前间隙裸区。该区域是前列腺与直肠间无系膜脂肪的疏松结缔组织,稍钝性分离即可达前列腺远端平面。而会阴组直肠在会阴体前后分离后,用手指引导,上下会合后,再继续在手指引导下采用超声刀,可方便、准确地完成远端直肠侧前间隙分离。即使远端直肠侧前间隙可疑受累,也可在手指引导下扩大切除范围,切除部分血管神经束。当然由于本手术方式缺乏对直肠前壁的直视,理论上当直肠前壁肿瘤明显外侵时,仍以俯卧折刀位手术为宜。
ELAPE与传统柱状切除术和Miles手术的差异还在于不切除坐骨直肠窝脂肪。尽管国外文献报道:ELAPE术后组织缺损大,常难以一期直接重建会阴部缺损,而需行肌皮瓣手术,以减少会阴部切口并发症。但行肌皮瓣手术需整形外科医师配合,延长了手术时间,且肌瓣可能导致供区并发症、肌瓣坏死等[27]。生物材料修复具有相对较高的安全性和有效性,但也有引起肠梗阻、盆腔脓肿和瘘等的风险[27,28,29,30]。可能因亚洲国家人群骨盆比欧美国家人群小,且体型瘦小,本研究27例患者均一期完成会阴部皮下及皮肤缝合;同时由于一期关闭了盆底腹膜,避免了小肠干扰,仅1例患者术后发生会阴部渗液和1例会阴部切口感染,其切口并发症发生率远低于文献报道的46%[31]。
既往研究结果已证实:腹腔镜ELAPE近期疗效与传统ELAPE相似[32,33]。本研究中,尽管术前行MRI检查肿瘤T4期6例,分期较晚,可能导致了较高的术中盆神经及血管副损伤发生率,但仅1例环周切缘阳性。这提示不翻转体位腹腔镜ELAPE能够达到较好的肿瘤根治性切除。腹腔镜ELAPE的优势还在于直视条件下分离直肠系膜与盆丛神经,有利于保护血管神经,减少术后肛周疼痛及性功能障碍,提高了患者术后生命质量。本研究中仅2例患者出院后发生持续肛周疼痛,3例发生性功能障碍。
综上,不翻转体位腹腔镜ELAPE安全可行,可一期关闭盆底腹膜。对低位直肠癌的治疗,临床医师应借助多学科团队,通过术前影像学评估,选择最佳治疗方案。降低术后肿瘤复发率,改善患者预后及生命质量才是结直肠癌治疗的初衷[34]。



 ±s. Measurement data with skewed distribution were described as M (range).
±s. Measurement data with skewed distribution were described as M (range).























