
移植后新发糖尿病是器官移植后最常见的代谢性并发症之一,与患者移植后心血管疾病的发生、移植物慢性功能障碍、严重感染、长期生存率下降等密切相关。不同器官移植后新发糖尿病的发病率不同,影响其发病的危险因素也存在诸多差别。本文综述了肾移植、肝移植、心脏移植、肺移植后新发糖尿病在发病率以及发病危险因素方面的差别。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1954年Murray在美国成功进行的第1例同种肾移植手术,揭开了器官移植在临床应用的新篇章[1]。经过半个多世纪的发展,器官移植开启了在肝移植、心脏移植、肺移植、胰腺移植、心肺联合移植等多个领域的尝试及应用;同时,器官移植已经成为肾脏、肝脏及心脏终末期疾病不可替代的治疗手段,随着器官移植受者寿命的延长,移植后新发糖尿病(new onset diabetes mellitus after transplantation, NODAT)越来越受到关注,那么,不同器官移植后NODAT的发生、影响因素与转归是否存在差异?本文针对肾移植、肝移植、心脏移植、肺移植后NODAT在发病率及其发病危险因素方面进行比较,旨在更深入认识NODAT的发病机制与防治措施。
对NODAT的诊断标准一直没有统一规定,直接影响到对其发病率的统计和对NODAT患者的准确识别以及早期干预;较早的临床试验通常将其定义为术后需要至少30天的胰岛素治疗,这样的定义无法将NODAT与术前即存在的糖尿病区分开来,并且漏掉了血糖调节受损(impaired glucose regulation)患者和一些症状不明显的患者,较易低估NODAT发病率,例如一项20世纪90年代的研究对NODAT的诊断没有标准定义,仅定义为需要降糖治疗,其统计结果NODAT发病率为3.6%,大大低估了其发病率[2]。2003年的NODAT指南提出将美国糖尿病学会(The American Diabetes Association, ADA)或世界卫生组织(World Health Organization, WHO)糖尿病诊断标准同样应用于器官移植后患者NODAT的诊断[3,4]。不同研究机构报道的NODAT发病率大致在2%~50%,在NODAT诊断标准、随访时间、样本含量及免疫抑制剂方案等方面的差别造成其统计发病率的较大幅度波动[5]。现将相关文献报道的不同器官移植后NODAT的发病率进行统计。
如表1所示,肝移植患者术后6个月内NODAT发病率高于肾移植患者,且肝移植和肾移植患者分别有54.5%~64%和38%~50%在术后3个月内发病(发病时间一般规定为随访过程中第1次发现血糖升高并达到糖尿病诊断标准,考虑到手术应激对血糖的影响,术后1个月以内的血糖不列入研究范围),即肝移植患者NODAT发病时间较肾移植患者早,然而随着术后随访时间的延长,肝移植患者的肝功能逐渐恢复,糖代谢调节得到一定改善,NODAT发病率显著下降,即远期发病率低于肾移植患者;单独就肝移植而言,活体供肝患者的NODAT发病率在不同随访时间点的发病率均为最低。心脏移植、肺移植后NODAT的相关研究较少,但从现有数据来看,肺移植患者NODAT发病率更高,且随着随访时间延长,发病率没有明显下降。笔者所在课题组所作的研究中,NODAT 5年发病率在肾移植、肝移植分别为20.3%和18.18%,基本与上述肾移植、肝移植后NODAT发病趋势相符[6,12]。
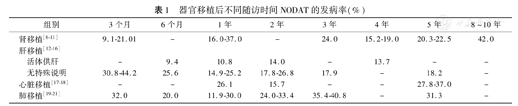
器官移植后不同随访时间NODAT的发病率(%)
免疫抑制剂的应用显著提高了移植术后生存率,但与此同时,随着患者生存时间的延长,免疫抑制剂长期使用的不良反应也逐渐显现;大量实验和观察结果证明,当下常用的免疫抑制剂均可不同程度增加器官移植后NODAT发病风险,但不同器官移植后免疫抑制方案不尽相同,因此可能导致不同器官移植后NODAT发病率的不同,表2、3总结了不同器官移植后免疫抑制剂方案与常用药物(由于心脏移植、肺移植相关研究数据较少,因此着重比较肾移植、肝移植后免疫抑制剂应用的差别)。

肝肾移植后免疫抑制剂应用方案比较
肝肾移植后免疫抑制剂应用方案比较
| 组别 | 主要方案 | 单抗诱导 | 激素 | 发生急性排斥反应时的应对 |
|---|---|---|---|---|
| 肾移植[6,7,8,9] | (1)20世纪80年代之前:二联AZA(2~3 mg·kg-1·d-1)+强的松(1.5 mg·kg-1·d-1)(2)20世纪80~90年代:三联CsA(3~8 mg·kg-1·d-1)+AZA(1~2 mg·kg-1·d-1)+强的松(0.5 mg·kg-1·d-1)(3)20世纪90年代之后:三联TAC(0.1~0.2 mg·kg-1·d-1)或CsA(6~10 mg·kg-1·d-1)+MMF(1 g/d)+激素;(4)单抗诱导、激素用量最小化 | 20世纪90年代开始使用;术前1 h、术后第4天分别给予巴利昔单抗20 mg+NaCl 100 ml静脉滴注 | 术中、术后第1、2天甲强龙静脉注射500 mg;第3天换口服强的松30 mg/d,至术后2~3个月时减量至10~20 mg/d,6个月时为15 mg/d,之后5~10 mg/d口服维持;也有学者主张[9],无急性排斥反应发生的患者应在3个月内撤用糖皮质激素,有急性排斥反应发生患者应口服强的松5 mg/d维持1年 | 甲强龙静脉注射500 mg连用3天,之后250 mg 2天;若发生激素不敏感的急性排斥反应,应用CsA的患者换为TAC,AZA换为MMF,或加用ATG;使用TAC的患者直接应用MMF、ATG |
| 肝移植[12,13,14,15] | (1)20世纪80年代之前:二联AZA(125~150 mg/d)+强的松(20~40mg)(2)20世纪80~90年代:二联CsA(5~6 mg·kg-1·d-1)+强的松(10~20 mg)(3)20世纪90年代之后:TAC+激素或TAC(0.075~0.15 mg·kg-1·d-1)+MMF(1 g/d)/AZA(1~2 mg·kg-1·d-1)+激素;(4)单抗诱导、激素用量最小化 | 20世纪末、21世纪初开始使用;肝复流后2 h内和术后第4日巴利昔单抗20 mg+NaCl 100 ml静脉滴注 | 术中甲强龙静脉注射1 000 mg或10 mg·kg-1·d-1,术后第2天40 mg/6 h,每天减量40 mg,第6天开始口服强的松20 mg/d,除自身免疫性肝病患者外,一般3~6个月内减量至停药 | 先加大TAC用量,无好转则甲强龙10 mg·kg-1·d-1冲击3天,7~10天内逐渐减量停用 |
注:AZA:硫唑嘌呤;CsA:环孢霉素A;TAC:他克莫司;MMF:霉酚酸酯;ATG:抗人胸腺细胞免疫球蛋白
肝脏属于免疫特惠器官,有一定的自发性免疫耐受潜力,因此其所需的免疫抑制强度较肾移植更弱,肝移植后他克莫司(tacrolimus, TAC)、环孢霉素A(cyclosporin A, CsA)的起始剂量均稍低于肾移植(表3),但术后目标血药浓度与肾移植无明显差异;另外,TAC肝脏毒性较小,且具有营养肝细胞的作用[22],因而临床上约90%以上的肝移植后患者应用以TAC为基础的免疫抑制方案[13,14](表2)。现有对钙调磷酸酶抑制剂(calcineurin inhibitor, CNI)类药物的研究显示,TAC的免疫抑制作用约为CsA的100倍,在预防各种器官移植后排斥反应的效果均优于CsA,但诱发NODAT的风险却比CsA高25%[7],严重时可发生酮症酸中毒,因此推测肝移植患者中TAC的较高使用率与其早期NODAT发病率较高相关(表1)。
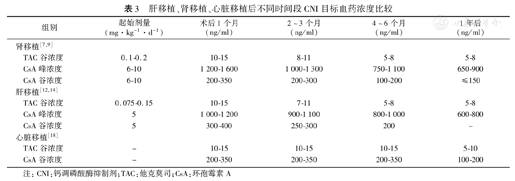
肝移植、肾移植、心脏移植后不同时间段CNI目标血药浓度比较
肝移植、肾移植、心脏移植后不同时间段CNI目标血药浓度比较
| 组别 | 起始剂量(mg·kg-1·d-1) | 术后1个月(ng/ml) | 2~3个月(ng/ml) | 4~6个月(ng/ml) | 1年后(ng/ml) | |
|---|---|---|---|---|---|---|
| 肾移植[7,9] | ||||||
| TAC谷浓度 | 0.1-0.2 | 10-15 | 8-11 | 5-8 | 5-8 | |
| CsA峰浓度 | 6-10 | 1 200-1 600 | 1 000-1 300 | 750-1 100 | 650-900 | |
| CsA谷浓度 | 6-10 | 200-350 | 200-300 | 100-200 | ≤150 | |
| 肝移植[12,14] | ||||||
| TAC谷浓度 | 0.075-0.15 | 10-15 | 7-11 | 5-8 | 5-8 | |
| CsA峰浓度 | 5 | 1 000-1 200 | 900-1 100 | 800-1 000 | 600-800 | |
| CsA谷浓度 | 5 | 300-400 | 250-300 | 200 | - | |
| 心脏移植[18] | ||||||
| TAC谷浓度 | - | 10-15 | 10-15 | 10-15 | 5-10 | |
| CsA谷浓度 | - | 200-350 | 200-350 | 200-350 | 100-200 | |
注:CNI:钙调磷酸酶抑制剂;TAC:他克莫司;CsA:环孢霉素A
大量研究结果表明,糖皮质激素虽然免疫抑制作用强大,但可能通过减少胰岛素分泌、增加胰岛素抵抗;减少糖的利用、增加糖异生等多条途径干扰糖代谢,在肾移植、肝移植后均是NODAT发病的独立危险因素,且与剂量和应用时间长短有关[17,23]。术中和术后3~6个月的糖皮质激素用量在肝移植患者中显著大于肾移植患者(表2),与表1中肝移植后NODAT较早发病、早期发病率较高的发病趋势相吻合;后期肝移植后患者一般在3~6个月内撤用激素,而肾移植后患者一般需要口服激素维持(表2),推测可能是造成肝移植患者后期NODAT发病率降低而肾移植NODAT发病率仍居高不下的原因之一。
抗白细胞介素2受体抗体(anti-interleukin-2 receptor antibodies, IL-2Ra)特异性阻断白细胞介素2(interleukin-2, IL-2)介导的T细胞增殖、活化,一般用于免疫诱导,能够极大降低器官移植后急性排斥反应发生率,现临床上最常使用的是巴利昔单抗(表2)。在肾移植中的较早应用使得IL-2Ra与NODAT发病的关系也受到普遍重视:Prasad等[24]、Bayés等[25]、Aasebø等[26]学者在肾移植人群中的研究一致认为,巴利昔单抗可能通过影响调节性T细胞而间接影响β细胞功能和糖代谢,因此是NODAT发病的危险因素之一;而IL-2Ra对肝移植后NODAT的影响尚未得出一致结论,为进一步明确IL-2Ra与肝移植后NODAT发病的关系,笔者所在课题组Xue等[27]、Lv等[12]在大样本肝移植人群中进行的回顾性研究发现:在随访时间内,使用与未使用IL-2Ra组的NODAT发病率分别为30.4%、41.8%(P=0.001),即IL-2Ra是肝移植后对抗NODAT发病的保护因素,推测其通过降低急性排斥反应发生率,并且间接减少免疫抑制剂用量而降低NODAT发生率。IL-2Ra影响不同器官移植后糖代谢的具体机制尚需深入研究。
另外,雷帕霉素(rapamycin)或称西罗莫司(sirolimus)是一种低毒性、高效能的新型免疫抑制剂,较少对糖代谢产生影响,应用剂量在肾移植、肝移植也没有明显差异:术后48 h内首次负荷剂量6~9 mg/d,维持剂量2~5 mg/d;术后1周的谷浓度应调整为10~15 ng/ml,之后5~10 ng/ml维持。
2006年至2007年期间进行心脏移植的患者当中,65%术后使用TAC[28]。只有30%使用CsA;而霉酚酸酯(Mycophenolate mofetil, MMF)则是最常用的抗增殖药物,术后1年有77%的患者使用;总的来说,大部分心脏移植后患者术后的免疫抑制剂方案为TAC+MMF+激素,其中CNI的目标血药浓度类似于肾移植、肝移植(表3)。
2002年至2011年的数据显示,TAC和MMF均是肺移植患者术后1年和5年最常用的免疫抑制药物,因此肺移植后较常用的抗排斥方案也为TAC+MMF+激素[29]。肺移植患者排斥反应发生率高,相应免疫抑制药物用量较大,且需要长期用药,因此其NODAT发病率较高,且随着随访时间延长没有明显下降趋势(表1)。Morton等[30]的研究还指出,肺移植患者体内激素水平高于正常对照,因此一味依照既定方案使用激素可能造成体内激素过量,而促发NODAT,所以对肺移植体内激素的血药浓度进行监测非常必要。
1.患者一般情况的比较:NODAT与一般人群中的2型糖尿病发病机制和自然病程较为类似,均涉及胰岛素抵抗和分泌受损两方面[31,32]。因此不同器官移植后NODAT患者的基本特征与2型糖尿病患者较为相似,即多发生于年龄较大者、体重指数≥25 kg/m2的患者、非洲或西班牙裔美国人、有一级亲属糖尿病家族史的患者,但具体来说,肾移植NODAT患者发病年龄较小[8];肝移植和肺移植中男性患者发生NODAT的可能更大[19,20,21,22,23,24,25,26,27,28,29,30,31,32,33];有吸烟史的肾移植和心脏移植患者发病风险也更大[6,17]。不同器官移植受者术前基础疾病不同,其对术前糖代谢基础状态的影响也不同,可能影响患者术后NODAT的发生。相关研究显示,肾移植前高血压相关终末期肾病、肝移植前终末期肝病模型(model for end-stage liver disease, MELD)评分和肝硬化、心脏移植前缺血性心脏病、肺移植前肺囊性纤维化分别是其移植术后NODAT发病的危险因素,具体发病机制有待深入研究(表4)[7,14,18,19]。
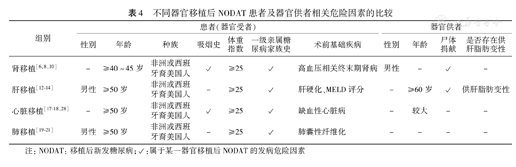
不同器官移植后NODAT患者及器官供者相关危险因素的比较
不同器官移植后NODAT患者及器官供者相关危险因素的比较
| 组别 | 患者(器官受者) | 器官供者 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 性别 | 年龄 | 种族 | 吸烟史 | 体重指数 | 一级亲属糖尿病家族史 | 术前基础疾病 | 性别 | 年龄 | 尸体捐献 | 是否存在供肝脂肪变性 | |
| 肾移植[6,8,10] | - | ≥40~45岁 | 非洲或西班牙裔美国人 | √ | ≥25 | √ | 高血压相关终末期肾病 | 男性 | - | √ | - |
| 肝移植[12,13,14] | 男性 | ≥50岁 | 非洲或西班牙裔美国人 | - | ≥25 | √ | 肝硬化、MELD评分 | - | ≥60岁 | √ | 供肝脂肪变性 |
| 心脏移植[17,18,28] | - | ≥50岁 | 非洲或西班牙裔美国人 | √ | ≥25 | √ | 缺血性心脏病 | - | 较大 | - | - |
| 肺移植[19,20,21] | 男性 | ≥50岁 | 非洲或西班牙裔美国人 | - | ≥25 | √ | 肺囊性纤维化 | - | - | - | - |
注:NODAT:移植后新发糖尿病;√:属于某一器官移植后NODAT的发病危险因素
MELD评分:R=3.78×ln[血清胆红素(mg/dl)]+11.2×ln[国际标准化比率(International Normalized Ratio, INR)]+9.57×ln[血清肌酐(mg/dl)]+6.43(病因:胆汁性或酒精性0,其他1),其R值越大,生存率越低,NODAT风险越高。
2.器官供者情况的比较:器官捐献者的诸多因素对不同器官NODAT发病存在不同程度的影响。Kasiske等[8]提出供肾者为男性可曾加肾移植患者NODAT的发病风险,其他器官移植未见相关研究结果;器官捐献者的年龄与肝移植和心脏移植患者NODAT的发病密切相关[18,34];供肝脂肪变性是指供肝活检提示肝实质细胞脂肪浸润超过5%,较早即有观点认为其与移植器官功能下降和受者胰岛素抵抗有关,但并未将其与NODAT联系起来[35]。笔者所在课题组陈显英等[36]在分析肝移植后NODAT发病危险因素时发现供肝脂肪变性可增加肝移植后NODAT的发病风险;Lv等[12]、Xue等[37]在更大样本人群中的回顾性研究进一步证实了这一观点;其具体机制尚未阐明,但可能与供肝脂肪变性加重胰岛素抵抗,进而影响糖代谢有关。
另外,与心脏移植、肺移植不同,肾移植、肝移植中,是否为活体供肝(肾)在很大程度上影响着NODAT的发病率。Lv[6]在一项回顾性研究中发现,尸体供肾在单因素和多因素分析中均是NODAT发病的危险因素;同样在肝移植中也有许多类似的研究结果,究其具体机制,可能是因为接受活体供肝(肾)的患者术后所需免疫抑制剂的剂量较小[34]:来自Jain等[38]的研究数据显示接受活体供肝的患者所需TAC剂量比接受尸体供肝的患者减少30%~40%,因此可间接降低NODAT发病率,这一结论与表1中活体供肝NODAT的发病数据相吻合;此外活体肝脏捐献者还可以通过饮食、运动减轻供肝脂肪变性的程度,从而也能够减轻术后供肝脂肪变性对NODAT的影响(表4)。
3.患者围术期情况的比较:丙型肝炎病毒(hepatitis C virus, HCV)感染在肾移植、肝移植后均可不同程度增加NODAT发病风险[6,14],肝移植研究结果显示HCV阳性患者NODAT发病率可达40%,阴性对照仅为27%[39];在肾移植患者中HCV阳性患者NODAT发病率为39.4%,同样远高于阴性对照9.8%[40]。慢性HCV感染主要通过干扰细胞内胰岛素作用信号通路、增加促炎细胞因子、下调肌肉和肝脏细胞表面的葡萄糖转运载体而促进患者胰岛素抵抗,另外还可逐渐导致肝脏纤维化,同样影响胰岛素敏感性,最终诱发NDOAT[41]。因此对HCV阳性患者在肾移植、肝移植术后的血糖水平应更为关注,加强监测及预防。尚未查到HCV感染与心脏移植、肺移植后NODAT相关性的研究。
巨细胞病毒(cytomegalovirus)感染是不同器官移植后NODAT共同的危险因素[42],发病机制未完全阐明,可能与其激活肿瘤坏死因子α等促炎因子,继而对胰岛β细胞产生毒性作用,影响胰岛素分泌释放有关。
术前和术后早期空腹血糖(fasting plasma glucose)水平>5.6 mmol/L表明胰岛素分泌和敏感性在一定程度上已经受损,后期发生NODAT的可能性较空腹血糖正常的患者更大,是不同器官移植后NODAT发病的共同危险因素。其中,研究结果显示,肝移植术前空腹血糖(OR=1.853,95%CI 1.405~2.444, P<0.001)异常较肾移植术前空腹血糖(OR=1.04,95%CI1.01~1.08, P=0.013)异常对术后NODAT发病的影响更大[43,44]。
急性排斥反应(acute rejection)的发生是肾移植、肝移植和肺移植的危险因素之一:一方面,发生急性排斥反应时需要大剂量激素冲击,并且后续的免疫抑制剂剂量也会相应加大,而激素和CNI等免疫抑制药物可通过多种途径干扰糖代谢,从而诱发NODAT;另一方面,急性排斥反应本身是一种应激反应,体内的儿茶酚胺、生长激素、胰升糖素等胰岛素拮抗激素水平升高,促使血糖升高而诱发NODAT。不同器官移植后NODAT发病危险因素的研究结果显示:肝移植、肾移植、肺移植后NODAT患者急性排斥反应发生率分别为50%~60.8%、50%和88%[15,20,45,46];肝移植后急性排斥反应发生率稍高于肾移植,而肺移植后急性排斥反应发生率远高于其他器官,可能是造成其发病率较高的原因之一(表1)。
术前和术后早期低镁血症(Mg<0.74 mmol/L)在肾移植、肝移植患者中均是NODAT的独立危险因素,其机制可能涉及胰岛素抵抗[47,48]。另外,CNI类药物诱发NODAT的作用很大程度上也是通过诱导低镁血症而产生的[47]。但尚未有文献报道低镁血症在肾移植、肝移植后发生率的差异,以及对NODAT发生率影响程度的差异。
大量研究结果显示不同器官移植后均存在逆转现象,即术后被诊断为NODAT的患者在随访过程中空腹血糖降至正常(<5.6 mmol/L),且在不注射胰岛素和口服降糖药的条件下维持血糖正常超过1年;而持续性NODAT患者则是在随访时间内空腹血糖持续高于正常或需要降糖治疗。肾移植、肝移植、心脏移植、肺移植术后NODAT 3~5年内逆转率分别为17.2%~33%、56.8%~69.9%、33%、11.1%[6,18,21,50,51];其中,肝移植后逆转率明显高于肾移植,与前述其发病率的变化趋势一致。另外,对比不同学者的研究结果发现肾移植后NODAT逆转病例大部分较持续性NODAT发病更早[49,50];而在肝移植后则是持续性NODAT发病更早,即发病越早越有可能成为持续性糖尿病。
在影响NODAT逆转的因素方面,年龄>40岁、HCV阳性、TAC用量较大是肝移植患者较易发展成为持续性NODAT的预测因子;而在肾移植患者中,大多数文献报道年龄>50岁、体重指数>25 kg/m2、免疫抑制方案中包括TAC、术前三酰甘油>1.5 mmol/L以及基础疾病非肾小球肾炎是术后持续性NODAT的危险因素;笔者所在课题组Lv等[6]通过对428例术前无糖尿病史肾移植患者术后糖尿病的转归情况进行分析后发现,糖尿病家族史、尸体供肾同样是肾移植后持续性NODAT的危险因素,值得一提的是,分析还发现急性排斥反应发生率是NODAT逆转的预测因子之一,其具体机制有待深入研究。
总之,通过对不同器官移植后NODAT的比较发现肾移植患者术后免疫抑制剂使用剂量较大,应用时间较长,应在不影响免疫抑制效果的前提下积极调整用药方案,减量使用免疫抑制剂;而肝移植后NODAT患者早期发病率较高,但后期逆转率也较高,术后早期更应严格监测免疫抑制剂血药浓度、关注其血糖水平并及时干预,另外应严格筛选供肝,降低供肝脂肪变性对术后NODAT发病的影响;其他器官移植中,肺移植患者术后急性排斥反应发生率较高,应在足量使用免疫抑制剂的基础上密切监测其血药浓度。
[本栏目由施维雅(达美康缓释片)特别赞助]



























