
近几十年来,恶性肿瘤的发病率越来越高,其发病年龄逐渐低龄化,严重威胁着人类的生命健康。目前,临床上有多种抗肿瘤治疗方法,但单一治疗方法往往达不到最佳治疗效果,因此常采用联合治疗的方法。联合治疗在增强治疗效果的同时还能减少药物的毒副作用,且可减轻患者痛苦。化学治疗(化疗)是临床上常用的治疗方法,但其副作用较大,对肿瘤细胞造成损伤的同时也会对人体正常细胞造成不可逆损伤。光动力疗法是利用特定波长的光激发富集在肿瘤局部的光敏剂,光敏剂被活化,在组织内氧的存在下可发生光动力反应直接或间接杀伤肿瘤细胞。化疗或光动力治疗肿瘤后会产生肿瘤相关抗原,免疫系统识别肿瘤相关抗原后会刺激机体产生特异性抗肿瘤免疫反应,在化疗协同光动力疗法的同时联合免疫治疗,能够有效地提高化疗药物的治疗效果、减少药物毒副作用,同时能抑制肿瘤转移,并可诱导机体产生长期抗肿瘤免疫反应,实现最大化的治疗效果。对近年来化疗、光动力疗法以及免疫治疗的研究现状作一综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
恶性肿瘤严重威胁人类健康,其治疗是临床上面临的巨大挑战。肿瘤的传统治疗方法包括手术治疗、放射治疗(放疗)以及化学治疗(化疗)[1]。手术治疗的问题在于尽管肿瘤被成功切除,但无法保证肿瘤组织及细胞被完全清除干净,同时并不是所有肿瘤都适合手术治疗,存在一定的局限性;放射治疗特异性较差,杀伤肿瘤细胞的同时也会对正常细胞造成不可逆损伤,有严重的副作用,影响患者的生存质量;传统化疗药物对人体会产生较大的副作用[2,3,4],故常与手术治疗等其他治疗方法联合使用,以达到最大程度发挥单一治疗优势、降低单一治疗毒副作用的目的[5]。因此开发具有高效特异性和较低毒副作用的肿瘤治疗方法具有较大的研究前景及应用价值。
化学治疗简称化疗,是临床上治疗恶性肿瘤的常用方法之一。随着分子肿瘤学等学科的发展以及组合化学、高通量筛选、基因工程等技术的应用,出现了大量抗肿瘤新药[6]。目前发现的抗肿瘤药物有30多种,常用的有10~20种[7],其中具有明确治疗机制、显著治疗效果的小分子化疗药物在肿瘤化疗方面发挥了巨大作用,如多柔比星、顺铂、紫杉醇及其衍生药物等。
盐酸多柔比星(Doxorubicin, DOX)是一种蒽环类抗肿瘤药物,DOX可在细胞核内与DNA结合形成复合物,阻碍DNA、RNA和蛋白质合成。DOX的抗瘤谱较广,同时又是放射增敏剂,因此在肿瘤治疗中应用较多。DOX具有心脏毒性,对心肌的损伤具有剂量依赖性。目前研究结果表明,可通过应用药物载体使DOX主要分布在肿瘤局部,以减少其在心脏等组织中的分布,从而降低毒副作用,其中脂质体制剂已经成功在临床应用。
多柔比星脂质体(pegylated liposomal doxorubicin, PLD)将DOX包载于脂质体内部,同时在脂质体周围包裹一层聚乙二醇(polyethylene glycol,PEG)。PEG层具有空间稳定作用,可保护脂质体不被网状内皮系统识别,以延长其在血液循环中的时间,并通过高通透性和滞留效应(enhanced permeability and retention effect,EPR)使更多药物作用于肿瘤细胞,提高DOX的化疗效率[8]。PLD在1999年通过FDA认证,被批准在临床用于治疗难治性卵巢癌,于2005年全面用于铂类敏感型复发性卵巢癌症患者的化疗方案。
紫杉醇(taxol,TAX)是从裸子植物红豆杉的树皮中分离提纯的天然次生代谢产物,接触细胞后会促进微管累积到细胞内[9],从而影响细胞的各种功能。TAX可阻断细胞的正常分裂且可诱导细胞凋亡[10],是治疗乳腺癌常用的核心化疗药物。TAX在水中溶解性较差,临床应用的Taxol是用聚氧乙烯基蓖麻油和乙醇以50∶50的混合物作为增溶剂;但聚氧乙烯基蓖麻油也会导致如全身性过敏、消化道及呼吸道等急性超敏反应等严重不良反应[11]。除了TAX本身的应用缺陷,其药用辅料的毒副作用同样限制了TAX在临床中的应用。
为解决TAX在临床上的应用缺陷,美国American Bioscience公司开发出一种新型药物——Abraxane,将紫杉醇包载于白蛋白中,形成外层为白蛋白内层核心为紫杉醇的纳米粒。Abraxane于2005年获得美国食品药品监督管理局(FDA)批准用于转移性乳腺癌的治疗[12]。
顺式二氯二氨合铂(顺铂)(Cisplatin,CDDP))是一种无机重金属络合物,属于细胞周期非特异性药物。CDDP的抗癌作用机制主要依靠其配合物的平面四边形结构。大量实验研究初步认为,CDDP的作用机理是靶向迁移、跨膜运转、水和离解以及作用于DNA。CDDP在临床上应用广泛,对多种恶性肿瘤有治疗作用。尽管顺铂类药物具有良好的抗癌疗效,但在临床应用中同样存在肾脏毒性、骨髓抑制和神经毒性等毒副作用[13],这些应用缺陷影响了CDDP的治疗效果。
尽管如此,目前临床上应用化疗药物治疗肿瘤仍是最常用的治疗方法。为了将毒副作用降到最低,可将其与其他治疗方法相结合,在发挥抗肿瘤药效的同时将其产生的副作用降到最低,结合其他治疗方法的优势进行更有效的肿瘤治疗。
目前,光动力治疗(photodynamic therapy,PDT)在临床已被应用于辅助治疗多种浅表性肿瘤。PDT具有许多优势,光敏剂纳米粒子可通过EPR效应等靶向至肿瘤局部,利用光源局部照射可避免正常组织受损;光敏剂被体内组织摄取后若没有接收到对应波长激发光的激发就不会产生光动力等一系列反应,也不会产生细胞毒性;肿瘤细胞对光敏剂不产生耐药性,因此可重复治疗;应用PDT不会破坏弹力纤维等结缔组织,因此不会使机体结构的完整性受到破坏;PDT不会和其他抗肿瘤药物产生交叉耐药性,可以与放化疗协同治疗,以增强治疗效果,改善患者的预后;还可与传统肿瘤治疗方法联合,如在肿瘤手术切除后作为辅助治疗手段可降低残留肿瘤细胞的存活率,增强治疗效果。
PDT基本原理是通过光敏剂引发一系列光生物学反应和光化学反应[14]而达到杀伤肿瘤细胞的目的。光生物学反应是光敏剂吸收入射光的能量,会促进前列腺素、淋巴因子、血栓素等细胞因子的释放,这些细胞因子能破坏肿瘤的微血管和肿瘤细胞生物膜,从而杀伤肿瘤细胞。光化学反应是利用光敏剂最大吸收波长的光照射光敏剂富集的肿瘤局部,光敏剂吸收光子能量跃迁到激发态,继而转化为三重激发态,与底物作用产生单线态氧(1O2)及氧化活性分子(radical oxygen species,ROS),对肿瘤细胞进行直接或间接杀伤。PDT一般分为Ⅰ型和Ⅱ型反应,大部分以Ⅱ型反应为主[15]。Ⅰ型反应:处于三重激发态的光敏剂可直接与细胞膜或生物大分子反应生成自由基,杀伤靶细胞;Ⅱ型反应:处于三重激发态的光敏剂直接将能量递送给周围的氧分子,生成具有较强细胞毒性的1O2,可迅速杀伤肿瘤细胞[16]。因此,PDT的3个要素为光敏剂、一定波长的激发光和组织含氧量[14]。PDT抗肿瘤作用机制包括对肿瘤细胞的直接杀伤[17,18]、对肿瘤血管的损伤[19]、局部的炎症反应[20,21]以及抗肿瘤免疫反应[22,23]。
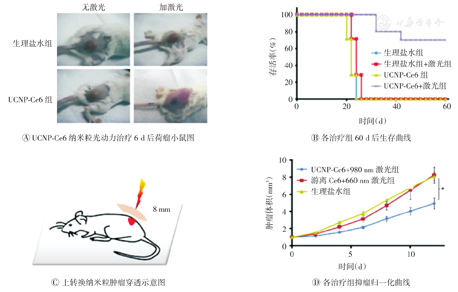
目前,经FDA批准的光敏剂大多适用于紫外或可见光激发,其穿透能力较差,只适用于浅表部位肿瘤的治疗。由于人体大部分组织能强烈吸收可见光,导致影响光敏剂发挥作用。有课题组[24]用两亲性PEG聚合物修饰上转化纳米粒(upconversion fluorescent nanoparticles, UCNs),将光敏剂二氢卟吩e6(Chlorin e6, Ce6)包载于聚合物疏水层,制备成UCNs-Ce6纳米复合体(图1)。体外实验结果表明,通过980 nm激发光激发后,UCNs-Ce6纳米复合体4T1细胞会产生强烈的抑制作用。体内实验结果表明,将UCNs-Ce6纳米复合体静脉注射到建立4T1乳腺癌模型的BALB/c小鼠体内,肿瘤生长可被抑制,小鼠存活时间延长。

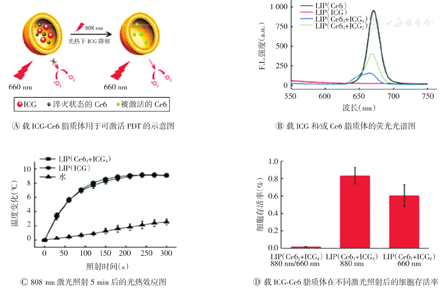
光敏纳米粒可使光敏剂富集于肿瘤部位,增强PDT效果。但大部分光敏纳米粒在体循环时会接受来自外界光的刺激而产生1Q2,对皮肤造成损伤。为克服光敏剂的光毒性,可激活光敏纳米粒成为目前研究的热点。有研究者研制出载有Ce6和吲哚菁绿(indocyaninegreen,ICG)的脂质体,其光敏剂分子之间通过相互作用,Ce6的光毒性可被ICG抑制(图2)[25]。当660 nm激光照射脂质体时,Ce6不能产生1Q2;当近红外808 nm激光照射时,ICG被分解,Ce6恢复产生1Q2。此外,ICG在近红外光照射下可将光能转化为热能而杀伤肿瘤细胞。

肿瘤免疫治疗作为一种新型抗肿瘤治疗方式是当下的研究热点。免疫治疗通过激活机体自身的免疫系统来攻击肿瘤细胞[26,27],增强自身免疫系统对肿瘤细胞的识别能力,实现机体自动清除肿瘤细胞。相较于其他治疗方式,肿瘤免疫治疗具有特异性,不会杀伤正常组织及细胞,并可产生免疫记忆,能有效防止肿瘤转移。肿瘤免疫治疗有多种治疗策略,包括细胞因子治疗[28,29]、检查点阻断治疗[30,31]、过继性T细胞转移,尤其是最新研究的嵌合抗原受体T(CAR-T)细胞治疗[32,33,34,35]、肿瘤疫苗[36,37,38]等。然而,免疫治疗对于小量或具有弥散性肿瘤细胞的清除更有效,而对于实体瘤的治疗效果则具有局限性,因此此方法常作为一种辅助治疗手段联合其他抗肿瘤方法协同治疗恶性肿瘤,以防止其复发和转移。
作为免疫治疗策略之一的肿瘤疫苗具有许多独特的优势[39,40]。有研究结果表明,相比于免疫检查点阻断等治疗方法诱导的非特异性免疫应答[41],载有肿瘤相关抗原的肿瘤疫苗能产生针对肿瘤的特异性免疫应答,可产生长期免疫记忆效应,有利于预防肿瘤的复发[42,43]。肿瘤疫苗包括含有肿瘤特异性抗原的疫苗和全癌细胞疫苗[44,45]。尽管在肿瘤特异性相关抗原的刺激下可诱导机体产生强烈的抗肿瘤免疫应答,但由于患者的个体差异较大而限制了它的临床应用。全癌细胞疫苗可针对机体内释放的所有潜在肿瘤抗原产生免疫反应,理论上适用于各种类型的实体瘤[39],但复杂的制备过程以及剂量的不确定性限制了它的应用[46]。
传统观念认为化疗和免疫治疗是两种相互拮抗的治疗方法,很难在一起配伍使用。化疗药物选择性较差,在杀伤肿瘤细胞的同时会对正常细胞造成不可逆损伤,其造成的不良反应会抑制机体免疫反应。然而近些年有研究结果表明,化疗药物可通过减少调节性T细胞的数量以及诱导树突状细胞(dendritic cell,DC)的成熟等来增强机体免疫细胞的功能[47],提高机体抗肿瘤的能力,为化疗联合免疫治疗带来了希望。二者联用不仅可在一定程度上减少化疗药物的毒性以及降低肿瘤细胞耐药性的发生,还能提高肿瘤抗原的交叉提呈作用。因此化疗联合免疫疗法在临床具有极大的应用前景。
Atezolizumab是人源化抗程序性死亡受体-1(programmed cell death-1,PD-L1)的高亲和性免疫球蛋白G1型抗体,可阻止PD-L1与PD-1和B7-1结合。PD-L1抑制剂则允许PD-1结合另一个PD-L2配体,由此有助于维持肺的免疫耐受性,降低肺炎的风险。2015年美国临床肿瘤学会公布数据显示,37例局部进展或转移的非小细胞肺癌患者接受Atezolizumab联合TAX/卡铂、Atezolizumab联合培美曲赛/卡铂、Atezolizumab联合蛋白结合型TAX/卡铂治疗后的客观缓解率分别为60%、75%和62%,主要不良反应是血液学毒性[48]。目前基础研究方面表明化疗联合免疫治疗具有协同作用,可提高客观缓解率,但增加了不良反应[49]。化疗联合免疫治疗为今后的临床治疗提供了一种新思路,但还需根据每种化疗药物以及免疫治疗药物的不同探索最佳的治疗策略。
Golab等[50]观察比较PDT联合瘤体内注射重组人细胞因子(G-CSF)对C-26型结肠癌和Lewis肺癌两种肿瘤的治疗疗效,发现结肠癌组小鼠得到治愈,肺癌组小鼠生存期较对照组延长33%。另外,治愈的小鼠似具有长期的抗肿瘤免疫作用。动物实验同样证实免疫佐剂BCG与PDT联合可明显抑制EMT6乳腺癌的生长,另一种分支杆菌细胞壁提取物MCWE与BCG具有相同的作用[51]。Jalili等[52]研究血卟啉-PDT联合DC细胞治疗荷C26结肠腺癌的移植瘤小鼠,瘤体内注射DC细胞后,可充分激活抗肿瘤免疫效应,小鼠肿瘤体积明显缩小。还有研究人员应用转载了IL-2基因的NK细胞(NK92MI)联合PDT治疗荷头颈部鳞状细胞癌、结肠腺癌和EMT6乳腺癌小鼠移植瘤,其疗效可明显提高[53,54]。
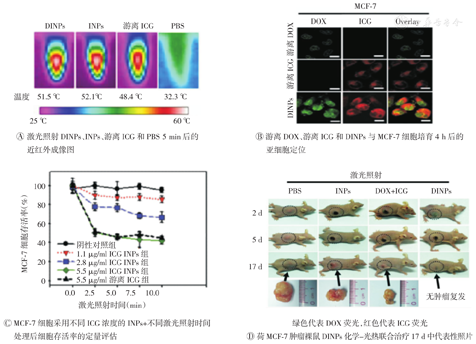
光动力疗法在临床上作为辅助疗法,可以与化疗协同治疗肿瘤。Zheng[55]将DOX和ICG共同包载于磷脂-聚合物纳米颗粒中(DINPs),成功构建了化疗光热协同的诊疗一体化纳米载药系统(图3)。其成功构建的DINPs可显著增强ICG的稳定性,在激光照射下能产生比游离ICG更高的局部温度,从而促进细胞对DOX和ICG的摄取。证明DINPs化疗与光热的协同治疗能抑制MCF-7肿瘤的生长,并高效防止肿瘤复发。

综上所述,各肿瘤治疗方法的联合应用是21世纪肿瘤治疗的发展趋势。与传统的单一治疗方法相比,光动力、免疫方法等联合治疗肿瘤可明显提高治疗效果,达到具有较广的适用范围、较轻副作用、较少不良反应的目的。目前几种不同方法的联合治疗已成为当下研究的热点,并取得了一定的研究成果;但在临床实践中仍存在许多问题,如在联合应用中如何调整化疗药物剂量使其在有最大药效的同时具有较低的不良反应、如何改善光源的穿透力使光动力疗法在机体深层次的肿瘤得以应用以及免疫治疗中如何平衡有效的免疫力和免疫耐受性来最大限度地减少潜在副作用等。相信随着医学及相关学科的发展,这些问题有望得到突破,肿瘤的联合治疗必将会有质的飞跃。
无



























