
探讨前列腺素D2合成酶(PTGDS)在非小细胞肺癌(NSCLC)[包括肺腺癌(ADC)和肺鳞癌(SCC)]中的作用及可能的机制。
首先,通过基因表达汇编(GEO)数据库对PTGDS在ADC和SCC中各自的蛋白表达进行分析。然后,通过组织芯片对PTGDS的蛋白表达进行验证。最后,选取A549和Calu-3细胞系过表达PTGDS,采用体外侵袭实验检测其侵袭能力,采用蛋白质印迹法进行检测其蛋白表达的变化。
PTGDS在ADC和SCC中的蛋白表达均下调,但是在ADC和SCC之间差异无统计学意义,且其仅与ADC的肿瘤发展相关。在过表达PTGDS以后,ADC肿瘤细胞的侵袭能力显著下降,蛋白质印迹法显示其内部机制可能与MAPK信号通路有关。
PTGDS在NSCLC中表达下调,其与ADC的发展有关,而与SCC的发展无关。PTGDS是NSCLC早期诊断与预后判断的一个潜在的肿瘤标志物,其是否可用于NSCLC的药物治疗将是我们接下来研究的重点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
前列腺素D2 (PGD2)是炎性反应中一个重要的调节分子,其功能主要依赖前列腺素D类受体1和前列腺素D类受体2的相互作用[1]。研究显示,PGD2与多种肿瘤的发生发展相关,如胃癌和睪丸癌等[2,3,4]。前列腺素D2合成酶(Prostaglandin D2 synthase,PTGDS),是调节PGD2合成最重要的酶,由相对分子质量为21 000的氨基酸组成[5]。目前有关PTGDS的研究主要集中于精神疾病[6],有关其在肿瘤中的作用研究较少。肺癌是全世界最常见的恶性肿瘤之一,其发病率和死亡率均位居前列[7,8]。非小细胞肺癌(NSCLC)是肺癌最常见的类型,大约占肺癌发病总数的80%~85%[9],对于NSCLC来说其最常见的两个亚型是肺腺癌(ADC)和肺鳞癌(SCC)[10]。本研究旨在探讨PTGDS在NSCLC(包括肺腺癌、肺鳞癌)中的作用及可能的机制。现将研究结果报道如下。
从GEO数据库搜索并导出有关PTGDS与NSCLC的数据集,总共有8个数据集纳入本研究,分别为GSE1037 (肺癌)、GSE2088 (肺鳞状细胞癌)、GSE20853(肺腺癌),GSE19188 (早期NSCLC)、GSE31210 (Gene expression data for pathological stage Ⅰ~Ⅱ lung adenocarcinomas)、GSE30219 ("Off-context"gene expression in lung cancer identifies a group of metastatic-prone tumors)、GSE8894 (Prediction of recurrence-free survival in postoperative NSCLC patients- a useful prospective clinical practice)和GSE11969 (Expression profile- defined classification of lung adenocarcinoma)。
从西安艾丽娜生物科技有限公司购入一张非小细胞肺癌组织芯片,编号为BC041115c。组织芯片包括有48例ADC组织、40例SCC组织以及10例正常肺组织,所有患者的平均年龄为54.5岁。详细信息见表1。
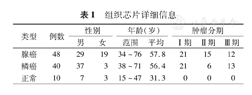
组织芯片详细信息
组织芯片详细信息
| 类型 | 例数 | 性别 | 年龄(岁) | 肿瘤分期 | ||||
|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 范围 | 平均 | Ⅰ期 | Ⅱ期 | Ⅲ期 | ||
| 腺癌 | 48 | 29 | 19 | 34~76 | 57.8 | 21 | 15 | 12 |
| 鳞癌 | 40 | 37 | 3 | 38~71 | 56.4 | 21 | 6 | 13 |
| 正常 | 10 | 7 | 3 | 15~47 | 31.3 | 0 | 0 | 0 |
试剂盒采购自武汉谷歌生物科技有限公司,免疫组化采用两步法进行。一抗为美国西格玛公司抗体(Sigma-Aldrich,鼠抗,稀释度1∶100)。实验步骤如下:(1)切片常规脱蜡;(2)枸橼酸缓冲液修复;(3)3%过氧化氢避光孵育,阻断过氧化物酶;(4)一抗孵育过夜,4 ℃;(5)HRP标记二抗室温孵育0.5 h;(6)DAB显色,苏木精复染;(7)梯度乙醇脱水干燥,二甲苯透明,中性树胶封片。枸橼酸液修复步骤后每一步均用磷酸盐缓冲液(PBS)冲洗3遍,每遍5 min。
阳性信号为黄色或棕黄色,按照阳性信号的强度(Intensity,0~3)和频度(Frequency,0~4)作为评价指标。强度分为:阴性(0)、弱阳性(1)、阳性(2)、强阳性(3)。频度分为:0%(0)、1%~25%(1)、26%~50%(2)、51%~75%(3)、76%~100%(4)。综合评分(CES)=Intensity×Frequency。CES分为阴性(0)、弱阳性(1~4)、阳性(5~8)、强阳性(9~12)。
ADC细胞系A549和Calu-3由武汉大学人民医院中心实验室提供,细胞生长于含10%胎牛血清RPMI-1640培养基中,培养温度为37 ℃,CO2浓度为5%。胎牛血清购自于美国HyClone公司,RPMI-1640培养基购自于美国Invitrogen公司,本研究相关所用试剂均购买于美国西格玛奥德里奇公司。蛋白质印迹法实验中所用的细胞均为处于对数生长期的细胞。
在质粒中克隆PTGDS的cDNA,这些扩增的cDNA用于在A549和Calu-3细胞中过表达PTGDS蛋白。被转染含有cDNA的质粒的细胞被命名为A549/PTGDS和Calu-3/PTGDS,被转染不含有cDNA的质粒的细胞被命名为A549/CTRL和Calu-3/CTRL。在细胞转染72 h以后,用1.5 ng/ml的嘌呤霉素对细胞进行选取。
采用8 μm孔径的Transwell小室检测细胞的体外侵袭能力。首先将Transwell小室悬挂于24孔板内,在上室内加入50 ml无血清培养液稀释的Matrigel胶(美国Sigma公司),置入37 ℃培养箱6 h使之凝固;在下室内加入600 μl含10%胎牛血清的RPMI-1640培养液。收集转染后24 h的细胞,以1×105个细胞悬液加入Transwell上室内,继续培养24 h后取出Transwell小室,棉签擦拭去上室内细胞,将已经侵入并贴附于下层微孔膜的细胞用多聚甲醛固定10 min后采用1%结晶紫染色细胞5 min,PBS清洗后于显微镜下观察侵袭细胞数量,每张微孔膜随机选5个视野进行细胞计数。
采用Western印迹检测,提取细胞和组织的总蛋白,用BCA法测蛋白浓度,取20 μg蛋白上样到9%十二烷基酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳、转膜至PVDF膜,5%牛奶(溶于TBST)室温封闭1 h,加一抗,4 ℃孵育过夜,TBST洗膜10 min×3次,再用相应的辣根过氧化物酶标记的二抗孵育1 h,再次TBST洗膜10 min×3次,配制新鲜发光液,膜孵育2 min,曝光显影。
计量数据采用 ±s表示,采用SPSS 20计数件进行分析,组间的比较采用t检验,P<0.05为差异有统计学意义。
±s表示,采用SPSS 20计数件进行分析,组间的比较采用t检验,P<0.05为差异有统计学意义。
PTGDS在ADC和SCC中的表达均下调,且仅与ADC的预后相关。GSE1037,GSE2088,GSE20853和GSE19188的分析结果显示,在ADC和SCC中的PTGDS蛋白表达均下调,但是在ADC和SCC中的PTGDS蛋白表达差异无统计学意义。GSE31210的分析结果显示,PTGDS在ADC中的蛋白表达下调,与低总生存率以及低无复发生存率均显著相关。此外,PTGDS在Ⅱ期非小细胞肺癌中表达显著低于Ⅰ期。GSE30219的分析结果显示,PTGDS蛋白表达,与ADC的总生存率有相关性,而与其无复发生存率无相关性。而对于SCC,PTGDS与其预后均无相关性(图1)。
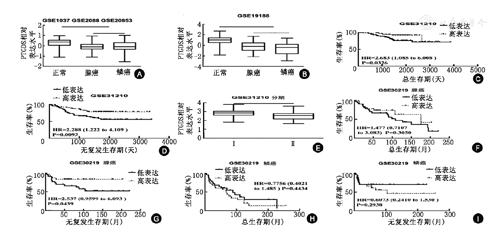

注:A, ID:31098,正常与ADC:P<0.001,正常与SCC:P<0.001, ADC a与SCC:P>0.05; B, ID:211663_x_at,正常与ADC:P<0.001,正常与SCC:P<0.001, ADC与SCC:P>0.05; C, ID:211663_x_at, HR=2.683 (1.085 to 6.008),P<0.05; D, ID:211663_x_at,HR=2.288 (1.222 to 4.109),P<0.001; E, ID:211663_x_at,P<0.001; F, ID:211663_x_at, HR=1.477 (0.710 7 to 3.083),P>0.05; G, ID:211663_x_at, HR=2.537 (0.959 9 to 6.093),P<0.05; H, ID:211663_x_at, HR=0.7756 (0.402 1 to 1.485),P>0.05; I, ID:211663_x_at, HR=0.6073 (0.241 0 to 1.530),P>0.05
GSE8894的分析结果显示,PTGDS蛋白表达,在ADC与SCC之间差异无统计学意义。此外,PTGDS与ADC的复发显著相关,与SCC的复发无明显相关性。GSE11969的分析结果显示,PTGDS的蛋白表达与ADC的临床分期、肿瘤复发以及分化程度均相关。这与p53基因突变有关,而与EGFR、KRAS的基因突变无关。此外,PTGDS蛋白表达还受到局部因素,诸如细菌、肿瘤侵袭以及组织坏死等的影响(图2)。
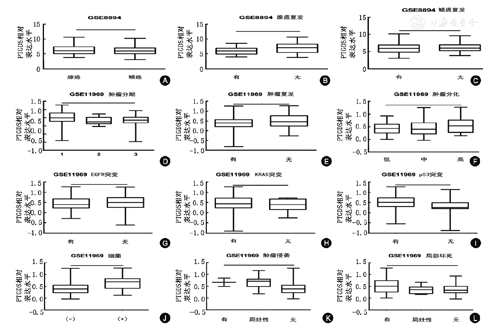

注:A, ID:211663_x_at, P>0.05; B, ID:211663_x_at,P<0.05; C, ID:211663_x_at,P>0.05; D, ID: 11,P<0.05; E, ID: 11,P<0.05; F, ID: 11,P<0.05; G, ID: 11,P>0.05; H, ID: 11,P>0.05; I, ID: 11,P<0.01; J, ID: 11,P<0.01; K, ID: 11,P<0.01; L, ID: 11,P<0.05
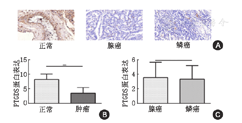
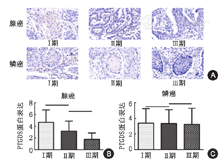
首先,对正常组织与肿瘤组织中的PTGDS蛋白表达进行对比,结果显示PTGDS在肿瘤组织中是表达下调的,见图3,t=7.300,df=93,P<0.001。然后,对ADC与SCC组织中的PTGDS蛋白表达进行对比,结果显示两者之间无明显差异,见图3,t=0.4868,df=83,P=0.628。其次,对ADC不同临床分期中的PTGDS蛋白表达进行对比,结果显示PTGDS在高临床分期中的蛋白表达要明显低于在低临床分期中,见图4,Ⅰ期与Ⅱ期:t=2.199,df=33,P=0.035;Ⅱ期与Ⅲ期:t=2.374,df=23,P=0.026。最后,对SCC不同临床分期中的PTGDS蛋白表达进行对比,没有发现明显差异,见图4,Ⅰ期与Ⅱ期:t=0.057,df=25,P=0.955;Ⅱ期与Ⅲ期:t=0.106,df=17,P=0.917。


转染质粒后,得到稳定生长的A549和Calu-3细胞(图5)。在过表达PTGDS以后,A549和Calu-3细胞的侵袭能力显著下降(图6)。蛋白质印迹实验显示,随着PTGDS蛋白表达的升高,MAPK信号通路相关蛋白,诸如p-P38、T-P38、p-ERK、T-ERK、p-JNK以及T-JNK的蛋白表达显著下降(图7)。
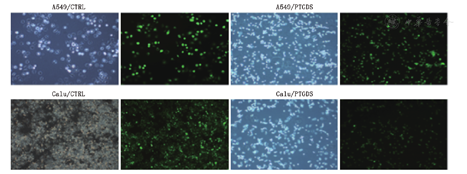

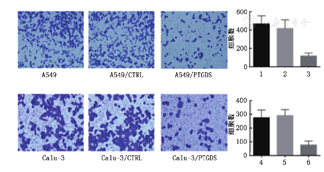

1:A549;2:A549/CTRL;3:A549/PTGDS;4:Calu3;5:Calu3/CTRL;6:Calu3/PTGDS
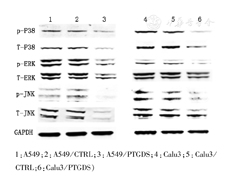

1:A549;2:A549/CTRL;3:A549/PTGDS;4:Calu3;5:Calu3/CTRL;6:Calu3/PTGDS)
NSCLC最主要的治疗方法是放化疗与手术切除联合治疗[11],而处于Ⅲ期或者Ⅳ期的的NSCLC患者已经失去了手术的最佳时机[12]。在临床上,NSCLC预后不良的主要原因之一就是在诊断时已经处于晚期,或者癌细胞已经扩散。有文献报道,PGD2通过抑制肿瘤微环境的血管生成,能够抑制肺癌的生长[13]。作为PGD2的主要合成酶,PTGDS也与多种肿瘤的生长相关,包括头颈肿瘤、子宫内膜癌以及葡萄膜黑色素瘤等[14]。尽管有报道PTGDS蛋白表达在肺癌中是下调的,其内部机制仍不清楚[15]。
本研究显示PTGDS在ADC与SCC中均下调,且与ADC预后相关,与SCC预后无关。在腺癌中,PTGDS在小鼠肠道肿瘤的生长过程中有抑制作用[16],这种作用可能与H-rev107基因有关。研究显示,沉默PTGDS基因能够减轻H-rev107介导的肿瘤细胞转移和侵袭作用,并且RIG1基因能够和PTGDS相互作用,增强其对肿瘤转移和侵袭的抑制作用[17]。
为了进一步对探索其内部机制,使用A549和Calu-3细胞系过表达PTGDS。结果显示,肿瘤细胞的侵袭能力与PTGDS紧密相关,且过表达PTGDS以后,MAPK信号通路相关蛋白表达明显下降。MAPK信号通路在NSCLC侵袭与转移过程中,发挥有重要作用[18,19]。有研究显示口服低剂量的双酚A能够促进PTGDS的蛋白表达[20],这是否能够用于对NSCLC肿瘤细胞的抑制,仍需要我们进一步的研究。
总之,我们的研究显示PTGDS在NSCLC中表达下调,其与ADC的发展有关,而与SCC的发展无关。PTGDS是NSCLC早期诊断与预后判断的一个潜在的肿瘤标志物,其是否可用于NSCLC的药物治疗将是我们接下来研究的重点。



























