
探讨冠心病经皮冠状动脉介入治疗(PCI)术后随访期间发生脑卒中患者的临床特征及预后特点。
选择阜外医院2013年行PCI的10 724例冠心病患者,PCI术后随访2年,比较随访期间发生与未发生脑卒中的两组患者的临床特征和预后特点。
共有145例PCI术后的冠心病患者发生脑卒中(1.4%),其中缺血性卒中124例(1.2%),4例(3.2%)患者死亡;出血性卒中21例(0.2%),9例(42.9%)患者死亡。与PCI术后未发生卒中的患者相比,发生脑卒中的患者女性比例较高,合并更多的临床危险因素(高血压、既往心肌梗死病史、既往脑卒中病史等)。2年随访结果提示,PCI术后发生脑卒中患者的全因死亡率明显高于未发生脑卒中患者(9.0%比1.1%;P<0.000 1),心源性死亡、心肌梗死、血运重建、支架血栓和主要不良心血管事件的发生率,两组患者之间差异无统计学意义。COX回归分析显示,PCI术后的脑卒中是全因死亡的独立危险因素(HR=8.387, 95%CI:4.725~14.855,P<0.000 1),倾向性评分调整后,上述趋势没有变化,PCI术后的脑卒中仍是全因死亡的独立危险因素(HR=6.737, 95%CI:1.52~29.85, P=0.012)。
PCI术后发生脑卒中的冠心病患者,合并更多的临床高危因素,并且动脉粥样硬化的程度更重。PCI术后2年随访期间发生的脑卒中是冠心病患者全因死亡的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
冠心病和脑卒中合并发病,虽然发病率低,但病死率高,预后极差。既往GRACE研究显示,急性冠状动脉综合征患者住院期间合并脑卒中的发生率为0.88%,病死率高达32.6%,远高于未合并卒中患者(32.6%比5.1%,P<0.001)[1]。根据脑病理改变可分为缺血性脑卒中和出血性脑卒中[2,3]。目前,国内有关冠心病患者经皮冠状动脉介入治疗(PCI)术后长期随访过程中发生脑卒中的临床研究资料较为缺乏。本研究拟通过对单中心大样本冠心病患者PCI术后2年长期随访结果的分析,探讨国人PCI术后发生脑卒中患者的临床特征和预后影响,以期为临床决策提供参考。
本研究为前瞻性单中心观察性研究,连续纳入自2013年1月至12月于中国医学科学院阜外医院行PCI治疗的10 724例患者。按常规方法置入支架[4]。计划急诊PCI的ACS患者(STEMI and NSTE-ACS),术前尽早给予阿司匹林负荷量,同时氯吡格雷300~600 mg或替格瑞洛180 mg负荷量。对于无禁忌证且术前无长期口服抗血小板药物的择期PCI患者,术前至少24 h口服阿司匹林300 mg负荷量,同时氯吡格雷300 mg或替格瑞洛180 mg负荷量,术中经动脉鞘管给予肝素100 U/kg,如果手术时间超过1 h再追加1 000 U,糖蛋白Ⅱb/Ⅲa拮抗剂的应用由术者根据临床和病变情况决定。术后根据指南推荐给予双联抗血小板药物治疗(阿司匹林100 mg/d和氯吡格雷75 mg/d或替格瑞洛90 mg每天2次的双联抗血小板治疗)[5]。
自病例和介入治疗记录中收集患者一般临床资料、实验室检查结果、介入治疗资料。造影结果用定量冠状动脉测量(QCA)进行评价。患者均已签署知情同意书且研究已通过医院伦理委员会审核(批准号:2013-449)。以上资料来源于阜外医院介入导管室核心实验室。
心源性死亡定义为无明确非心源性原因导致的死亡。心肌梗死诊断依据第三版心肌梗死全球定义[6]。血运重建为缺血症状或事件驱动的对任一病变进行的血运重建治疗,包括PCI和冠状动脉旁路移植术(CABG)。支架内血栓(ST)定义为学术研究联盟(ARC)正式发表的肯定的(definite)、可能的(probable)和不能排除的(possible)支架内血栓形成[7]。脑卒中为神经科医师确诊的新发脑梗死和脑出血。诊断标准参照《中国急性缺血性卒中诊治指南2014》、《中国脑出血诊治指南》[2,3]。主要不良心脑血管事件(MACE)包括心源性死亡、心肌梗死(MI)、血运重建和支架内血栓。
住院期间、PCI术后1年、2年,包括门诊随访、电话随访和书信随访,主要记录死亡、心源性死亡、心肌梗死、血运重建、支架内血栓等主要不良心血管事件。
统计分析采用SPSS 22.0版本进行。正态分布计量资料描述为 ±s或中位数(四分位数),计数资料以比例(%)表示。计量资料采用配对t检验,计数资料采用χ2检验。多因素回归分析采用Logistic回归分析。生存曲线采用Kaplan-Meier生存分析,不良事件的多因素回归分析采用COX回归分析。倾向性得分匹配(PS)采用R语言的Rstudio软件进行。P<0.05为差异有统计学意义。
±s或中位数(四分位数),计数资料以比例(%)表示。计量资料采用配对t检验,计数资料采用χ2检验。多因素回归分析采用Logistic回归分析。生存曲线采用Kaplan-Meier生存分析,不良事件的多因素回归分析采用COX回归分析。倾向性得分匹配(PS)采用R语言的Rstudio软件进行。P<0.05为差异有统计学意义。
10 724例行PCI的冠心病患者,术后住院期间1例缺血性卒中和2例出血性卒中患者发生死亡(0.3‰)。出院后2年随访期间,142例患者发生脑卒中(1.3%),其中缺血性卒中123例,3例患者死亡,病死率2.4%;出血性卒中19例,7例患者死亡,病死率36.8%。住院及2年随访期间,共145例患者发生脑卒中(1.4%),其中缺血性卒中124例(1.2%),4例患者死亡,病死率3.2%;出血性卒中21例(0.2%),9例患者死亡,病死率高达42.9%。
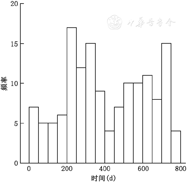
随访时间分析显示,21例患者PCI术后半年内发生脑卒中(0.2%),其中缺血性卒中15例,1例患者死亡,病死率为6.7%;出血性卒中6例,3例患者死亡,病死率高达50.0%。PCI术后半年到2年随访期间,124例患者发生脑卒中(1.2%),其中缺血性卒中109例,3例患者死亡,病死率为2.8%;出血性卒中15例,6例患者死亡,病死率达40.0%(图1)。

与PCI术后2年随访期间未发生脑卒中的患者相比,发生脑卒中的患者中,女性(29.7%比22.8%,P=0.05)及合并心血管危险因素(高血压、既往心肌梗死等)的比例较高(P<0.05),既往脑卒中病史的患者比例明显较高(P<0.001),术前肾小球滤过率(GFR)较低(P<0.05)。病变特点方面,发生脑卒中的患者左主干比率较高(5.5%比2.5%;P=0.031);靶病变个数和PCI次数均高于PCI术后未发生脑卒中的患者(P<0.05)(表1)。
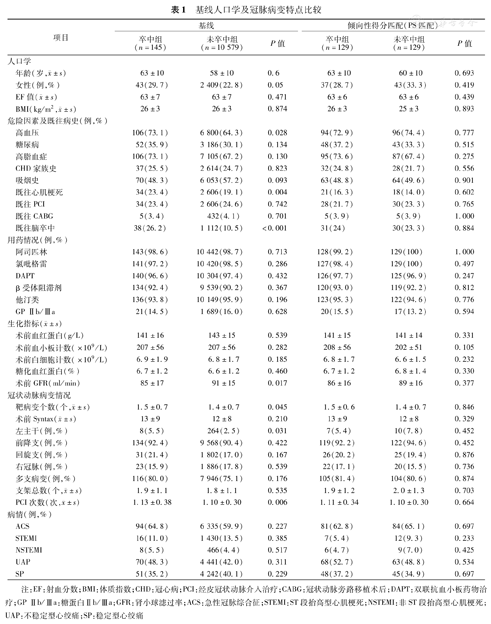
基线人口学及冠脉病变特点比较
基线人口学及冠脉病变特点比较
| 项目 | 基线 | 倾向性得分匹配(PS匹配) | |||||
|---|---|---|---|---|---|---|---|
| 卒中组(n=145) | 未卒中组(n=10 579) | P值 | 卒中组(n=129) | 未卒中组(n=129) | P值 | ||
| 人口学 | |||||||
年龄(岁, ±s) ±s) | 63±10 | 58±10 | 0.6 | 63±10 | 60±10 | 0.693 | |
| 女性(例,%) | 43(29.7) | 2 409(22.8) | 0.05 | 37(28.7) | 43(33.3) | 0.419 | |
EF值( ±s) ±s) | 63±7 | 63±7 | 0.471 | 63±6 | 63±6 | 0.439 | |
BMI(kg/m2, ±s) ±s) | 26±3 | 26±3 | 0.874 | 26±3 | 25±3 | 0.893 | |
| 危险因素及既往病史(例,%) | |||||||
| 高血压 | 106(73.1) | 6 800(64.3) | 0.028 | 94(72.9) | 96(74.4) | 0.777 | |
| 糖尿病 | 52(35.9) | 3 186(30.1) | 0.134 | 48(37.2) | 43(33.3) | 0.515 | |
| 高脂血症 | 106(73.1) | 7 105(67.2) | 0.130 | 95(73.6) | 87(67.4) | 0.275 | |
| CHD家族史 | 37(25.5) | 2 614(24.7) | 0.823 | 32(24.8) | 28(21.7) | 0.556 | |
| 吸烟史 | 70(48.3) | 6 053(57.2) | 0.093 | 63(48.8) | 64(49.6) | 0.901 | |
| 既往心肌梗死 | 34(23.4) | 2 606(19.1) | 0.004 | 21(16.3) | 18(14.0) | 0.602 | |
| 既往PCI | 34(23.4) | 2 606(24.6) | 0.742 | 28(21.7) | 30(23.3) | 0.765 | |
| 既往CABG | 5(3.4) | 432(4.1) | 0.701 | 5(3.9) | 5(3.9) | 1.000 | |
| 既往脑卒中 | 38(26.2) | 1 112(10.5) | <0.001 | 31(24) | 30(23.3) | 0.884 | |
| 用药情况(例,%) | |||||||
| 阿司匹林 | 143(98.6) | 10 442(98.7) | 0.713 | 128(99.2) | 129(100) | 1.000 | |
| 氯吡格雷 | 141(97.2) | 10 420(98.5) | 0.286 | 127(98.4) | 129(100) | 0.497 | |
| DAPT | 140(96.6) | 10 304(97.4) | 0.432 | 126(97.7) | 125(96.9) | 0.247 | |
| β受体阻滞剂 | 134(92.4) | 9 539(90.2) | 0.367 | 120(93.0) | 119(92.2) | 0.812 | |
| 他汀类 | 136(93.8) | 10 149(95.9) | 0.196 | 123(95.3) | 122(94.6) | 0.776 | |
| GP Ⅱb/Ⅲa | 21(14.5) | 1 689(16.0) | 0.628 | 20(15.5) | 17(13.2) | 0.594 | |
生化指标( ±s) ±s) | |||||||
| 术前血红蛋白(g/L) | 141±16 | 143±15 | 0.539 | 141±15 | 141±14 | 0.331 | |
| 术前血小板计数(×109/L) | 207±56 | 207±56 | 0.282 | 208±56 | 202±51 | 0.105 | |
| 术前白细胞计数(×109/L) | 6.9±1.9 | 6.8±1.7 | 0.185 | 6.8±1.7 | 6.6±1.5 | 0.232 | |
| 糖化血红蛋白(%) | 6.7±1.2 | 6.6±1.2 | 0.460 | 6.7±1.2 | 6.8±1.4 | 0.330 | |
| 术前GFR(ml/min) | 85±17 | 91±15 | 0.017 | 86±16 | 89±16 | 0.377 | |
| 冠状动脉病变情况 | |||||||
靶病变个数(个, ±s) ±s) | 1.5±0.7 | 1.4±0.7 | 0.045 | 1.5±0.6 | 1.4±0.7 | 0.846 | |
术前Syntax( ±s) ±s) | 13±9 | 12±8 | 0.210 | 13±9 | 12±8 | 0.329 | |
| 左主干(例,%) | 8(5.5) | 264(2.5) | 0.031 | 7(5.4) | 10(7.8) | 0.452 | |
| 前降支(例,%) | 134(92.4) | 9 568(90.4) | 0.422 | 119(92.2) | 122(94.6) | 0.452 | |
| 回旋支(例,%) | 31(21.4) | 1 802(17.0) | 0.167 | 26(20.2) | 25(19.4) | 0.876 | |
| 右冠脉(例,%) | 23(15.9) | 1 886(17.8) | 0.539 | 22(17.1) | 20(15.5) | 0.736 | |
| 多支病变(例,%) | 116(80.0) | 7 946(75.1) | 0.176 | 105(81.4) | 104(80.6) | 0.874 | |
支架总数(个, ±s) ±s) | 1.9±1.1 | 1.8±1.1 | 0.535 | 1.9±1.2 | 2.0±1.3 | 0.703 | |
PCI次数(次, ±s) ±s) | 1.13±0.38 | 1.10±0.30 | 0.006 | 1.11±0.34 | 1.10±0.30 | 0.664 | |
| 病情(例,%) | |||||||
| ACS | 94(64.8) | 6 335(59.9) | 0.227 | 81(62.8) | 84(65.1) | 0.697 | |
| STEMI | 16(11.0) | 1 430(13.5) | 0.385 | 7(5.4) | 12(9.3) | 0.233 | |
| NSTEMI | 8(5.5) | 466(4.4) | 0.517 | 6(4.7) | 9(7.0) | 0.425 | |
| UAP | 70(48.3) | 4 441(42.0) | 0.311 | 68(52.7) | 63(48.8) | 0.534 | |
| SP | 51(35.2) | 4 242(40.1) | 0.229 | 48(37.2) | 45(34.9) | 0.697 | |
注:EF:射血分数;BMI:体质指数;CHD:冠心病;PCI:经皮冠状动脉介入治疗;CABG:冠状动脉旁路移植术后;DAPT:双联抗血小板药物治疗;GP Ⅱb/Ⅲa:糖蛋白Ⅱb/Ⅲa;GFR:肾小球滤过率;ACS:急性冠脉综合征;STEMI:ST段抬高型心肌梗死;NSTEMI:非ST段抬高型心肌梗死;UAP:不稳定型心绞痛;SP:稳定型心绞痛
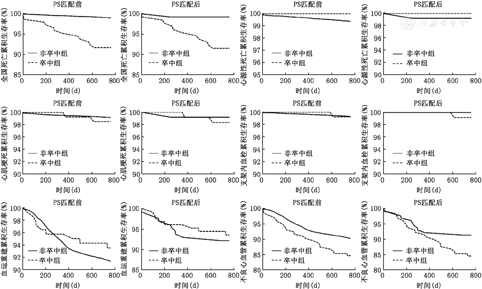
2年随访结果显示,PCI术后发生脑卒中的患者全因死亡率明显高于未发生脑卒中的患者(9.0%比1.1%;P<0.000 1)。两组患者心源性死亡、心肌梗死、血运重建、支架内血栓发生率差异无统计学意义(P>0.05)。两组患者主要不良心血管事件的发生率比较差异也无统计学意义(P>0.05,表2)。Kaplan-Meier生存分析显示了同样的趋势(图2)。
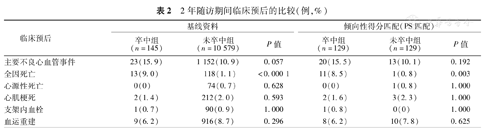
2年随访期间临床预后的比较(例,%)
2年随访期间临床预后的比较(例,%)
| 临床预后 | 基线资料 | 倾向性得分匹配(PS匹配) | ||||
|---|---|---|---|---|---|---|
| 卒中组(n=145) | 未卒中组(n=10 579) | P值 | 卒中组(n=129) | 未卒中组(n=129) | P值 | |
| 主要不良心血管事件 | 23(15.9) | 1 152(10.9) | 0.057 | 20(15.5) | 13(10.1) | 0.192 |
| 全因死亡 | 13(9.0) | 118(1.1) | <0.000 1 | 11(8.5) | 1(0.8) | 0.003 |
| 心源性死亡 | 0(0) | 74(0.7) | 0.628 | 0(0) | 1(0.8) | 1.000 |
| 心肌梗死 | 2(1.4) | 212(2.0) | 0.593 | 2(1.6) | 3(2.3) | 1.000 |
| 支架内血栓 | 1(0.7) | 90(0.9) | 1.000 | 1(0.8) | 0(0) | 1.000 |
| 血运重建 | 9(6.2) | 916(8.7) | 0.296 | 8(6.2) | 10(7.8) | 0.625 |

COX回归分析提示,PCI术后随访期间发生的脑卒中是全因死亡的独立危险因素(HR=8.387, 95%CI 4.725~14.855, P<0.000 1);而不是心源性死亡、心肌梗死、血运重建以及支架内血栓的独立危险因素(表3)。
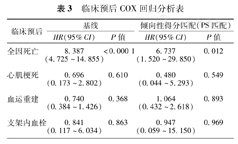
临床预后COX回归分析表
临床预后COX回归分析表
| 临床预后 | 基线 | 倾向性得分匹配(PS匹配) | ||
|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 全因死亡 | 8.387(4.725~14.855) | <0.000 1 | 6.737(1.520~29.850) | 0.012 |
| 心肌梗死 | 0.696(0.173~2.802) | 0.610 | 0.480(0.044~5.293) | 0.549 |
| 血运重建 | 0.740(0.384~1.426) | 0.368 | 1.064(0.432~2.618) | 0.893 |
| 支架内血栓 | 0.841(0.117~6.034) | 0.863 | 0.947(0.059~15.150) | 0.969 |
通过调整基线不均衡和对预后有影响的因素,倾向性评分得出129对卒中患者和非卒中患者,患者基线参数均不再有显著性差别(表1)。倾向性评分调整后,PCI术后随访期间发生脑卒中的患者全因死亡率仍然明显高于未发生卒中的患者(8.5%比0.8%;P=0.003)。两组患者其他不良心血管事件(心源性死亡、心肌梗死、血运重建、支架血栓)的发生率差异无统计学意义(P>0.05)(表2)。Kaplan-Meier生存分析显示同样的上述趋势(图2)。COX回归分析提示,PCI术后随访期间发生的脑卒中仍然是全因死亡的独立危险因素(HR=6.737, 95%CI 1.52~29.85, P=0.012)(表3)。
脑卒中是指脑局部血液循环障碍所致的神经功能缺损综合征,症状持续至少24 h,如脑缺血症状持续<24 h,且CT或MRI未显示结构性改变则称为短暂性脑缺血发作。根据脑病理改变可分为缺血性脑卒中和出血性脑卒中。在临床实践中冠心病伴随脑卒中是治疗的难点。虽然二者同时发生的概率很低,但致残率和病死率都很高,预后极差。多项研究显示,冠心病患者住院期间合并脑卒中的发病率在0.18%~0.44%,病死率高达19%~37%[8,9,10,11],而急性心肌梗死患者1年随访期间缺血性脑卒中的发生率可达4.1%,病死率高达36.5%[12]。本研究发现,冠心病患者PCI术后的2年随访期间,1.4%(n=145)的患者发生脑卒中,其中缺血性卒中占比1.2%(n=124),病死率为3.2%(n=4)。冠心病合并缺血性脑卒中的发病原因如下:两者基本病因是动脉粥样硬化,均为动脉粥样硬化常见并发症,同时都具有相同高危因素:性别、年龄、吸烟、高血压、高脂血症、糖尿病、肥胖等。
本研究在单中心、大样本的冠心病PCI患者中进行2年长期随访,研究结果显示:(1)与未发生脑卒中的患者相比,发生脑卒中的患者女性比例较高,常合并高血压,同时既往心肌梗死病史,尤其既往有脑卒中病史的比例明显较高,而年龄、吸烟、高血脂、糖尿病的发生率差异无统计学意义(P>0.05);(2)发生脑卒中的患者左主干比例较高;靶病变数和PCI次数均稍高于PCI术后未发生脑卒中的患者。本研究提示PCI术后发生脑卒中的冠心病患者,合并更多的临床高危因素,并且动脉粥样硬化的程度更重。因此,临床实践中识别卒中高危患者是预防卒中的重要环节之一。
Mahaffey等[13]研究发现,NSTE-ACS患者在中位随访时间332 d时并发颅内出血的发生率是0.4%,其中33%为致命性,相关危险因素分析显示,高龄、既往脑卒中史、高收缩压、3联抗栓药物联用为其独立预测因子。另有研究指出,肾功能不全,包括透析患者应用阿司匹林、氯吡格雷、华法林、肝素等抗栓药物时,这些药物半衰期延长、清除率减低,使临床中出血事件增多[14,15]。本研究中21例发生出血性卒中,发生率为0.2%,病死率高达42.9%(n=9),其中76.2%的患者合并高血压病史,19%的患者合并既往脑卒中史,与国外研究结果相近。
GRACE研究表明[1],住院期间合并脑卒中是住院期间病死率的独立预测因子(OR=8.3,95%CI 6.2~-11.4)。Segev等[16]研究也发现,NSTE-ACS患者住院期间发生的脑卒中是住院期间以及1年随访期间全因死亡及心肌梗死的独立危险因素(OR 5.50, 95%CI 1.94~15.60, P=0.001 4)。本研究结果显示,在真实世界中冠心病患者PCI术后2年随访期间,脑卒中总体发生率是1.35%,总体病死率达9%,明显高于未发生脑卒中的PCI患者(9%比1.1%, P<0.000 1)。2年随访期间发生脑卒中是全因死亡的独立危险因素,但并未证实与心源性死亡及心肌梗死相关。针对PCI术后卒中发生的时间分析发现,85.5%的患者脑卒中发生在PCI术后半年到2年的随访期间。因此,深入研究分析PCI术后发生脑卒中患者的临床介入特征、相关危险因素和高发时间,将有利于识别卒中发生的高危人群,进而为卒中的预防治疗奠定重要的基础。通过积极控制临床高危因素,可能有助于降低住院期间脑卒中的发生率,也有利于减少PCI术后的远期卒中发生风险和死亡风险。
本研究的局限性:(1)本研究为单中心、观察性研究,入选患者的心肾功能较好,主要不良心血管事件的发生率偏低,整体人群低危,存在一定的选择偏倚。因此本文的结论尚待大型前瞻、多中心研究进一步证实。(2)本研究所入选的患者中,对于既往有卒中病史的患者,主要依据既往检查资料和患者主诉,因患者来自全国各地,部分患者既往卒中病史较长,故难以获取较为详尽的影像资料,也难以进行详细的卒中病因分析。本研究凡既往有脑卒中病史者,均行头颅CT或核磁共振评估。既往脑卒中病史(主要指缺血性脑卒中)3个月以上的患者,目前认为并非PCI手术禁忌证,若3个月以内的患者,请外院神经内科会诊,决定是否适宜PCI治疗。因此,纳入本研究的既往有脑卒中病史的患者,均有行PCI手术的适应证。(3)本研究随访期间脑卒中诊断主要来源于电话或书信获得,脑卒中是由当地神经科医师确诊的脑梗死或脑出血。部分患者由我院门诊随诊或再次入院时确定,另有部分患者缺乏影像学资料,在未来的研究中我们拟通过微信公众号获取更为详尽可靠的书面随访资料。































