
Rex手术(肠系膜上静脉与门静脉左支矢状部搭桥分流手术)是治疗肝外门静脉海绵变导致门静脉高压的最流行术式,但是有大约14%的患者合并有门静脉矢状部闭锁或发育不良不能行此分流手术,并且此手术后的失败率在4%~28%,这限制了这种符合生理性分流手术的应用。本研究的目的是探索向肝内门静脉右支分流建立恢复门静脉血流的新途径。
2015年11月至2016年6月,对4例门静脉海绵样变性行Rex分流手术后门脉高压复发患儿行门静脉右支分流手术。患儿年龄3.5~8.9岁,平均6.1岁,分别于1.1~2.5年前在我院行Rex手术,其中采用扩张的胃冠状静脉与肝内门静脉矢状部搭桥3例,扩张的门静脉主干分支与肝内门静脉矢状部搭桥1例,术后再发出血和脾功能亢进,经保守治疗无效。术前影像学检查提示:食管胃底静脉曲张,门静脉海绵样变存在;原搭桥血管显示不清,肝内门静脉血流少;脾脏增大。手术采用原上腹肋缘下横切口,首先游离肝门的了解原搭桥血管的形态;然后将胆囊从胆囊床上游离;在右侧肝门的后方切开Glisson氏鞘,显露门静脉右支,将其游离足够的长度;然后切开肝十二指肠韧带,游离扩张门静脉主干足够的长度;根据肝内门静脉右支至肝外门静脉主干之间的距离,截取肠系膜下静脉作为搭桥血管:血管壁外观正常,直径≥5 mm;以7-0 Prolene线将间置静脉的近心端和远心端分别与门静脉右支和肝外门静脉的主干行端侧吻合。术后1个月、3个月及6个月定期随访。
4例患儿中3例门静脉右支发育好、通畅,直径5~6 mm,成功实施门静脉右支搭桥手术;另外1例门静脉右支纤细放弃搭桥。手术时间2.3 h(1.9~3.5 h),术中出血约50 ml(30~80 ml),无一例需要输血。取肠系膜下静脉间置3例;搭桥后门静脉的平均压力由33 cmH2O(26~45 cmH2O)下降至18.7 cmH2O(14~24 cmH2O)。术中发现肝内门静脉右支与左支延续相通,而与肝外门静脉主干中断不通;Glisson鞘内沿着胆管周围大量增生的小静脉;原搭桥血管呈条索状,一致性狭窄或闭锁。术后随访6~18个月,无患儿再出现呕血,影像学检查分流血管增粗通畅,肝内门静脉增粗,门静脉海绵样改变消失,肝功能各项指标正常;血小板、红细胞血红蛋白、白细胞正常。
门静脉主干与肝内门静脉右支分流是治疗肝外型门静脉高压的有效新方法,适用于门静脉左支发育不良或Rex手术失败的病例,目前该方法尚未见文献报告。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肠系膜上静脉-门静脉左主支搭桥分流手术(Rex手术)由de Ville de Goyet等1992年首先报告[1],用于治疗肝脏移植后门静脉主干血栓患者获得成功,此手术很快被应用于门静脉海绵变的治疗,显示出具有恢复门静脉正常血流,避免门体分流术后肝性脑病、肠病等并发症等优点,目前被认为是治疗肝外门静脉海绵变导致门静脉高压去除病因符合生理的理想术式。但是有大约14%的患者合并有门静脉矢状部闭锁或发育不良不能行此分流手术;并且此手术后的失败率在4%~28%[2],这些问题限制了这种符合生理性分流手术的应用。本研究的目的是探索向肝内门静脉右支分流建立恢复门静脉血流的可行性。
2015年11月至2016年12月,对4例门静脉海绵样变性行Rex分流手术后门静脉高压复发患儿试图行门静脉右支分流手术。患儿年龄3.5~8.9岁,平均6.1岁,分别于1.1~2.5年前在我院行Rex手术,其中采用扩张的胃冠状静脉与肝内门静脉矢状部搭桥,术后再发复发出血和脾功能亢进。保守治疗包括内科药物和食管胃底静脉硬化或结扎,仍然不能有效控制消化道出血。术前Doppler和CT血管成像检查提示:食管胃底静脉曲张,门静脉海绵样变存在;原搭桥血管显示不清,肝内门静脉血流少,不能确切显示肝内门静脉血管是否开放;脾脏增大。
患儿仰卧位,原上腹肋缘下切口;稍微分离切口下粘连;行小肠系膜静脉的二级血管穿刺置管,测压和造影检查,了解门静脉的病变情况;将肝脏的镰状韧带和右侧三角韧带游离;游离肝门的了解原搭桥血管的形态;将胆囊从胆囊床上游离,保留胆囊血管和胆囊壁完好无损;沿着门静脉右支的走行方向劈开Gallison鞘,在其后方找到门静脉的右支,沿着静脉壁向左右游离,至少2 cm长度(图1),必要时沿着门静脉右支的表面将肝裂劈开以延长静脉的游离长度;穿刺门静脉,测压和造影;切开肝十二指肠韧带外侧壁表面的腹膜,在其内找到梗阻近端粗大门静脉的主干,游离静脉的前壁放置血管侧壁阻断钳。根据测量门静脉主干至肝门静脉右支之间的距离,截取肠系膜下静脉,其直径要在5 mm以上。首先用侧壁钳阻断门静脉右支的前壁,根据搭桥血管的直径纵行切开静脉壁,将搭桥血管的向心端与门静脉右支端侧吻合;然后将搭桥血管的远心端与门静脉主干的侧壁端侧吻合,吻合均采用7-0 prolene线间断缝合(图2)。吻合后做门静脉的测压和造影,术中超声了解搭桥血管的通畅情况。
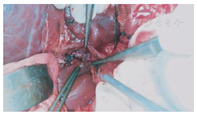

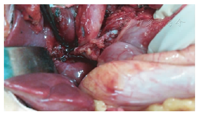

术后每天血常规,肝功能,超声检查搭桥血管通畅、肝内供血及肝脏和脾脏体积变化;术后1个月、3个月、半年复查以上结果。将脾功能亢进缓解,消化道无再出血和影像学检查搭桥血管通畅,海绵样变消失和肝内门静脉增粗作为手术成功标准。
采用SSPS软件进行数据的统计学处理,以P<0.05作为差异有统计学意义。
4例患儿中3例门静脉右支发育好、通畅,直径5~6 mm,成功实施门静脉右支搭桥手术;另外1例门静脉右支纤细放弃搭桥。手术时间2.3 h(1.9~3.5 h),术中出血约50 ml(30~80 ml),无需要输血者。取肠系膜下静脉间置3例(表1)。
门静脉右支分流患儿手术时的一般情况
门静脉右支分流患儿手术时的一般情况
| 病例编号 | 年龄(岁) | 与初次手术间隔(年) | 初次搭桥血管选择 | 肠系膜上静脉压力(cmH2O) | 门静脉右支压力(cmH2O) | 门静脉右支直径(mm) | 实施手术 | 本次搭桥血管选择 | 搭桥血管长度(cm) | 搭桥血管直径(mm) | 搭桥后肠系膜上静脉压力(cmH2O) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 6.1 | 1.1 | 冠状静脉 | 45 | 10 | 5 | 门-门右支分流 | 肠系膜下静脉 | 10 | 6 | 24 |
| 2 | 8.9 | 2.5 | 冠状静脉 | 26 | 10 | 6 | 门-门右支分流 | 肠系膜下静脉 | 5 | 6 | 18 |
| 3 | 3.5 | 1.2 | 冠状静脉 | 28 | 8 | 6 | 门-门右支分流 | 肠系膜下静脉 | 5 | 5 | 14 |
4例复发患儿均表现为上消化道再发呕血或黑便,3例有脾大、脾功能亢进表现;超声或增强CT扫描显示,搭桥血管显示不清,肝内门静脉血流不好,门静脉海绵变改变仍然存在;术中探查见搭桥血管均变细呈索条样外观,内腔闭锁或狭窄。
术中探查显示,4例患儿中3例肝内门静脉右支开放,血管壁条件完好,直径5~6 mm,内膜光滑,无血栓及异物。其内血流压力8~10 cmH2O(1 cmH2O=0.098 kPa)。所有病例门静脉右支与门静脉左支延续汇合,但是与肝十二指肠内门静脉主干中断,之间为疏松纤维结缔组织,与肝外门静脉主干不连接,沿着胆管大量增生的壁薄小静脉。肝十二指肠韧带内的脂肪结缔组织增生,其内有大量增生的细小血管;通过造影门静脉梗阻近端为单一主干者3例;分成2个分支者1例,所有梗阻近端的门静脉均扭曲扩张;对肝十二指肠韧带的分离解剖显示,粗大血管壁与周围组织粘连紧密;胆总管和肝动脉被推挤异位;肝十二指肠韧带内的静脉增生,侧支循环丰富,压力高,开口于门静脉主干;韧带内的结缔组织水肿,增生致密。
搭桥血管取自肠系膜下静脉,本组患儿血管增粗,肠系膜下静脉较长,可取血管长度5~10 cm,直径5~6 mm。
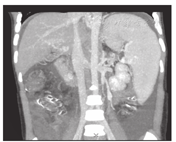
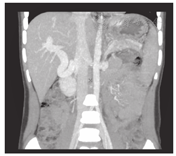
搭桥后血流通畅情况,搭桥前门静脉的平均压力33 cmH2O (26~45 cmH2O),搭桥后门静脉压力下降至18.7 cmH2O(14~24 cmH2O)。肝脏膨胀,脾脏背膜皱缩,游离创面渗血减少。静脉造影显示,分流后肝内门静脉右支及其分支灌注显影,达到肝脏实质边缘。患儿随访6个月至1.5年,超声及增强CT显示所有患儿的搭桥分流血管开放通畅,门静脉海绵变消失,肝体积增大(图3、图4),无消化道出血复发,脾功能亢进症状消失,血小板、白细胞和血红蛋白在正常水平。上消化道造影显示食管静脉曲张明显减轻。


目前尚未见本文所描述的采用门静脉主干与门静脉右支搭桥分流治疗门静脉海绵变的文献报告。de Ville de Goyet等[1]首次提出颈内静脉间置肠系膜上静脉与门静脉左支的搭桥分流手术恢复向肝内门静脉血流,因为它是针对病因治疗,被认为是门静脉海绵变治疗的里程碑。其后许多学者提出了改良术式,如采用扩张的胃冠状静脉与门静脉左支矢状部的转流分流术式[3]、脾静脉与门静脉矢状部的转流术式[4,5]、截取肠系膜下静脉或小肠静脉进行门静脉主干与矢状部的搭桥分流术式[6,7,8],获得了良好的结果。以上术式的血流入肝途径均通过门静脉左支的矢状部,其优点是该血管表浅,容易暴露,在门静脉海绵变中,门静脉主干梗阻,肝内门静脉矢状部90%左右开放,并且具有年龄小血管开放率高的趋势。但是不足之处是门静脉左支也存在发育不良改变,血管的口径比正常细小,血管吻合困难,术后吻合口狭窄或闭锁造成门静脉高压复发消化道出血的发生率高达28%。从本组4例术中解剖显示,搭桥血管狭窄或闭塞导致血流不畅是Rex手术失败的原因。从术中解剖情况看是整个血管变成索条闭塞,可能是血管条件不好整个闭塞,也可能是吻合口梗阻在先,血流中断后,整个血管闭塞。
4例患儿中3例门静脉右支通畅,1例合并术后肝内门静脉右支闭锁。本例门静脉右支梗阻的患儿初次手术中发现门静脉左支是开放的,所以行门静脉左支的分流手术。术后门静脉右支梗阻原因有可能是血栓形成,造成肝内门静脉左支和右支均梗阻,也可能是当时门静脉右支就存在发育不良。术前因为肝内门静脉血流不足,充盈差,超声和血管显像很难准确显示是否存在,目前普遍的观点认为术中探查能明确肝内门静脉是否开放。
既往对Rex手术失败的患者主张行门体分流[9,10,11],如Warren分流手术或门腔静脉分流手术等,降低门静脉压力减少出血风险,但是肝脏仍然处于缺血状态,会直接导致凝血机制异常、肝脏萎缩、胆汁淤积、腹水、肝功能异常,甚至会造成肝性脑病、肺动脉高压、肠病等。之前我们对Rex手术失败的患儿做二次Rex手术,术中看门静脉左支仍然开放的不多,即使再次搭桥吻合,成功率也不高。所以放弃了再次Rex窝搭桥。
本研究结果显示,门静脉左支分流失败的4例患儿中,3例门静脉的右支开放通畅,并且血管条件好,分流效果好,可以作为恢复门静脉血流的另一个途径;而在脐静脉插管和脐炎相关的门静脉梗阻患儿,门静脉矢状部及左支受累的可能性更大,门静脉右支搭桥可能是唯一途径。此术式的优势是正常情况下门静脉右支粗大,血流占门静脉总血流量的60%~70%以上,血管口径较左支宽大,有利于入肝血流通过;不足是门静脉右支位于肝右动脉和右肝管的后方,位置深;肝实质外的部分较左支短,这样增加了血管暴露和吻合的困难。术中将肝脏右叶游离,将胆囊从肝脏表面分离,以充分暴露右半肝门。因为门静脉海绵变肝内门静脉处于瘪陷状态,静脉直接穿刺造影或超声检查不能准确显示门静脉是否开放,术中直接解剖探查是了解血管的最可靠方法。右支搭桥比左支难得多,因为右支比左支深,暴露困难,吻合困难;另外右支周围有丰富的海绵样变的侧支增生血管,很容易造成大出血。将右肝充分游离,从后路游离可以减少出血和对胆管损伤的风险[12]。
本研究通过肝门部的精细解剖研究首次发现,门静脉海绵变的患儿,左右门静脉均有汇合,但是与门静脉主干中断,之间为少量的疏松结题组织充填,而未见血管壁延续。本研究结果支持先天性门静脉海绵样变由胚胎早期肝内门静脉与肝外门静脉融合时出现障碍,从而导致门静脉入肝血流不能直接流入肝内门静脉系统,导致肝脏供血不足,肝脏萎缩,胆汁淤积等改变。不支持门静脉海绵变是由门静脉血栓或空化不全所致的观点。
本研究通过门静脉直接造影显示,梗阻近端的门静脉主干1支3例,2支1例,提示门静脉梗阻由先天发育异常所致。门静脉主干梗阻,进肝血流受阻形成了门静脉高压。Glisson鞘内结缔组织中,特别是胆管周围有大量侧支循环增生静脉,部分代偿门静脉主干梗阻入肝血流的途径,形成影像学检查所见的"海绵样"改变。增生的静脉曲屈,口径粗细不均,壁薄,术后随访中发现"海绵样"侧支循环消失,可见搭桥分流成功后由于门静脉压力下降,增生的静脉发生塌陷萎缩,血流消失。选择肠系膜下静脉或小肠静脉,在组织结构上与门静脉相近,静脉壁各层组织完整,内膜光滑,保障搭桥后的血流灌注;术后随访显示,间置的静脉口径逐渐增大,达到正常同龄儿童相近的直径。为了避免术后搭桥血管灌注不足发生狭窄闭塞,导致手术失败,搭桥的近端要选择梗阻近端的门静脉主干作为搭桥血管的吻合点,不可选择在增生扩张的分支。
本研究表明门静脉主干与门静脉右支搭桥分流手术是安全可行的,可以有效地恢复门静脉海绵变患儿入肝血流,去除其病因。此技术特殊优势是适用于门静脉左支闭锁不能行Rex分流或Rex分流后失败的病例,扩大了向肝内分流手术的适应证。但是只要是血管搭桥手术一定存在血栓和狭窄问题,门静脉左支出现的,右支同样会出现。但是理论上来讲,门静脉右支比左支粗,左支搭桥失败的患者,右支受累的可能性比左支要小,本研究显示门静脉右支分流的3例患儿均成功,疗效由于左支。本研究病例尚少随访时间尚短,远期效果有待于进一步长期随访观察。
无



























