
脓毒症心肌病是由脓毒症导致的可逆性心肌功能障碍,严重者可合并心源性休克,药物治疗效果差,急性期病死率高。南方医科大学顺德医院重症医学科(ICU)收治了1例脓毒症心肌病合并心源性休克患者,该患者女性,37岁,因"反复发热5 d,胸闷、腹痛3 d"入院;同时存在严重心肌抑制、腹部感染,可以用脓毒症心肌病"一元论"解释两组征象。患者心源性休克严重,经积极抗感染、血流动力治疗,病情无好转,给予体外膜肺氧合(ECMO)支持后,顺利渡过循环衰竭期转出ICU;转出后腹主动脉CT血管造影术(CTA)、肠镜均提示回肠病变,最后手术明确回肠憩室感染并出血,行回肠憩室切除,术后好转出院。通过介绍该病例治疗的成功经验,旨在提高对脓毒症心肌病的诊断,以及对ECMO在心源性休克治疗中的作用认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脓毒症心肌病是指由脓毒症导致的心肌功能抑制,而未出现心肌结构改变,血流动力学表现为心排血量降低[1,2],其主要特点为可逆性双心室扩大,可逆性射血分数下降,液体复苏的反应性降低及心脏对儿茶酚胺的敏感性减弱等[3]。国外研究显示,脓毒症心肌病的发生率为40%~60%,急性期死亡风险高达70%[4,5],但一旦渡过危险期,心功能多在7~10 d恢复正常,长期预后良好[2,6]。国外有报道应用体外膜肺氧合(ECMO)治疗脓毒症心肌病的案例[7,8],但在国内鲜见相关报道。本院应用ECMO成功救治1例脓毒症心肌病合并心源性休克患者,现报告如下。
患者女性,37岁,既往体健,因"反复发热5 d,胸闷、腹痛3 d"入本院冠心病重症医学科(CCU)。患者于5 d前无明显诱因出现间断性发热,热峰38.0 ℃,无流涕、鼻塞、咳嗽、咳痰,3 d前出现胸前区闷胀感,无向他处放射,伴四肢阙冷,出冷汗,伴右下腹痛,多次排黑色稀样便。
入院查体:体温38.5 ℃,脉搏100次/min,呼吸频率20次/min,血压85/59 mmHg(无升压药物支持,1 mmHg=0.133 kPa);意识清,精神疲倦;双肺呼吸音粗,双下肺闻及较多粗湿啰音;心界无扩大,心率100次/min,律齐,各瓣膜听诊区未闻及病理性杂音;腹平软,右下腹压痛,无反跳痛、肌紧张,肝脾肋下未触及。
辅助检查:血常规:白细胞计数(WBC)14.0×109/L,血小板计数(PLT)260×109/L,血红蛋白(HGB)114 g/L;降钙素原(PCT)0.73 μg/L;动脉血气分析:pH值7.24,二氧化碳分压(PCO2)23.4 mmHg,氧分压(PO2)69.6 mmHg,剩余碱(BE)-9.7 mmol/L;乳酸(Lac)8.6 mmol/L;肾功能:血肌酐(SCr)167 μmol/L;肝功能:丙氨酸转氨酶(ALT)695 U/L,天冬氨酸转氨酶(AST)1 135 U/L;心功能:肌酸激酶(CK)353 U/L,肌酸激酶同工酶(CK-MB)33.9 U/L;N末端B型钠尿肽前体(NT-proBNP)>9 000 ng/L,心肌肌钙蛋白I(cTnI)1.2 μg/L。多次监测心电图:窦性心动过速,肢体导联、胸导联(V4~V6)低电压,未见动态性ST-T改变及病理性Q波。心脏彩超:左心房(LA)24 mm,肺动脉内径(PA)22 mm,右心房(RA)42 mm,右心室(RV)40 mm,左室舒张期末内径(LVDd)45 mm,左室收缩期末内径(LVDs)35 mm,室间隔 (IVS)8.2 mm,左室后壁(LVPW)8.0 mm,左室短轴缩短分数(FS)0.23,左室射血分数(LVEF)0.47,心内未探及异常血流信号,提示左室收缩功能不全。胸片示:双肺呈对称性向心性渗出,心影增大,符合肺水肿改变。上腹部平扫CT示:腹腔积液。
入院诊断:① 急性暴发型心肌炎?② 心源性休克;③ 急性肾损伤(AKI);④ 急性肝功能不全。
入院后予以无创机械通气、强心、升压、丙种球蛋白冲击、激素抗炎(第3~7天甲泼尼龙80 mg/d)治疗。入院当天休克加重,予以气管插管接呼吸机支持,并转入重症医学科(ICU)。转入后予以去甲肾上腺素升压,置入漂浮导管示低心排〔心排血指数(CI)21.67 mL·s-1·m-2,中心静脉压(CVP)17 mmHg,肺动脉楔压20 mmHg,肺动脉压24 mmHg,中心静脉血氧饱和度(ScvO2)0.60〕,符合心源性休克表现。在漂浮导管指导下,加用多巴酚丁胺(5 μg·kg-1·min-2)强心、利尿。转入后查体:右下腹痛,并出现持续高热,呈稽留热型,热峰39.5 ℃,感染指标明显升高,WBC 15.7×109/L,PCT 13.00 μg/L,C-反应蛋白(CRP)>200 mg/L,用"暴发型心肌炎"一元论难以解释病情全貌,考虑感染灶未明确,暂予以抗感染治疗(帕尼培南倍他米隆1 g、12 h 1次,联合万古霉素1 g、12 h 1次)。
第2天病情曾一度好转,心源性休克有所好转,血压105/60 mmHg(去甲肾上腺素减至0.38 μg·kg-1·min-1),CI升至41.68 mL·s-1·m-2(多巴酚丁胺5 μg·kg-1·min-1维持下),Lac降至2.6 mmol/L,ScvO2升至0.68;感染指标好转,热峰降至38.2 ℃,WBC 11.2×109/L,PCT 5.70 μg/L。
但第3天早上出现感染加重,热峰升至40.5 ℃,WBC 19.4×109/L,PCT 7.70 μg/L;晚上监测漂浮导管,提示心源性休克加重(CI降至26.67 mL·s-1·m-2,CVP 18 mmHg,肺动脉压28 mmHg),科内彩超提示全心弥漫性波动减弱(LVEF约0.30),Lac>15.0 mmol/L,伴难治性室性心动过速(室速),排除漂浮导管位置异常、电解质紊乱等诱因,予以胺碘酮、利多卡因、电复律效果仍差,考虑心源性休克合并难治性室速,经常规药物治疗不佳,有ECMO支持指征。
第4天早上,在彩超引导下经皮穿刺股动静脉,置入ECMO导管(动脉导管15F,静脉导管21F)。在静脉-动脉(V-A)ECMO支持下(转速3 760 r/min,血流量3.68 L/min,气流量4 L/min,吸入氧浓度1.00),停用强心药物,下调并停用升压药物,Lac逐渐下降,膜前中心静脉血氧饱和度(ScvO2)维持在0.71~0.86,心电稳定趋于好转,未再出现室速。由于先有感染指标恶化,然后是心源性休克加重,考虑感染打击,加重脓毒症心肌抑制,在ECMO支持同时,调整抗感染方案,停用帕尼培南倍他米隆,改用美罗培南,加强覆革兰阴性(G-)杆菌效能,继续联合万古霉素覆盖革兰阳性(G+)球菌,循环及感染指标逐渐好转(感染指标及抗感染方案见图1),逐渐下调ECMO参数。撤机前2 h,下调ECMO转速至1 985 r/min、血流量1.0 L/min,气流量2 L/min,FiO2 0.60,膜前ScvO2 0.75,Lac 1.0 mmol/L;复查心电图为窦性心律,血压维持在115~125/55~65 mmHg,心脏彩超提示LVEF恢复至0.52,达到撤机标准。
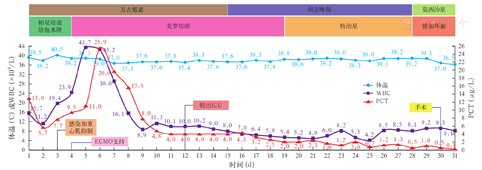

注:WBC为白细胞计数,PCT为降钙素原,ECMO为体外膜肺氧合,ICU为重症医学科
经ECMO支持77 h,于第7天成功撤离ECMO,第12天转出ICU继续治疗。转出时体温37.4 ℃,WBC 10.0×109/L,PCT 4.00 μg/L;复查心电图示:窦性心律(心率90次/min),V4~V6导联T波倒置;心脏彩超:LA 26 mm,PA 22 mm,RA 43 mm,RV 40 mm,LVDd 46 mm,LVDs 30 mm,IVS 8.2 mm,LVPW 8.0 mm,FS 0.34,LVEF 0.64,提示二尖瓣少量反流。
转出ICU后,患者仍有右下腹痛,伴腹泻、便血,间断发热,调整抗感染方案、抑酸、止泻、止痛治疗,效果欠佳(感染指标及抗感染方案见图1),但监测WBC恢复正常,而PCT维持在较低水平。有剖腹探查指征,但由于麻醉科、普外科医生担心麻醉及手术风险,建议继续药物保守治疗。
第27天完善腹主动脉CT血管造影术(CTA):右下腹回肠远端肠壁肿胀,周围血管增多增粗,考虑炎症性改变,下腹部及盆腔肠系膜少量渗出灶伴积液。
第28天肠镜提示小肠出血。完善术前准备。
第30天行腹腔镜探查,术中见距回盲部约110 cm处回肠呈憩室样改变,局部明显扩张(长6 cm、直径5 cm),予以回肠部分切除术,术后病理:送检小肠憩室见慢性溃疡,炎性肉芽组织增生伴活动性炎症,小肠系膜淋巴结见淋巴组织反应性增生。术后诊断:回肠憩室感染并出血。术后未再出现发热、腹痛,感染指标明显好转。术后1周,病情好转出院。


Parker等[9]在1984年使用放射性核素心脏造影术测量感染性休克患者LVEF、心排血量,发现50%的患者存在左心室收缩功能障碍,并首次提出脓毒症心肌病的概念。目前认为脓毒症心肌病是多因素、多通路参与的结果,功能性变化在心肌抑制中起到主导作用,但具体机制目前尚未完全阐明。其诊断标准亦尚未明确,目前多数临床研究以严重脓毒症导致的低心排或者被心脏彩超所证实的心肌功能障碍[10,11]作为诊断标准,而漂浮导管和心脏彩超作为重要的诊断工具[1]。
回顾该患者的病情发展特点、诊治经过,我们倾向于用脓毒症心肌病一元论作为原发病的诊断。首先,该患者为37岁女性,急性起病,病程短,病情进展迅速;同时存在两组主要临床征象:① 严重心肌抑制:以心源性休克为首发表现,心肌损伤标志物升高(cTnI 1.2 μg/L,CK-MB 33.9 U/L),科内彩超提示全心弥漫性波动减弱,漂浮导管提示低心排(21.67 mL·s-1·m-2);② 腹部感染:主诉包括腹痛、发热,查体提示右下腹压痛,入院后出现持续高热,热峰为40.5 ℃,感染指标明显升高,WBC峰值43.7×109/L,PCT峰值25.90 μg/L,腹部CTA、肠镜均提示回肠病变,最后手术明确回肠憩室感染并出血。其次,感染指标恶化与心源性休克加重时间窗一致。转入时考虑存在感染、心源性休克两组征象,在漂浮导管指导下,予以强心、利尿、升压的同时,予以帕尼培南倍他米隆+万古霉素经验性抗感染;第2天感染指标好转伴随心脏功能好转;但在第3天早上感染指标再次恶化,晚上出现心肌抑制加重,表现为心源性休克伴难治性室速;在ECMO支持的同时,积极调整抗感染方案,加强覆盖G-杆菌后感染指标再次好转,随心肌抑制缓解,心源性休克好转;转出ICU后,患者感染灶虽未得到清除,仍有间断发热,但在抗菌药物的干预下,WBC降至正常,PCT在低水平徘徊,提示炎症反应得到抑制。所以我们倾向用脓毒症心肌病这一元论解释病情全貌:回肠憩室为该次起病的"元凶" ,由于回肠憩室合并出血、感染,感染灶持续释放炎性因子入血,而早期抗感染药物效果欠佳,导致脓毒症心肌病未得到控制,并发心源性休克,经有效调整抗感染方案,控制炎症反应,从而有效缓解心肌抑制。


脓毒症心肌病在脓毒性休克患者中普遍存在,其本质是心肌细胞内在功能下降[12]。有关脓毒症心肌病发病机制,早期认为脓毒症可造成心肌缺血、甚至心肌坏死,但研究表明,脓毒症时冠状动脉(冠脉)血流增加且心肌氧耗减少[13,14]。目前认为功能性变化在脓毒症性心功能障碍中起到主导作用,但具体发生机制尚未完全阐明。研究表明,心肌抑制因子包括肿瘤坏死因子-α(TNF-α)、白细胞介素(IL-1、IL-6)、溶菌酶C、内皮素-1(EF-1)可诱导心肌损伤[15,16,17]。炎症反应的异常激活,包括Toll样受体(TLR)的激活、一氧化氮(NO)和一氧化氮合酶(NOS)过量表达,补体的激活,在心肌抑制中起到重要作用[18]。另外,线粒体功能失调、心肌细胞钙平衡紊乱和细胞凋亡加速也参与了心肌抑制的过程[13,19]。在对脓毒症性心功能障碍发生机制进行基础研究的同时,目前有关的临床试验也是研究热点。
至于在原发病诊断方面,该患者同时存在严重心肌抑制、腹部感染征象。部分专家同意一元论解释,即回肠憩室感染,由于感染灶血运丰富,持续释放心肌抑制因子、异常激活炎症反应,导致脓毒症心肌病、心源性休克;而部分专家倾向用二元论解释病情,认为早期病情符合暴发型心肌炎表现,由于心源性休克打击,胃肠道供血不足,在原有回肠憩室基础上合并感染、出血,从而表现为腹痛、感染指标升高。但该患者无急性上呼吸道感染或急性胃肠炎等病毒感染的前驱症状,且转入ICU后经药物治疗心源性休克曾一度好转,在第3天再次加重,不太符合暴发型心肌炎一旦起病即呈急剧恶化的一般规律;另外,心肌酶学指标CK-MB、cTnI无持续升高的表现,与心肌炎的特点不符合。所以本人更倾向于脓毒症心肌病一元论解释,结合患者病史、体征,以及整个治疗过程的演变特点,在排除其他感染灶的前提下,考虑回肠憩室为原发感染灶。
近年来ECMO的临床适应证不断扩展,适用于各种原因引起的严重心源性休克[20]。脓毒症心肌抑制呈可逆性改变,心功能多在7~10 d恢复正常,而其治疗方法无特异性。脓毒症心肌病治疗原则包括控制感染源、稳定血流动力状态,后者包括液体管理、使用正性肌力药物、缩血管药物[1]。研究提示中药对脓毒症心肌病也有一定保护作用[21]。患者在第3天晚上心源性休克加重伴难治性室速,同时存在泵功能衰竭以及严重电解质紊乱,经药物治疗无效,有ECMO支持指征。国内ECMO专家共识中指出ECMO支持的指征为[22]:对于不明原因的心源性休克,可考虑予以ECMO支持;当使用大量正性肌力药物效果不佳,血流动力学仍难以维持,CI<33.34 mL·s-1·m-2持续3 h以上,Lac进行性升高时,建议尽早予以ECMO支持,对于危重患者,时间就是生命,快速识别危重患者以及ECMO支持时机,尽早予以ECMO支持是提高危重患者抢救成功率的关键。Bréchot等[6]完成了一项应用ECMO治疗成人严重脓毒症心肌病的研究,该研究共纳入14例感染性休克合并严重心肌抑制,结果表明LVEF<0.25、CI<36.67 mL·s-1·m-2可作为脓毒症心肌病行ECMO支持的参考标准。
ECMO应用策略,早期应予以ECMO高流量支持,偿还氧债,并停用强心药物,逐步下调升压药物,减少血管活性药物诱发心律失常等副作用,为心脏的恢复赢得时机。该患者在第3天及时调整抗感染方案为万古霉素+美罗培南,经积极抗感染,热峰下降,WBC、PCT等感染指标明显好转,提示原发感染灶得到控制。经ECMO支持77 h,心脏功能逐渐恢复,逐步下调ECMO流量并成功撤机。该例患者心功能障碍加重与感染打击时间窗符合,好转的拐点亦与感染控制一致,并呈自愈性,临床诊断脓毒症心肌病。结合救治经过,我们认为对于脓毒症心肌病的治疗,首先应采取有效的抗感染药物控制感染,选择合适的方式清除感染灶,并在心脏彩超或者漂浮导管的监测下,优化容量管理及合理运用血管活性药物,若合并心源性休克,经积极药物治疗无效,可考虑应用ECMO渡过心功能衰竭期。


陈仲清主任医师(南方医科大学南方医院):该病例的诊治过程曾在省内重症会议中分享,在原发疾病的诊断方面引发了较激烈的讨论。该患者以心源性休克为首发表现,经传统药物治疗效果欠佳,转入ICU后休克加重并发难治性室速,有行机械循环辅助指征,及时给予ECMO支持后,患者渡过了心功能衰竭期,为原发病的诊治赢得了时机,是治疗过程中的亮点。



























