
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
研究早发糖尿病,对于理解胰岛β细胞生长增殖、胰岛素产生和胰岛素作用机制有重要作用。本研究在1例早发糖尿病先证者发现PAX4基因外显子5上G→A变异(R192H,杂合子);据报道该位点变异在泰国人群中引起糖尿病发病率明显增加,而在日本人群中对糖尿病发病无影响[1,2]。为了解该家系中PAX4 R192H变异是否为致病因素,对该患者家系作遗传分析。
先证者资料:14岁女性,因"发现血糖升高2年余"就诊,2年前患者发现血糖升高,无多饮、多食、多尿、口干等不适,测指尖血糖13.9 mmol/L,遂至当地医院查空腹血糖11.47 mmol/L、HbA1C 10.3%、胰岛细胞抗体(ICA)、胰岛素自身抗体(IAA)、谷氨酸脱羧酶抗体(GADAb)阴性,未予降糖药物及胰岛素治疗。患者出院后控制饮食、适当运动,平时自测空腹血糖7.0~8.0 mmol/L。1年前患者饮食控制不佳,后自觉口干、呼吸困难至当地医院就诊,查空腹血糖21.6 mmol/L、血酮体5.5 mmol/L、血气分析示pH 6.8、血钾3.2 mmol/L,考虑糖尿病酮症酸中毒,予以胰岛素小剂量静脉滴注后好转。
既往外院行口服葡萄糖耐量试验及胰岛素C肽释放试验,0 min血糖7.16 mmol/L,胰岛素0.5 mIU/L,C肽709.2 pmol/L;30 min血糖11.3 mmol/L,胰岛素15.4 mIU/L,C肽966.4 pmol/L;60 min血糖14.95 mmol/L,胰岛素27 mIU/L,C肽1 477 pmol/L;120 min血糖15.79 mmol/L,胰岛素26.5 mIU/L,C肽1 822 pmol/L;180 min血糖11.47 mmol/L,胰岛素28.5 mIU/L,C肽1 826 pmol/L。精氨酸刺激试验如下:0 min血糖6.69 mmol/L,胰岛素8.2 mIU/L,C肽715.9 pmol/L;2 min血糖6.21 mmol/L,胰岛素28.9 mIU/L,C肽1 147 pmol/L;4 min血糖6.57 mmol/L,胰岛素30.2 mIU/L,C肽1 260 pmol/L;6 min血糖6.52 mmol/L,胰岛素18.3 mIU/L,C肽1 112 pmol/L。
HLA基因检测:HLA-A 02;24,B 54;67,DR 09;14。
既往史:否认高血压、冠心病等。家族史:母亲、外婆、姨母、舅舅均为糖尿病,无听力减退。父系无糖尿病家族史。
入院体格检查:身高154.9 cm,体重54.9 kg,体重指数22.9 kg/m2,腰围90 cm,臀围98 cm。颈项部未见黑棘皮。血乳酸运动试验:0 min为2 mmol/L、运动15 min为4.24 mmol/L、休息后10 min为3.44 mmol/L。对糖尿病易感基因(包括ABCC8、GCK、HNF4A、KCNJ11、PDX1、SOD2、BLK、HFE、IL1RN、KLF11、PLAGL1、VEGFA、CEL、HNF1A、INS、NEUROD1、PON1、ZFP57、EPO、HNF1B、INSR、PAX4、SLC2A2基因)进行高通量测序,发现有PAX4基因外显子5上G→A变异(R192H,杂合子)。
搜集家系成员相关临床资料:年龄、空腹血糖、HbA1C。
家系成员PAX4基因R192H变异检测:抽取家系中先证者及其他所有成员外周血2 ml,EDTA抗凝,使用天根非离心柱试剂盒提取DNA。对PAX4基因外显子5基因片段进行PCR扩增(PCR仪型号:VeritiTM-96 well ABI),引物序列如下:上游引物为5′-CTGTGGGCAAAGGCTGAGAG-3′,下游引物为5′-GGCCCAGACTCTTCCTCCTTG-3′,产物片段长度为290 bp。扩增体系中为20 μl,其中含有2 μl 10×PCR缓冲液,2 mmol/L dNTPs,1.4 μl MgSO4,1.4 μl引物,KOD酶0.4 μl,1 μl DNA模板。PCR扩增反应条件:94℃预变性2 min,98℃变性10 s,62℃退火30 s,68℃延伸1 min,共35个循环,末端循环延伸10 min。
以限制性片段长度多态性聚合酶链反应技术(PCR-RFLP)检测变异:扩增产物NcoⅠ酶切反应(Thermo公司,NcoⅠ反应体系包括:1.0 μl NcoⅠ内切酶、10.0 μl DNA、2.0 μl限制性内切酶缓冲液,37℃水浴,30 min)。酶切后将所有酶切产物进行2.5%琼脂糖电泳(EPS300上海天能科技有限公司),电压110 mV,时间30 min。结束后在凝胶成像系统(Tanon-3500上海天能科技有限公司)紫外光成像观测结果。将家系成员PCR产物送至铂尚生物技术(上海)有限公司测序验证PCR-RFLP结果。
先证者诊断分析:患者为早发糖尿病,母系明确的三代遗传家族史,且发病时间逐代提前,患者发病时仅12岁,胰岛素水平正常、外院查ICA、IAA、GADAb阴性,1型糖尿病相关HLA易感位点基因检测为阴性,临床符合青少年发病的成人型糖尿病(MODY)临床诊断。基因分析检测到PAX4外显子5上G→A杂合变异,使得精氨酸变为组氨酸(Arg 192 His)。
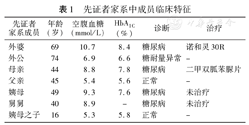
先证者家系中成员临床特征
先证者家系中成员临床特征
| 先证者家系成员 | 年龄(岁) | 空腹血糖(mmol/L) | HbA1C(%) | 诊断 | 治疗 |
|---|---|---|---|---|---|
| 外婆 | 69 | 10.7 | 8.4 | 糖尿病 | 诺和灵30R |
| 外公 | 74 | 6.9 | 6.6 | 糖耐量异常 | - |
| 母亲 | 44 | 8.8 | 7.8 | 糖尿病 | 二甲双胍苯脲片 |
| 父亲 | 45 | 5.4 | 5.6 | 正常 | - |
| 姨母 | 49 | 9.3 | 7.6 | 糖尿病 | 未治疗 |
| 舅舅 | 40 | 8.9 | - | 糖尿病 | 未治疗 |
| 姨母之子 | 16 | 5.3 | 5.8 | 正常 | - |

注:MODY:青少年发病的成人型糖尿病
对家系成员PCR-RFLP结果:包括对外公、外婆、母亲、母亲姐姐(姨母)、姨母之子提取DNA,进行PCR-RFLP检测,均未见被酶切的条带,无PAX4外显子5上R192H变异。而血糖水平正常的父亲,被限制性内切酶切开成为三条条带,考虑父亲存在PAX4基因外显子5 R192H变异,且为杂合子,PCR-RFLP结果见图2。
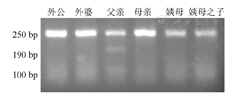

注:MODY:青少年发病的成人型糖尿病;PCR-RFLP:限制性片段长度多态性聚合酶链反应技术
基因检测及验证:为进一步验证PCR-PFLP结果,将家系成员PCR产物直接测序,未被限制性内切酶NcoⅠ切开的成员(包括外婆、外公、母亲、姨母、姨母之子)测序结果显示无R192H变异;而父亲(能被NcoⅠ酶切开)测序结果显示为第5外显子G/A杂合变异导致R192H变异,证实PCR-RFLP结果准确可靠,提示患者基因变异来自父亲遗传而并非母亲(图3)。
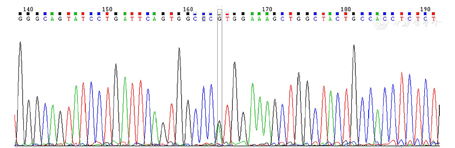

注:MODY:青少年发病的成人型糖尿病
MODY为糖尿病单基因遗传疾病,以常染色体显性遗传、非酮症糖尿病及早发为主要临床特征。根据Joslin《糖尿病学》中描述MDOY主要临床特征[3]:(1)早发非胰岛素依赖性糖尿病;(2)家族三代或以上发病,呈常染色体显性遗传,且发病年龄逐渐提前;(3)β细胞功能障碍而无胰岛素抵抗;瘦体型。本研究通过对临床特征表现为MODY先证者进行高通量测序,通过已知与糖尿病相关基因芯片测序,获得该先证者基因序列,从而检测到该先证者存在PAX4基因位点第5位外显子R192H变异,导致192位组氨酸替代精氨酸,从而发生相应功能改变。
PAX4在胰岛素细胞胚胎时期发育、分化过程均发挥重要作用[4],β和δ细胞生长受PAX4表达影响。Cheung等[5]研究发现,鼠胰岛细胞中过度表达PAX4基因能激活cmy/id2细胞增殖信号转导通路,并且使抗凋亡基因bcl-xl(Bcl-2家族)上调,而bcl-xl促进c-myc(myc基因家族重要成员之一,可使细胞增殖并促进细胞分裂,并与肿瘤发生发展相关)表达,最后导致胰岛β细胞增殖。同时发现纯合子PAX4变异小鼠生长较迟缓,并在3天内死亡,小鼠体内几乎不含成熟β细胞。尽管PAX4在成人胰腺β细胞中表达较少,但据观察成熟β细胞PAX4功能仍较强,PAX4发挥保护β细胞免于细胞因子(如白细胞介素-1β)损害。瑞士及德国人群研究发现PAX4基因中P321H多态性与1型糖尿病相关[6],该多态性转录抑制活性在小鼠胰岛素启动子βTC3细胞中降低,并导致β细胞增殖受损。因此认为,PAX4基因在成熟β细胞增殖及生长极为重要[7]。该假设在其他关于PAX4不同类型变异报道中得以证实,例如R121W、R133W和R164W,分别发生在日本糖尿病人群、西非人群及泰国人群中[1,8,9]。
目前也有一些关于PAX4 R192H变异研究报道,认为PAX4 R192H变异可能通过以下机制导致糖尿病风险增加[10]。首先PAX4 R192H转录活性受抑制,可能影响β细胞在发育过程中分化及成熟,造成β细胞大量减少;其次可能损害β细胞在成人胰腺中增殖;最后可能影响α细胞构造,如同PAX4杂合子敲除小鼠,其胰腺α细胞受到损害[11]。R192H变异可能导致胰岛素/胰升糖素比降低,导致糖异生和糖酵解作用异常,使血糖介导胰岛素分泌调节受损[12],而且胰腺β细胞减少及β细胞增殖受损是促进糖尿病进展的易感因素[13]。Kooptiwut等[14]研究报道PAX4 R192H变异与早发单基因糖尿病相关,PAX4 R192H变异会导致转录抑制活性受损[15],从而可能影响β细胞在胚胎阶段发育,导致成熟β细胞数量及增殖减少。因此在MODY先证者身上获得PAX4基因外显子5 R192H变异,这与泰国文献报道相一致,导致胰岛素水平降低[1]。
随后对其整个家系进行临床资料搜集及PAX4基因外显子5测序,测序后并未发现家系中其他糖尿病患者(包括外婆、母亲及姨母)存在该位点R192H变异,而父亲却出现该MODY先证者所认为的致病基因,即PAX4外显子5 R192H变异,这与预想不同。于是认为PAX4外显子5 R192H变异不是该家系致病原因,而推测该MODY家系中可能存在其他致病基因。结合国外关于PAX4基因基础及动物实验研究,PAX4在胰岛发育及分化过程中发挥着巨大作用。然而在人群研究中,结果却不统一,PAX4外显子5 R192H变异的泰国研究报道中,泰国人群2型糖尿病患者发生变异与未发生变异基因型比较,R192H多态性在糖尿病患者中基因型频率是非糖尿病患者3倍[1]。而在日本PAX4基因相关研究中,R192H多态性在2型糖尿病与正常人之间等位基因频率分别为5.3%和6.2%,两者没有统计学差异[2]。最近Fuchsberger等[16]通过6 504例糖尿病人群和6 436例对照组的全基因组关联研究,PAX4 R192H变异在东亚人群与2型糖尿病的发病有关,而在早发单基因遗传病该位点变异不如2型糖尿病明显,而其他种族人群(包括南亚、欧洲、西班牙、非裔美籍等)R192H位点变异发生率很低。
综合既往研究及本研究,认为PAX4基因R192H变异并非该家系糖尿病致病原因。该MODY家系中致病基因可能存在其他现今未知的MODY基因变异位点,需继续随访该家系下一代糖尿病患病情况和其基因变异情况来进一步证实。


























