
明确不同体成分含量及分布对骨龄发育的影响,建立有益于骨龄发育的健康生活方式。
选取2014年1月1日至2015年8月31日在华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)儿童保健科进行体成分分析、骨龄评价且随访1年的3~10岁儿童作为研究对象,进行前瞻性研究。通过对体质量、身高、人体成分、骨龄的随访,了解不同人体成分分布及增速对骨龄发育的影响。
341例研究对象中,男166例,女175例,入组年龄3.3~10.8岁。不同年龄组儿童骨龄年增长速率为0.62~1.37岁。体成分增速最快者为去脂肪组织(2.60 kg/年),其次为瘦体组织(2.47 kg/年),骨矿物质增长最慢(0.14 kg/年)。瘦体组织(β=14.13)、骨骼肌(β=12.79)、骨矿物质(β=6.26)、无机盐(β=5.91)等体成分含量和四肢瘦体组织含量(1.74≤β≤20.79)、胸围(β=2.02)、腹围(β=1.37)、左臂围(β=1.36)、腹部(β=13.10)和双上臂(β=9.47、6.07))皮下脂肪厚度的增速越快,骨龄的增速越快(均P<0.01);总体水(β=-5.99)、细胞外液(β=-1.60)、躯干瘦体组织含量(β=-7.67)和双股围(β=-1.81、-1.77)、左下肢脂肪皮下脂肪厚度(β=-7.99)的增速越快,骨龄的增速越慢(均P<0.05)。
长期进行有氧运动,避免四肢(尤其是上肢)的负重力量运动,增加水分的摄入等生活方式能更好地延缓骨龄发育,最大限度地促进终身高的发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨龄评价和体成分分析是儿童营养和生长发育监测、内分泌疾病及生长紊乱疾病诊断与治疗监测必不可少的一种手段[1,2]。为了解体成分对骨龄发育的影响,本课题组前期研究曾对1 351例3~12岁儿童进行横断面研究,初步明确了不同体成分对骨龄发育的作用[3],但某些体成分在不同部位的分布对骨龄发育的作用还存在争议。因此,有必要对体成分和骨龄发育做进一步的前瞻性研究,以明确不同体成分对骨龄发育的促进或抑制作用。
选取2014年1月1日至2015年8月31日在华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)儿童保健科体检,进行体成分分析、骨龄评价且随访1年的3~10岁儿童作为研究对象。本研究已通过医院医学伦理委员会审批,并对所有参与研究的儿童监护人告知了研究方案内容、潜在危害及应急预案,充分知情告知后监护人均签署了知情同意书。随访过程中凡出现开始青春期发育、体格生长落后或超前、肝功能受损、血液系统疾病、骨骼系统疾病、钙磷代谢异常、影响体格发育的内分泌及肾脏疾病、服用影响维生素K及维生素D代谢的药物(双香豆素类抗凝剂、抗癫痫药、抗结核药及阿司匹林等)者均予以剔除。
采用自制的3~10岁儿童骨龄发育调查表,在首次来儿童保健门诊体检时进行基线调查,具体内容包括家庭一般情况(居住地、联系方式、父母职业、年龄、文化程度、家庭收入等),出生史(出生时间、孕周、体质量、身长等),近期营养状况及疾病诊疗史等。
采用百斯人体成分分析仪(Biospace InBody J20,韩国Biospace公司生产)对儿童进行体成分分析。具体分析指标包括细胞内液、细胞外液、总体水含量、蛋白质、无机盐、骨矿物质、骨骼肌、瘦体组织、脂肪、去脂肪组织含量、基础代谢率等。
拍摄左腕部X光片,根据《中国儿童手腕骨成熟度及评价方法》[4],采用Z分法对儿童进行骨龄评价,主要评价的骨化中心为桡骨、尺骨,第一、三、五掌骨,第一、三、五近节指骨,第三、五中节指骨,第一、三、五远节指骨。
骨龄评价的参与者均进行骨龄发育等级的系统学习,考核合格后(单人随机阅片20张,骨龄评价误差在0.5岁以内)方能阅片。日常工作中,每天安排2人同时阅片,并与儿童家长约定时间取骨龄报告,保证骨龄评价的准确性。每月科室对所有参与阅片的人员进行阅片质量控制:随机选取50张骨龄片,按随机顺序阅片,评价者间的等级相同例数百分比控制在70%以上,骨龄评价随机误差控制在±0.6岁以内;20 d后对同一批骨龄片再次阅片,评价者内等级相同例数百分比控制在80%以上。
研究对象完成基线调查后1年,电话通知进行门诊随访,随访内容包括近1年来儿童身高、体质量、体成分和骨龄的变化,膳食营养摄入频度、制剂补充情况,疾病诊疗情况等。随访时如有研究对象符合剔除标准,则不必进行骨龄评价并予以剔除。
资料收集完毕后,统一编码,采用Epi-Data3.02软件双份录入并进行一致性检验。逻辑核查无误后,采用SAS 8.0软件进行统计分析,具体分析方法有描述性分析(计数资料的构成比、计量资料的均数和标准差)、单因素分析(性别-年龄构成差异的χ2检验、骨龄与年龄增长速率差异的t检验,P<0.05)、多因素分析(不同体成分增速对骨龄增速影响的多元线性回归,P<0.20)等。
本研究入组的儿童共603例,随访有效研究对象共341例,随访比例为56.55%。在341例研究对象中,男166例,女175例,男女比例为0.951.00;入组年龄3.3~10.8岁,其性别-年龄构成差异无统计学意义(χ2=2.15,P>0.05)(表1)。
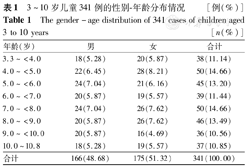
3~10岁儿童341例的性别-年龄分布情况[例(%)]
The gender-age distribution of 341 cases of children aged 3 to 10 years[n(%)]
3~10岁儿童341例的性别-年龄分布情况[例(%)]
The gender-age distribution of 341 cases of children aged 3 to 10 years[n(%)]
| 年龄(岁) | 男 | 女 | 合计 |
|---|---|---|---|
| 3.3~<4.0 | 18(5.28) | 20(5.87) | 38(11.14) |
| 4.0~<5.0 | 22(6.45) | 28(8.21) | 50(14.66) |
| 5.0~<6.0 | 24(7.04) | 21(6.16) | 45(13.20) |
| 6.0~<7.0 | 20(5.87) | 19(5.57) | 39(11.44) |
| 7.0~<8.0 | 24(7.04) | 26(7.62) | 50(14.66) |
| 8.0~<9.0 | 20(5.87) | 26(7.62) | 46(13.49) |
| 9.0~<10.0 | 20(5.87) | 16(4.69) | 36(10.56) |
| 10.0~10.8 | 18(5.28) | 19(5.57) | 37(10.85) |
| 合计 | 166(48.68) | 175(51.32) | 341(100.00) |
入组时341例儿童的骨龄为3.48~10.42岁,经过近1年(0.97~1.22年)的随访,复诊时骨龄为4.76~11.64岁,不同年龄组儿童的骨龄年增长速率为0.62~1.37岁。不同年龄组儿童骨龄年增长速率与生活年龄增长速率的差异无统计学意义(P>0.05)(5~<6.0岁组除外)(表2)。
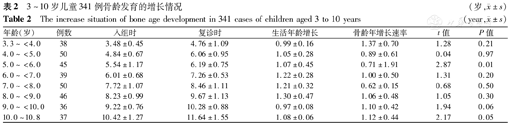
3~10岁儿童341例骨龄发育的增长情况(岁, ±s)
±s)
The increase situation of bone age development in 341 cases of children aged 3 to 10 years(year, ±s)
±s)
3~10岁儿童341例骨龄发育的增长情况(岁, ±s)
±s)
The increase situation of bone age development in 341 cases of children aged 3 to 10 years(year, ±s)
±s)
| 年龄(岁) | 例数 | 入组时 | 复诊时 | 生活年龄增长 | 骨龄年增长速率 | t值 | P值 |
|---|---|---|---|---|---|---|---|
| 3.3~<4.0 | 38 | 3.48±0.45 | 4.76±1.09 | 0.99±0.16 | 1.37±0.70 | 1.28 | 0.21 |
| 4.0~<5.0 | 50 | 4.84±0.67 | 6.06±0.95 | 1.05±0.28 | 0.89±0.61 | 0.04 | 0.97 |
| 5.0~<6.0 | 45 | 5.54±1.17 | 6.19±0.75 | 1.07±0.45 | 0.71±1.91 | 2.87 | 0.01 |
| 6.0~<7.0 | 39 | 6.01±0.68 | 7.26±0.53 | 1.22±0.28 | 1.00±0.50 | 1.31 | 0.20 |
| 7.0~<8.0 | 50 | 7.72±1.07 | 8.46±1.11 | 1.21±0.32 | 0.62±0.15 | 0.68 | 0.50 |
| 8.0~<9.0 | 46 | 8.23±0.99 | 9.67±1.13 | 1.30±0.47 | 1.06±0.48 | 1.05 | 0.30 |
| 9.0~<10.0 | 36 | 9.22±0.76 | 10.28±0.88 | 0.97±0.08 | 1.10±0.42 | 1.94 | 0.06 |
| 10.0~10.8 | 37 | 10.42±1.27 | 11.64±1.55 | 1.08±0.06 | 1.12±0.44 | 2.17 | 0.05 |
体成分分析显示,341例儿童身高的增长速率为6.42 cm/年,体质量增长速率为3.02 kg/年。增长最快的体成分是去脂肪组织(2.60 kg/年),其次为瘦体组织(2.47 kg/年);骨矿物质增长最慢(0.14 kg/年),其次为无机盐(0.18 kg/年)(表3)。
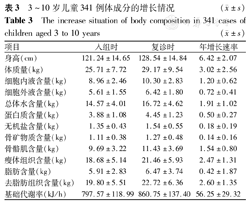
3~10岁儿童341例体成分的增长情况( ±s)
±s)
The increase situation of body composition in 341 cases of children aged 3 to 10 years( ±s)
±s)
3~10岁儿童341例体成分的增长情况( ±s)
±s)
The increase situation of body composition in 341 cases of children aged 3 to 10 years( ±s)
±s)
| 项目 | 入组时 | 复诊时 | 年增长速率 |
|---|---|---|---|
| 身高(cm) | 121.24±14.65 | 128.54±14.84 | 6.42±2.07 |
| 体质量(kg) | 25.71±7.72 | 29.17±9.54 | 3.02±2.56 |
| 细胞内液含量(kg) | 8.96±2.46 | 10.30±2.83 | 1.20±0.62 |
| 细胞外液含量(kg) | 5.61±1.55 | 6.42±1.80 | 0.72±0.41 |
| 总体水含量(kg) | 14.57±4.01 | 16.72±4.62 | 1.91±1.02 |
| 蛋白质含量(kg) | 3.88±1.08 | 4.45±1.23 | 0.50±0.27 |
| 无机盐含量(kg) | 1.35±0.43 | 1.54±0.55 | 0.18±0.19 |
| 骨矿物质含量(kg) | 1.11±0.38 | 1.27±0.48 | 0.14±0.16 |
| 骨骼肌含量(kg) | 9.69±3.22 | 11.43±3.69 | 1.54±0.80 |
| 瘦体组织含量(kg) | 18.68±5.14 | 21.46±5.93 | 2.47±1.31 |
| 脂肪含量(kg) | 5.91±2.83 | 6.47±3.74 | 0.42±1.87 |
| 去脂肪组织含量(kg) | 19.80±5.51 | 22.72±6.36 | 2.60±1.35 |
| 基础代谢率(kJ/h) | 797.57±118.99 | 860.75±137.40 | 56.25±29.32 |
为探讨体成分对骨龄发育的影响,去除混杂因素的影响,以儿童身高和体质量的增速、各体成分的增速、性别等因素为自变量,以骨龄增速为因变量,采用逐步回归的方法,进行多元线性回归,入选和剔除变量的标准均为P<0.20。分析结果显示,瘦体组织、骨骼肌、骨矿物质、无机盐、脂肪等体成分总含量和四肢瘦体组织含量、上臂围、腹围、胸围、上臂和腹部皮下脂肪厚度的增速越快,骨龄的增速越快;总体水、细胞外液、躯干瘦体组织含量和双股围、左下肢皮下脂肪厚度的增速越快,骨龄的增速越慢(表4)。
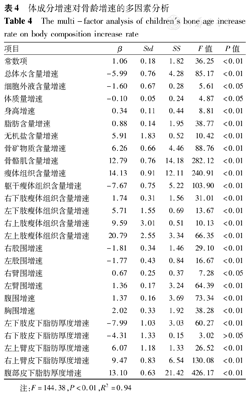
体成分增速对骨龄增速的多因素分析
The multi-factor analysis of children′s bone age increase rate on body composition increase rate
体成分增速对骨龄增速的多因素分析
The multi-factor analysis of children′s bone age increase rate on body composition increase rate
| 项目 | β | Std | SS | F值 | P值 |
|---|---|---|---|---|---|
| 常数项 | 1.06 | 0.18 | 1.82 | 36.25 | <0.01 |
| 总体水含量增速 | -5.99 | 0.76 | 4.28 | 85.17 | <0.01 |
| 细胞外液含量增速 | -1.60 | 0.67 | 0.28 | 5.61 | <0.05 |
| 体质量增速 | -0.10 | 0.05 | 0.24 | 4.87 | <0.05 |
| 身高增速 | 0.34 | 0.11 | 0.44 | 8.81 | <0.01 |
| 脂肪含量增速 | 0.88 | 0.14 | 1.95 | 38.77 | <0.01 |
| 无机盐含量增速 | 5.91 | 1.83 | 0.52 | 10.42 | <0.01 |
| 骨矿物质含量增速 | 6.26 | 0.66 | 4.46 | 88.76 | <0.01 |
| 骨骼肌含量增速 | 12.79 | 0.76 | 14.18 | 282.12 | <0.01 |
| 瘦体组织含量增速 | 14.13 | 0.91 | 12.11 | 240.91 | <0.01 |
| 躯干瘦体组织含量增速 | -7.67 | 0.75 | 5.22 | 103.90 | <0.01 |
| 右下肢瘦体组织含量增速 | 1.74 | 0.31 | 1.56 | 31.01 | <0.01 |
| 左下肢瘦体组织含量增速 | 5.71 | 1.55 | 0.69 | 13.67 | <0.01 |
| 右上肢瘦体组织含量增速 | 9.59 | 3.01 | 0.51 | 10.13 | <0.01 |
| 左上肢瘦体组织含量增速 | 20.79 | 2.55 | 3.34 | 66.35 | <0.01 |
| 右股围增速 | -1.81 | 0.34 | 1.46 | 29.10 | <0.01 |
| 左股围增速 | -1.77 | 0.43 | 0.84 | 16.67 | <0.01 |
| 右臂围增速 | 0.67 | 0.25 | 0.37 | 7.28 | <0.05 |
| 左臂围增速 | 1.36 | 0.17 | 3.24 | 64.39 | <0.01 |
| 腹围增速 | 1.37 | 0.16 | 3.69 | 73.34 | <0.01 |
| 胸围增速 | 2.02 | 0.33 | 1.92 | 38.28 | <0.01 |
| 左下肢皮下脂肪厚度增速 | -7.99 | 1.03 | 3.03 | 60.27 | <0.01 |
| 右下肢皮下脂肪厚度增速 | -4.31 | 1.33 | 0.15 | 3.02 | >0.05 |
| 左上臂皮下脂肪厚度增速 | 6.07 | 1.18 | 1.33 | 26.52 | <0.01 |
| 右上臂皮下脂肪厚度增速 | 9.47 | 0.83 | 6.54 | 130.08 | <0.01 |
| 腹部皮下脂肪厚度增速 | 13.10 | 0.63 | 21.42 | 426.17 | <0.01 |
注:F=144.38,P<0.01,R2=0.94
既往研究显示,生长激素、甲状腺素、雌激素、糖皮质激素等内分泌系统激素在儿童体格生长和骨龄发育的方面有重要的调节作用[5,6]。相对稳定的内分泌环境是研究体格生长速率、体成分变化和骨龄变化规律的良好基础[7]。本研究入组和随访的研究对象年龄为3~10岁,均未进入青春发育期,身高和体质量的增长符合中国儿童青少年体格发育曲线且在正常范围内,骨龄年增长速率与生活年龄增长速率一致,提示研究对象是个稳态的群体,有助于体格生长速率、体成分和骨龄生长速率的研究。
本研究结果显示,总体瘦体组织、骨骼肌、骨矿物质和脂肪含量增速越快,越促进骨龄的快速增长,且瘦体组织在骨龄快速增长中居于首要地位(β=14.13)。瘦体组织是人体肌肉和骨矿物质的总称。骨矿物质主要分布于骨干及生长板成熟区的基质钙化带,骨矿物质增加代表骨组织合成代谢增加,是矿物质在骨干和次级骨化中心沉积的结果,其含量与生活年龄有密切的关系[8,9]。骨骼肌主要分布于四肢,含量增加代表骨骼肌细胞体积的增大,是人体长期力量训练的结果。运动医学认为,长期运动(尤其重力量运动)会增加骨骼肌的含量,并通过骨骼肌的负荷牵拉改变骨骼的应力作用,通过压缩骨骺板加速骺软骨营养转换,从而加速骨矿物质在骨骼和骨化中心的沉积,促进骨龄的快速增长[10,11]。
骨龄评价的基础是非优势手(左手)腕部二次骨化中心的数目、大小、形态、融合与否,涉及桡骨、尺骨、掌指骨等长骨和腕骨。本研究结果提示,四肢瘦体组织快速增加对骨龄的快速增加起促进作用,且以左上肢作用最明显(β=20.79),但是躯干瘦体组快速增加可延缓骨龄的快速增长(β=-7.67)。躯干部位的矿物质沉积主要发生在胸廓、椎骨和骨盆等一些扁平骨、短骨和不规则骨上,这些骨骼多为膜内成骨,无干骺端结构,因此骨矿物质的快速沉积不影响骨龄的发育[12]。当躯干骨骼肌收缩时,椎间盘的存在缓冲了骨骼肌对脊椎的直接牵拉作用,并有效地减缓了脊椎软骨的营养交换,从而减少了椎体矿物质沉积的速率,间接延缓了骨龄的发育。但也有研究证实,躯干骨骼肌的运动可促进椎体骨矿物质的沉积[13],其机制仍需运动医学做进一步研究。
人体脂肪含量和皮下脂肪厚度是判断儿童营养状况和肥胖症分度、分型和预后判断的重要依据。前期研究结果提示,脂肪组织总量、腹部和上肢皮下脂肪厚度的增加可以促进骨龄发育,下肢皮下脂肪厚度的增加可延缓骨龄的发育[3]。本次前瞻性研究得到了类似的结论,提示人体脂肪组织的向心性分布对骨龄发育起促进作用。
人体水分包括细胞外液(60%)和细胞内液(40%)。细胞外液包括组织液、血浆、淋巴、脑脊液等,构成了体内细胞生活的液体环境;细胞内液体相对稳定。本研究结果显示,总体水分和细胞外液的快速增加会延缓骨龄的快速增长,考虑与细胞外液功能相关。细胞外液增多时,细胞膜外物质浓度、渗透压和电荷发生改变,加速了细胞内外物质交换;由于细胞外液具有流动性,细胞代谢产物可被更快地转运,进而形成代谢产物浓度差,分解代谢过程会加速。在骨组织的代谢过程表现为血浆和组织液使成骨细胞获得更多的营养物质,破骨细胞的代谢产物快速转运而形成钙、磷等破骨代谢产物的浓度差,骨组织分解代谢加快,破骨作用加强,骨干的骨矿物质降低。当骨矿物质降低影响到骨化中心时,儿童骨龄增长变慢。
综上,受运动、营养等因素的影响,不同人体成分的含量和分布对骨龄发育的影响往往也不相同。长期进行有氧运动,增加上肢及腹部脂肪的消耗,避免四肢(尤其上肢)的负重力量运动,增加水分的摄入,加快代谢产物的转运,才能更好地延缓骨龄发育,最大限度地促进身高潜能的发挥。



























