
研究不同生长方式颅咽管瘤患者围手术期与远期随访垂体激素的变化规律。
回顾性分析南方医科大学附属南方医院2001年1月至2012年5月间,以手术全切除为目的进行治疗的212例原发颅咽管瘤的临床资料,根据颅咽管瘤QST外科学分型,分析不同生长方式的颅咽管瘤患者手术前、手术后早期及远期垂体激素水平以及相关临床特征。
177例(83.5%)患者术前出现垂体功能减退,其中36例为全垂体功能减退,术后早期垂体功能可进一步加重,下丘脑-垂体-肾上腺轴、下丘脑-垂体-甲状腺轴减退在术后远期的发生率分别为60.1%、58.3%,多数患者术后需要行肾上腺激素及甲状腺激素的替代治疗,不同生长方式的颅咽管瘤垂体功能减退模式存在差异。
颅咽管瘤垂体功能减退模式与QST分型相关,这种分型有利于治疗方法的选择及预后判断,是持续改进颅咽管瘤神经内分泌监控、治疗与健康教育的重要依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
颅咽管瘤是由胚胎发育阶段残存拉克氏管上皮细胞发展而来的一种常见的鞍区良性肿瘤,发病率占所有颅内原发肿瘤的2%~5%,占儿童颅内肿瘤的5.6%~14%[1,2]。大多数颅咽管瘤患者在就诊时已存在垂体功能减退,而颅咽管瘤患者术前垂体功能减退的特点,术后垂体功能变化规律仍不明确,探讨不同生长方式颅咽管瘤患者垂体功能减退模式,对改善患者预后具有重要的意义。本文回顾性分析2001年1月至2012年5月首次手术在南方医院神经外科进行的212例原发颅咽管瘤患者的临床资料,分析并比较不同生长方式颅咽管瘤围手术期及远期垂体激素水平、相关临床特征。
本研究共纳入212例颅咽管瘤患者。纳入标准为:影像学及病理学诊断为颅咽管瘤的新发患者。收集患者临床表现、影像学资料、内分泌激素检查,包括泌乳素(PRL)、睾酮(TEST)、雌二醇(E2)、黄体生成素(LH)、卵泡刺激素(FSH)、皮质醇(COR)、甲状腺功能、生长激素(GH)和胰岛素样生长因子-1(IGF-1)。排除标准:(1)就诊前在外院行相关治疗(包括针对性药物、手术及立体定向放射治疗等)的患者;(2)影像学表现与其他鞍区肿瘤难以鉴别且未行手术、无病理学诊断结果的患者。
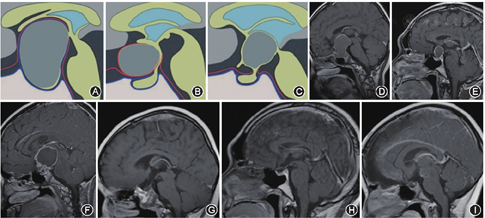
通过前期成人及胎儿标本的解剖学研究,基于肿瘤起源位置和周边膜性结构关系的QST分型[3,4](图1):Q型:起源于鞍隔下的垂体中间叶或垂体柄鞍膈下段,当通过鞍膈孔凸向鞍上时,可有雪人症。肿瘤主体多位于鞍内,可见蝶鞍扩大,甚至凸向海绵窦,鞍膈或部分鞍膈向上膨隆。即使肿瘤较大,周边仍可见鞍膈孔及基底蛛网膜,垂体柄中上段完整存在。S型:起源于鞍膈上垂体柄袖套外及袖套间段,位于鞍膈上,有部分外层蛛网膜和内层蛛网膜与结节漏斗部相隔。肿瘤位于蛛网膜腔内生长,肿瘤可将鞍膈向下推移或不变,垂体清晰可见,三脑室底部向上推移,矢状正中位多可见结节漏斗部和垂体柄。可分为累及多个脑池的肿瘤和只累及单个脑池的肿瘤。当鞍膈孔较大时,肿瘤可部分凸入鞍内生长,但蝶鞍不扩大,鞍内的神经垂体和腺垂体多清晰可见,可见鞍膈和基底蛛网膜大部分完整,位于肿瘤下方。T型:起源于垂体柄袖套内段疏松部、结节漏斗部,肿瘤通过三脑室底凸出卷向三脑室底内或蛛网膜内生长,结节漏斗部正中结构被推挤变形,难以辨认,三脑室内膜延续于肿瘤上方,三脑室底内层蛛网膜及liliequest膜的间脑叶将肿瘤与脚间池相隔。当liliequest膜稀疏或呈网状时,可凸入脚间池生长。垂体柄中下段多存在,当肿瘤穿垂体柄生长时,垂体柄呈喇叭样扩张。该型由于个体间相关蛛网膜结构的差异,肿瘤的生长方式及影像学表现多样,但肿瘤下极与神经血管间存在着多量的内层蛛网膜及完整的基底蛛网膜。

(1)性腺轴功能减退:成年男性TEST下降伴FSH、LH、PRL水平异常,女性E2下降伴FSH、LH正常或下降或者PRL的异常[5];儿童患者FSH和LH下降。(2)生长激素轴功能减退:对应性别年龄组的IGF-1下降,或胰岛素耐受试验(ITT)血糖<400 mg/L时,GH<5 μg/L[6,7]。中枢性甲状腺轴功能减退:游离甲状腺素(FT4)降低伴有促甲状腺激素正常或下降[8]。中枢性肾上腺皮质功能减退:清晨COR<30 μg/L,或ITT血糖<400 mg/L时,COR<200 μg/L[9]。当IGF-1正常或清晨COR>30 μg/L且<180 μg/L时,行ITT判断生长激素轴功能及皮质醇储备功能[10,11]。将尿量超过5 000 ml/24 h或>250 ml/h,持续3~4 h以上,尿比重低于1.005定义为尿崩[12]。出现一种或数种垂体功能轴减退成为部分垂体功能减退(Partial-HP),出现全部垂体前叶激素轴功能减退称为全垂体功能减退(Pan-HP)。
采用门诊复查和电话、网络(QQ等)、信件随访的方式,随访时间为术后3~240个月,平均(125±21)个月。
统计学软件为SPSS 19.0,以P<0.05为差异有统计学意义。计数资料差异统计学意义检验方式采用χ2检验,垂体功能轴减退数及各垂体功能轴减退发生率均以发生垂体功能减退患者为总体进行分析。

不同分型颅咽管瘤患者的临床表现
不同分型颅咽管瘤患者的临床表现
| 分型 | 例数 | 临床表现 |
|---|---|---|
| Q型 | 58 | 生长发育迟缓48例,视路症状45例,多饮多尿22例,精神萎靡11例,癫痫发作8例,肥胖6例 |
| S型 | 48 | 视路症状32例,性功能障碍、闭经或月经紊乱16例,高颅压症状12例,生长发育迟缓8例,多饮多尿6例 |
| T型 | 106 | 视路症状72例,高颅压症状63例,男性性功能障碍29例,女性月经紊乱30例,多饮多尿27例,生长发育迟缓26例,肥胖20例、性格改变10例 |
QST分型是根据起源处垂体柄与蛛网膜覆盖情况对肿瘤生长方式影响而提出的颅咽管瘤分型方式,发病年龄、病理学类型、脑积水等与这种分型有明显相关性。Q型起源于鞍隔下,为蛛网膜外肿瘤,多为儿童患者,均为造釉型肿瘤,多伴有垂体窝扩大,影像学上可见"雪人征",生长发育迟缓发生率较高,脑积水少见;鳞状乳头型肿瘤均为T型,少数为S型。S型为袖套段起源的肿瘤,属蛛网腔内肿瘤,肿瘤可以在袖套内外生长,与三脑室底存在不同蛛网膜间隔,肿瘤囊变多见,可向前、中、后颅窝延伸;T型肿瘤起源于垂体柄的袖套内段结节漏斗部,与三脑室底无蛛网膜间隔,而三脑室方向的肿瘤顶部有室管膜的覆盖,由于蛛网膜分布的个体差异,肿瘤可以向三脑室方向及蛛网膜腔方向生长,甚至完全朝三脑室方向生长,部分患者由于袖套的完整,甚至可以形成穿垂体柄生长的方式,可发生于任何年龄段,除了高颅压及视路损害表现外,性腺轴功能障碍在成人以男性性功能障碍及女性月经紊乱为主,儿童以下丘脑性肥胖及生长发育迟缓为主,T型颅咽管瘤脑积水的发生率显著高于Q型和S型肿瘤。
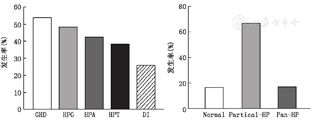
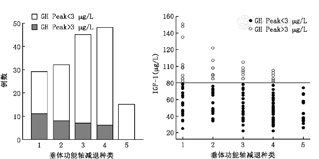
(1)颅咽管瘤患者术前垂体功能减退模式:本组共有177例(83.5%)术前出现垂体功能减退,其中36例出现全垂体功能减退,141例出现部分垂体功能减退。垂体功能减退发生规律见图2,不同年龄组和外科分型间垂体功能减退发生率的差异有统计学意义(表2,3);而不同性别、肿瘤大小及有无囊变、钙化间对比差异无统计学意义(P>0.05)。①不同年龄组间垂体功能减退特点(表2):儿童组70.4%患者出现部分垂体功能减退,23.5%发生全垂体功能减退,明显高于成人组(11.4%)(P<0.01)。各下丘脑-垂体激素轴对比:多数儿童组垂体激素轴功能减退频率与成人组间差异有统计学意义(P<0.05),儿童组出现垂体功能减退的概率从高到低依次为:生长激素缺乏(GHD)>下丘脑-垂体-肾上腺轴(HPA)>下丘脑-垂体-甲状腺轴(HPT)>下丘脑-垂体-性腺(HPG)>DI,异常率分别为76.5%、54.1%、46.9%、38.8%及26.5%。成人组出现垂体功能减退的概率从高到低依次为:HPG>GHD>HPA>HPT>DI,异常率分别为:55.3%、34.2%、32.5%、30.7%及25.4%。②不同外科分型垂体功能减退发生特点(表3):对比不同外科学分型垂体功能减退发生率的特点,全垂体功能减退发生率Q型>T型>S型,P<0.05。出现垂体功能减退各轴差异有统计学意义(P<0.05)。Q型肿瘤出现垂体功能减退频率顺序为:GHD>HPA>HPT>HPG>DI,S型出现垂体功能减退频率为:HPG>HPA>GHD>HPT>DI,T型出现垂体功能减退的频率为:HPG>GHD>HPT >HPA >DI。(2)颅咽管瘤围手术期内分泌变化:本组共有140例患者行胰岛素激发试验,不同分型颅咽管瘤ITT试验的GH峰值不同,以Q型颅咽管瘤峰值最低,S型颅咽管瘤最高(P=0.000)。在29例一种垂体功能减退患者中,18例GH峰值<3 μg/L;在32例同时合并有两种垂体功能减退患者中,24例GH峰值<3 μg/L;在45例同时合并有3种垂体功能减退患者中,38例GH峰值<3 μg/L;在48例同时合并4种垂体功能减退患者中有42例GH峰值<3 μg/L;在15例同时合并5种垂体功能减退,所有患者GH峰值<3 μg/L。当IGF-1低于80 μg/L时,90%患者的GH峰值<3 μg/L(图3)。术前、术后1周、2周分别评估垂体-甲状腺轴、肾上腺轴、性腺轴和生长激素的储备功能,不同肿瘤分型之间的GH、TSH、LH、FSH、PRL异常率差异有统计学意义(P<0.05),随访终点各组之间上述各指标仍差异有统计学意义(P<0.01)。212例中术前激素异常率为25.9%~53.8%,其中GHD最常见(53.8%),有25.6%的患者术前出现DI,据临床观察术前尿崩一般只达到轻中度程度,HPA轴及HPT发生率均不足50%,在成年患者中HPG轴发生率可高达55.3%,术后早期垂体功能减退发生率高于术前,多数患者术后合并多种激素水平下降。通过统计分析,术后早期激素水平的各项数值同术前相比,均P<0.05,术后1~2周患者垂体内分泌激素水平变化尤为剧烈。(3)出院后随访患者内分泌功能的变化:术后3个月及0.5、1年(以后间隔1年)进行随访,在垂体功能恢复的不同阶段,根据激素水平变化规律,结合QST分型,给予相应剂量的激素替代治疗。对于多种激素不足的患者,最先应用皮质激素,然后是甲状腺素,病情稳定后再应用生长激素及性激素。HPA、HPT在术后远期的发生率较高,分别为60.1%、58.3%,多数患者需要行肾上腺激素及甲状腺激素的替代治疗;术后远期DI为18.1%,多数患者服用弥凝可有效控制。80%患者经单一或者多种激素联合替代治疗后,多饮、多尿、食欲减退、闭经、乏力等症状得到不同程度的改善,可轻松从事一般的生活、学习、工作及普通的家务劳动,25例患者术后2年停用激素,可完全恢复正常生活,5例结婚生子,12例患者激素替代疗效不佳,其中10例存在永久性尿崩,需长期使用长效尿崩停或弥凝。


不同年龄组颅咽管瘤患者垂体功能减退发生率[例(%)]
不同年龄组颅咽管瘤患者垂体功能减退发生率[例(%)]
| 组别 | 例数 | Normal | Partial-HP | Pan-HP | GHD | HPG | HPT | HPA | DI |
|---|---|---|---|---|---|---|---|---|---|
| 儿童 | 98 | 6(6.1) | 69(70.4) | 23(23.5) | 75(76.5) | 38(38.8) | 46(46.9) | 53(54.1) | 26(26.5) |
| 成人 | 114 | 29(25.4) | 72(63.2) | 13(11.4) | 39(34.2) | 63(55.3) | 35(30.7) | 37(32.5) | 29(25.4) |
| P值 | 0.000 | 0.267 | 0.000 | 0.000 | 0.017 | 0.015 | 0.001 | 0.856 |
注:Normal:垂体功能正常;Partial-HP:部分垂体功能减退;Pan-HP:全垂体功能减退;GHD:生长激素缺乏;HPG:下丘脑-垂体-性腺轴;HPT:下丘脑-垂体-甲状腺轴;HPA:下丘脑-垂体-肾上腺轴;DI:尿崩
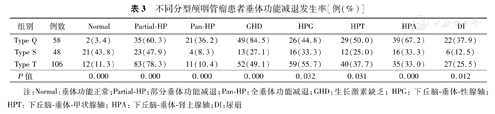
不同分型颅咽管瘤患者垂体功能减退发生率[例(%)]
不同分型颅咽管瘤患者垂体功能减退发生率[例(%)]
| 组别 | 例数 | Normal | Partial-HP | Pan-HP | GHD | HPG | HPT | HPA | DI |
|---|---|---|---|---|---|---|---|---|---|
| Type Q | 58 | 2(3.4) | 35(60.3) | 21(36.2) | 49(84.5) | 26(44.8) | 29(50.0) | 39(67.2) | 22(37.9) |
| Type S | 48 | 21(43.8) | 23(47.9) | 4(8.3) | 13(27.1) | 16(33.3) | 12(25.0) | 16(33.3) | 6(12.5) |
| Type T | 106 | 12(11.3) | 83(78.3) | 11(10.4) | 52(49.1) | 59(55.7) | 40(37.7) | 35(33.0) | 27(25.5) |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.032 | 0.031 | 0.000 | 0.012 |
注:Normal:垂体功能正常;Partial-HP:部分垂体功能减退;Pan-HP:全垂体功能减退;GHD:生长激素缺乏;HPG:下丘脑-垂体-性腺轴;HPT:下丘脑-垂体-甲状腺轴;HPA:下丘脑-垂体-肾上腺轴;DI:尿崩
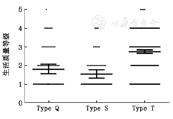
根据Wen等[13]所述,结合Kranofsky评分,患者的临床症状及主诉,本研究采用严格的标准用以评价患者术后的生活质量(表4),级别越高,说明生活质量越差,术后远期生活质量水平由高到低分别为:S型>Q型>T型(图4)。


颅咽管瘤患者术后远期生活质量评价标准
颅咽管瘤患者术后远期生活质量评价标准
| 等级 | 标准 |
|---|---|
| 1级 | Kranofsky评分90分以上,可从事正常体力活动,有轻微不适 |
| 2级 | Kranofsky评分80分以上,需努力才能完成体力活动,出现部分症状 |
| 3级 | Kranofsky评分70分以上,仅能生活自理,不能从事正常体力活动 |
| 4级 | Kranofsky评分60分以上,偶需他人帮助,自理大部分可以完成 |
| 5级 | Kranofsky评分60分以下,生活不能自理,残疾或严重残疾 |
由于起源和生长与下丘脑-垂体有千丝万缕的关系,几乎所有的研究均观察到颅咽管瘤患者的腺垂体功能受到明显损害,与术前相比,术后早期垂体功能障碍多数加重[1,14,15]。本研究显示,不同分型颅咽管瘤垂体功能减退模式存在差异,依据不同生长方式颅咽管瘤患者内分泌激素的变化规律,制定临床诊疗对策,能够更好实现垂体功能重建,提高颅咽管瘤患者远期生活质量。
目前尚缺乏一种合理的能够涵盖全部颅咽管瘤复杂多变的生长方式的分类方法,国内外学者根据影像学解剖位置、与视交叉、三脑室底推挤关系等对颅咽管瘤进行分型:Yasargil等[14]、Steno等[15]使用的鞍下或鞍上型,脑室内或脑室外型肿瘤;Hoffman[16]使用视交叉前或视交叉后型肿瘤;Kassam等[17]针对经蝶窦行颅咽管瘤切除术将肿瘤分为垂体柄前、穿垂体柄以及垂体柄后型;国内学者通过成人及胎儿标本的解剖学研究[3,4],基于肿瘤起源位置和周边膜性结构关系提出新的分型——QST分型。Q型起源于鞍隔下,直接压迫垂体及垂体柄,与鞍上、三脑室底下丘脑结构常常为推挤毗邻关系,全垂体功能减退患者明显高于S型及T型,该型患者术后多数需要长期、序贯垂体激素的替代治疗。S型为袖套段起源的肿瘤,术中操作空间均在蛛网膜下腔,垂体柄的形态、连续性存在,远期内分泌结果最好,多数患者在激素替代一段时间后,可逐步减量,无需长期激素应用。T型肿瘤起源于垂体柄的袖套内段结节漏斗部,无蛛网膜间隔,需要经终板三脑室入路手术,术中采取正确的操作技巧是减少术后下丘脑反应、提高远期生活质量的关键。该型肿瘤远期治疗难点主要集中在对下丘脑功能紊乱、严重肥胖及代谢异常、尿崩及渴感减退等方面的处理。本组研究显示,颅咽管瘤的发病年龄、病理学类型、脑积水及远期生活质量与QST分型有明显相关性,Q型肿瘤多见于儿童,且均为造釉型肿瘤,而鳞状乳头型肿瘤均为S型和T型,术后远期生活质量水平由高到低分别为:S型>Q型>T型。
在颅咽管瘤所致的垂体功能减退中,临床表现取决于激素缺乏的程度、受损激素轴的数量和发病速度[18,19,20,21]。本研究结果显示,垂体激素轴功能减退发生率为GHD>HPG>HPA>HPT>DI,与之前的研究结果基本一致[1,4,14,15,16],儿童组垂体功能减退的发生率明显高于成人组,儿童组全垂体功能减退发生更普遍,所以颅咽管瘤造成的垂体功能减退对儿童患者造成的影响更深远。本组病例中术前不同激素异常率为25.9%~53.8%,其中GHD最为多见(53.8%);有25.9%的患者术前出现DI,一般只达到轻中度尿崩,多数术后远期尿崩服用弥凝可有效控制,且服用一段时间后可逐步停药;本组患者的HPG术前发生率为47.6%,术后远期异常率为60.8%,其中S型及成人T型颅咽管瘤患者HPG减退的发生率高于Q型及儿童T型颅咽管瘤患者。本组HPA、HPT术前发生率分别为42.5%、38.2%,术后远期异常率分别为60.1%、58.3%,说明术后需加强肾上腺皮质激素及甲状腺素的替代。
本研究表明,垂体功能轴减退种类、GH峰值、IGF-1对于预测患者生长激素缺乏有着相当重要的作用,当颅咽管瘤患者同时伴有3种垂体激素缺乏,且血清IGF-1水平显著低于正常参考值,可以不必行生长激素刺激试验即可确诊生长激素缺乏。值得注意的是,本结果显示,患者术后早期皮质醇水平、甲状腺激素水平显著低于术前,尿崩出现率均明显高于手术前,表明颅咽管瘤患者术后1~2周激素水平持续下降,内分泌功能波动剧烈,考虑原因为:(1)经过手术打击,使原有的激素反馈机制受到破坏,而新的代偿机制有待进一步建立;(2)术前残存于体内的部分垂体激素,术后经过1周左右的新陈代谢已经消耗殆尽,而机体尚未完全适应外源性激素的作用机制,因此,术后1~2周是内分泌紊乱及水电解质紊乱最严重的时期。此外,术后1周是开颅手术后脑水肿及颅内感染的高峰期,因此,术后1~2周对颅咽管瘤患者的处理至关重要,稍有不慎则易导致严重并发症,甚至危及生命,合理的激素应用及维持水电解质,内环境的稳定才能使患者平稳渡过围手术期;所有S型及多数T型、Q型患者,通过及时、合理激素替代,远期内分泌紊乱逐步得到纠正,生活质量较早期明显提高,能够轻松从事一般的生活、学习、工作及普通的家务劳动。
综上所述,颅咽管瘤患者术前已存在不同程度的垂体功能减退,垂体功能减退模式与涵盖颅咽管瘤复杂多变生长方式的QST分型密切相关,依据这种外科学分型,有利于垂体激素的变化规律判断及激素替代方案的确定,可以大大提高颅咽管瘤患者远期生活质量。本组资料显示,在高质量的内分泌替代治疗下不但可以使患者长期生存,部分患者还可以继续生长发育,甚至保存生育能力。
南方医科大学统计教研室李丹玲老师对本研究数据的统计分析进行了指导



























