
就脑多巴胺转运蛋白(DAT)显像的最新研究进展进行综述,重点讨论123I-N-ω-氟丙基-2β-甲酯基-3β-(4-碘苯基)去甲基托烷(FP-CIT)SPECT显像。该文涉及这种检查技术在已确诊或疑似帕金森综合征患者诊断中的合理应用,包括其在神经退行性帕金森综合征的鉴别诊断、早期或临床前期诊断以及病情进展评价中的作用。强调如脑纹状体DAT功能正常,可将继发性帕金森综合征或有关震颤综合征患者与神经退行性帕金森综合征患者区分开来。此外,还着重讨论了DAT SPECT显像在诊断路易体痴呆及鉴别该病与阿尔茨海默痴呆中的应用价值,也涉及了此类影像技术在临床应用中的经济学评价。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
运动障碍性疾病是常见的神经系统疾病,其中主要类型之一是帕金森综合征(parkinsonian syndromes, PS)。PS包含以下4种不同病因的疾病类型:(1)帕金森病[(Parkinson disease, PD),或称原发性PS]和帕金森病性痴呆(Parkinson disease with dementia,PDD);(2)遗传性PS(familial PS);(3)非典型性PS(atypical PS,aPS;即由其他神经退行性病变引起的PS,亦称"帕金森叠加综合征");(4)继发性(症状性)PS。上述aPS包括多系统萎缩(帕金森型和小脑型)、进行性核上性麻痹、皮质基底节变性、脊髓小脑萎缩症以及路易体痴呆(Lewy body-type dementia,DLB);继发性PS是由多种原因,如血管因素、药物、感染、中毒、代谢异常所导致的PD样表现,多可伴有炎性反应、外伤、肿瘤以及正常压力脑积水。除PS和aPS以外,常需进一步鉴别诊断的有特发性震颤(essential tremor,ET)和其他震颤综合征。
PD的诊断主要根据英国帕金森病学会脑库(UK Parkinson Disease Society Brain Bank)所制定的临床诊断标准[1],该标准对其他类型的PS亦有参考价值。然而,在PS早期,如果临床表现并不明显,仅表现为单一或轻微的症状(如孤立性震颤),则很难明确诊断。而在该疾病的潜伏期,诊断则更为困难。一些研究(包括临床和尸检研究)[1,2,3,4,5]从不同方面探讨了如何提高临床诊断的正确性,以减少误诊。核医学显像可准确判断许多临床表现不明确的病例,为早期预测疾病的预后及指导临床治疗方案制定提供重要的参考信息。
常规CT及MRI技术很难对PS进行早期诊断,原因是CT或MR观察到的形态学改变通常出现在疾病的相对晚期。一些更为先进的成像技术,如磁共振容量分析(MR volumetry)、质子磁共振波谱(proton MR spectroscopy)、扩散张量及扩散加权成像(diffusion tensor and diffusion-weighted imaging)、弛豫时间(relaxometry)、神经黑色素成像(neuromelanin imaging)以及磁化传递成像(magnetization transfer)对PS的诊断及鉴别诊断可能具有一定价值,但这些技术并非常规检查,其临床应用价值还有待验证[6,7,8,9,10]。
相比之下,核医学分子影像技术有其独特的优势。实验、动物、临床及尸检等诸多研究已经证实,借助分子影像学方法可显示多巴胺能递质系统的功能改变。这种功能改变出现在几乎所有的神经退行性PS中。
多巴胺能神经传递的基本原理众所周知。脑内的多巴胺能神经元主要集中在黑质致密区,通过黑质-纹状体通路投射到纹状体(包括尾状核与壳核)。输送到纹状体的神经递质由突触前多巴胺能神经元末梢释放,并与突触后多巴胺受体结合。此外,多巴胺还可由位于中脑的中脑腹侧被盖区(ventral tegmental area,VTA)产生,产于VTA的多巴胺不仅可通过中脑边缘系统(mesolimbic)或中脑皮质通路(mesocortical)输送至伏隔核或额叶皮质,还可经中脑纹状体多巴胺系统(包括腹侧外壳与前腹侧纹状体)进行输送。通过应用各种特异性PET或SPECT分子显像探针,可评估突触前多巴胺能神经元与突触后多巴胺受体的完整性、数量与密度[11,12]。
突触前黑质纹状体神经元的完整性可通过以下3种主要的功能显像进行评价:(1)18F-多巴(DOPA) PET显像可以反映左旋芳香族氨基酸脱羧酶活性,该酶的活性与PD病情及多巴胺能神经元数目密切相关[11,13];(2)以二氢丁苯那嗪(dihydrotetrabenazine)为分子探针的功能显像可定量检测囊泡单胺转运蛋白2(vesicular monoamine transporter type 2,VMAT2)[14,15],准确反映多巴胺能神经元分布的变化;(3)以可卡因或非可卡因类衍生物为分子探针的多巴胺转运蛋白(dopamine transporter,DAT)功能显像[11,12],此类探针与位于神经元末梢突触前膜的DAT特异性高度亲和。DAT的主要功能是再摄取突触间隙的多巴胺,故通过DAT显像就可以在活体评价突触前神经末梢的完整性。已应用的此类显像剂有非可卡因类衍生物,如哌醋甲酯(methylphenidate);多种可卡因类衍生物,如123I-2β-甲酯基-3β-(4-碘苯基)托烷[2β-carbomethoxy-3β-(4-iodophenyl)tropane,β-CIT],N-(3-碘丙烷-2-烷基)-2β-甲酯基-3β-(4-氯苯基)托烷[N-(3-iodopropen-2-yl)-2β-carbomethoxy-3β-(4-chlorophenyl)tropane,IPT],N-ω-氟丙基-2β-甲酯基-3β-(4-碘苯基)去甲基托烷[N-ω-fluoropropyl-2β-carbomethoxy-3β-(4-iodophenyl)nortropane,FP-CIT],Altropane,N-(3-碘丙基-2E-烯基)-2β-甲酯基-3β-(4′-甲基苯)去甲基托烷[N-(3-iodopro-2E-enyl)-2β-carbomethoxy-3β-(4′-methylphenyl)nortropane,PE2I]以及99Tcm-[N,N′-双(2-巯乙基)乙撑二胺基]甲基-3β-(4-氯苯基)托烷{[2-[[2-[[[3-(4-chloropheny)-8-methyl-8-azabicyclo[3.2.1]oct-2-yl]-methyl](2-mercaptoethyl) amino] ethyl] amino]ethane-thiolato(3-)-N2,N2′,S2,S2′]oxo-[1R-(exo-exo)], TRODAT-1}等。在DAT显像的各类分子探针中,临床应用的主要是123I-FP-CIT(DaTscan)。该显像剂12年前即已在欧洲获准临床应用,在美国也已获准应用2年。多巴胺能神经元突触后膜的功能显像主要为多巴胺D1、D2受体显像。目前,针对多巴胺D1类受体(D1、D5)以及D2类受体(D2、D3、D4)的PET或SPECT显像探针也在研发之中[11]。
药监部门的批准使得123I-FP-CIT广为应用,因此本文主要涉及多巴胺能神经元突触前膜123I-FP-CIT SPECT功能显像评价,重点为这一技术在PS患者中的诊断应用。而对显像技术方面的问题,如显像设备的使用、图像采集及参数处理的最优化以及数据定量分析的方法等则不作详述,相关内容可参考欧洲核医学学会(European Association of Nuclear Medicine)[16]与美国核医学与分子影像学会(Society of Nuclear Medicine and Molecular Imaging)发布的指南[17]。
多巴胺能神经元突触前膜的功能显像可为神经退行性PS(由原发性或其他神经退行性病变引起的PS,包括PD及aPS)的诊断提供重要依据。PD(占PS的70%~80%)的主要病理表现为中脑黑质致密部投射到纹状体(包括尾状核与壳核)的多巴胺能神经元变性脱失。通常投射至后壳核的神经元比前壳核或尾状核更早且更易发生脱失变性。PS患者纹状体DAT的结合力降低,在DAT脑功能影像上表现为基底节区放射性摄取减少,目视判读即可发现该表现。疾病早期后壳核的摄取减少最为显著,逐渐进展到前壳核,最终到尾状核。因此,后壳核是PD患者基底节区最容易、最早受损的部位。尤其在疾病早期,两侧基底节区的放射性摄取呈明显不对称,以患病肢体对侧壳核的摄取减少更为显著[18]。这种情况不仅出现在散发性PD中,也存在于青少年型以及携带帕金森突变基因的PD患者中[19,20,21]。
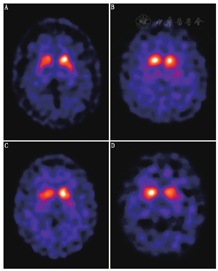
DAT结合显像剂功能的受损与多巴胺能神经元脱失之间的联系已被病理学证实[12]。由于PD以及各类aPS患者的DAT结合力减低,在DAT SPECT图像中可观察到脑基底节区放射性摄取的减少。但需注意的是,在一些aPS患者中上述基底节放射性非对称性减低可能并不明显,且从后壳核到尾状核的放射性浓聚梯度差异也不一定显著。图1为PD与各类aPS患者的DAT功能显像图。只要突触前多巴胺能神经元数量已发生变化,通过123I-FP-CIT SPECT诊断神经退行性PS的灵敏度一般高于95%[22]。
1.神经退行性PS的早期诊断。DAT功能显像在PD早期、尤其是那些偏侧症状的PD(Hoehn & Yahr Ⅰ期)患者中可发现双侧突触前功能受损。通过视觉判读,可以观察到纹状体,特别是壳核部位的放射性摄取较同龄健康志愿者明显降低。在PD早期,这种放射性摄取的降低左右两侧不对称,以起病肢体对侧壳核的放射性降低更为显著 [23,24,25]。基于这种特异性的影像学表现,DAT SPECT显像被认为是诊断早期PD的一种灵敏方法,其甚至在症状出现前即可检测出异常。
病理学结果发现,只有在50%以上黑质多巴胺能神经元脱失时患者才有典型的临床症状[26],这进一步突显了脑DAT功能显像在临床前期及前驱期PD诊断中的应用价值[19,27,28,29,30]。
2.SWEDDS。SWEDD(scans without evidence of dopaminergic deficit)患者指那些根据临床特征被诊断为PD而其DAT显像结果正常的患者,也即早期、不确定性PD样患者。迄今SWEDD患者的组织病理学特点仍不明确。在最近几项针对PD的临床研究中,SWEDD患者的检出比例为11%(45/410)。这一比例和文献报道运动障碍专科医师对早期PD的误诊率一致。由于肌张力障碍性震颤(dystonic tremor)已经被确认是引起SWEDD的一个原因[31],因此,一种观点认为SWEDD仅是有帕金森样表现的其他疾病被误诊为PD,SWEDD并不属于神经退行性疾病的范畴;另一种观点认为SWEDD是一种特殊的、未被完全认识理解的神经退行性疾病,其病理生理学特点与黑质多巴胺能神经元的变性脱失并无关联。虽然在分类方面存在争议,但目前一致认为,与PD相比SWEDD患者有以下特点:突触前多巴胺能神经元的功能在多年内不会受损,也不会进行性减退;接受多巴胺能药物治疗无明显效果(多巴反应性肌张力障碍震颤患者除外);不具有类似于PD患者FDG PET所示脑葡萄糖代谢的典型改变。此外,SWEDD患者的预后要明显好于神经退行性PS患者[32,33,34,35,36]。由于SWEDD患者的组织病理学特点仍不明确,有待将来的研究进一步阐明。
3.病情进展评价。一些横断面研究[12,25,37]报道,DAT功能显像反映的突触前多巴胺能神经元减少程度与PD的严重程度有显著的相关性。另有一些研究[24,38]指出,在不同时间点多次行DAT功能显像有助于对患者病情发展进行个体化评价。这些研究中纹状体DAT结合力(主要通过PET图像中基底节壳核区的放射性摄取来反映)的年减低率(annual decline)为6%~8%,但该减低幅度主要见于PD早期患者,晚期患者的年减低率则小得多。例如,在1组症状持续时间超过9年的PD患者中,DAT结合力的年减低率仅2.4%。另外,aPS的临床进展要明显快于PD; aPS患者的DAT功能减退也比PD快得多:aPS患者平均症状持续时间约2.1年,其平均DAT结合年减低率为14.9%;而PD患者症状持续时间约2.4年,其平均DAT结合年减低率为7.1%[38]。
4.各类PS间的鉴别诊断。突触前功能显像在PD与aPS间、各类aPS之间(例如多系统萎缩、进行性核上性麻痹、皮质基底节变性)鉴别诊断方面的应用价值非常有限[39,40]。在图1中可看到,PD与aPS,以及各类aPS间的脑DAT SPECT图像表现无明显差异。一些其他的核医学分子影像技术在这方面可能更有优势,例如多巴胺能神经元突触后功能显像(D2受体显像)、脑葡萄糖代谢显像[41,42,43,44]。
如果震颤患者的DAT功能正常,则其患神经退行性PS的可能性很小。所以主要鉴别是继发性PS还是其他类型震颤疾病,这些疾病表现易与单一症状的神经退行性PS混淆。DAT功能显像有望解决一个关键的问题,即患者当前的临床症状是否与神经退行性病变有关?这个问题对于神经内科医师而言比较棘手。据文献[32,45,46]报道,许多有震颤症状的疾病与神经退行性病变并无关联,但却易误诊为神经退行性PS,早期患者尤为如此,例如震颤综合征(包括ET),药物性、精神性、血管性PS,甚至阿尔茨海默痴呆等。
图2为继发性PS和ET代表性病例的DAT功能显像图。由于这部分患者的DAT结合力正常,其很容易与神经退行性PS患者(包括PD与aPS)相鉴别。然而,单凭基底节区123I-FP-CIT摄取正常或很轻微的减低并不能区分各类不同的继发性PS,亦不能鉴别继发性PS与ET。在这种情况下需结合临床,在某些情况下形态学影像亦有助于诊断(例如正常压力脑积水及血管性PS)。
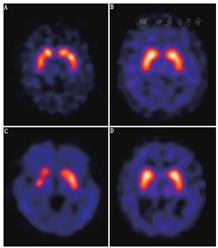

1.震颤综合征。突触前DAT功能显像在震颤综合征和神经退行性PS的鉴别诊断方面有重要的临床应用价值。
(1) ET。ET是最常见的病理性震颤类型,其高峰发病年龄为青少年(20~30岁)和中老年(50~60岁)。超过一半的ET患者有家族史,呈常染色体显性遗传特征。ET的主要临床表现为对称性双侧肢体动作性震颤,亦可同时包含意向性震颤或静止性震颤(后者较少见)。患者通常首先由上肢开始,受累常为手臂,也可以累及头、颈、面部肌肉、发声系统和腿。从临床症状上ET和单一症状的神经退行性PS不易鉴别,DAT SPECT功能显像在这种情况下有其独特的临床应用价值。有时ET和PD可同时出现于一个患者,这种患者需要同时接受抗ET和抗PD治疗。10年前,欧洲多中心临床试验即针对ET和神经退行性PS鉴别诊断的难题展开研究,该试验结果推动了123I-FP-CIT在欧洲的批准使用[22]。该研究共纳入158例临床诊断为PS的患者,27例ET患者以及35名健康志愿者。结果显示,123I-FP-CIT SPECT显像可鉴别PS与ET,其灵敏度与特异性分别高达97%与100%。ET患者的DAT SPECT图像与健康志愿者相同,因而很容易与神经退行性PS患者相鉴别。相似的临床试验在后期被多次重复,证实了结论的可靠性。近期有类似研究对患者进行了更长时间的随访,最长的一项临床随访时间为3年[47]。这些研究的目的与之前相同,仅是研究方法有些差异,比如:有研究[35]在入组的震颤综合征患者中包括了SWEED和肌张力障碍性震颤患者,有研究[48]是通过DAT显像的半定量分析结果来鉴别ET和健康志愿者或偏侧症状的PS。
(2)其他类型的震颤综合征。直立性震颤(orthostatic tremor, OT)在临床上较为少见,主要表现为站立不稳、站立时双下肢出现高频震颤。OT通常发生在站立的情况下,但也可出现在行走的过程中。除了双下肢外,OT也可以影响身体其他部位,如脸部、手和躯干。OT的病因尚不明确,可能与多巴胺能神经系统退化有关。OT患者的纹状体DAT结合力一般正常或仅有轻度降低,故OT患者的123I-FP-CIT SPECT检查结果通常表现正常或仅观察到基底节区放射性有轻度减低[49,50],这与PD患者的123I-FP-CIT SPECT所见明显不同,两者的鉴别诊断较容易[51]。孤立性动作性震颤为ET的特征性临床表现,但也可出现在PD患者中[51]。研究[52]表明,通过123I-FP-CIT SPECT显像能将有动作性震颤症状的患者正确地归类于ET(DAT结合力正常)或PD(DAT结合力减低)。精神心理性震颤(psychogenic tremor)患者的DAT结合力亦表现为正常。
2.血管性PS。血管性PS的主要临床表现为姿势步态异常,其典型表现为行走中呈短小步态。因此,血管性PS又被称为"下肢性PS"。此外,非对称性肌张力增高、表情呆板、吞咽困难、认知障碍、大小便失禁为其常见的临床表现,但震颤特别是静止性震颤少见。抗PD药物对于大多数血管性PS的治疗效果不佳[53]。目前关于血管性PS患者DAT结合力的研究很多,但其结果各异。有文献[44,54,55]报道可疑血管性PS患者的DAT结合力通常正常或仅有轻度减低;而另一些文献[56,57]报道其DAT结合力较正常人显著降低。不一致可能是由于被研究对象的不一致以及病例数量不足所致。但目前较为一致的认识是,在血管性PS患者脑梗死灶直接累及的纹状体上局部的DAT结合力减低,此部位与CT或MRI图像上显示的梗死灶一致。通常可通过上述影像学表现来鉴别血管性PS与神经退行性PS。因此,对血管性PS患者的诊断,高度推荐结合DAT功能显像与CT/MRI形态学显像的结果。除上述较典型的血管性PS之外,Zijlmans等[56]提出另一类发病过程的血管性PS,称之为"脑小血管病变"(small-vessel disease of the brain),特点是症状出现缓慢、隐匿,并可出现DAT结合力减低。Lorberboym等[57]对20例脑血管疾病引发血管性PS症状的患者进行DAT SPECT检查,发现其中9例DAT结合力正常的患者对多巴胺类药物的治疗反应较差;而另外11例DAT结合力减低的患者中5例对多巴胺类药物的治疗效果好。因此,通过DAT功能显像有助于判断血管性PS患者的黑质-纹状体系统是否发生减退,并以此筛选出多巴胺类药物治疗敏感的患者。Contrafatto等[58]通过半定量分析比较了血管性PS、PD以及ET患者的纹状体不对称指数(striatal asymmetry index,两侧纹状体放射性摄取的比值),结果表明血管性PS患者的不对称指数要显著低于PD患者,作者认为通过该参数的定量分析可较为准确地鉴别血管性PS和PD。
3.药物所致PS。在使用抗精神病药物治疗的过程中,此类药物会阻滞纹状体突触后膜的多巴胺受体而引起帕金森样症状。多巴胺受体被阻滞的程度很大程度上取决于所使用药物的种类。典型的抗精神病药物如氟哌啶醇(haloperidol),即使相对较小的治疗剂量也会引起较强的多巴胺受体阻滞作用,故较小的用量也可引起锥体外系不良反应而出现帕金森样症状。而非典型抗精神病药物,尽管其产生多巴胺受体阻滞作用的剂量阈值高得多,但仍可在一定程度上产生多巴胺受体的阻滞而导致锥体外系症状。根据美国帕金森病学会的数据,约7%的PD患者是在服用抗精神病药物后出现症状。文献[45,59,60,61]报道123I-FP-CIT SPECT显像证实药物性PS患者脑DAT功能正常,故可与神经退行性PS相鉴别。还有一种情况即药物激发PS,是指PD患者服用抗精神病药物后出现帕金森样症状,停药以后症状也不完全消失,这种情况多出现在PD患者的疾病前驱期。另有一些疑诊为药源性PS但DAT结合力减低的患者,其最终的临床诊断为神经退行性PS或药源性PS合并神经退行性PS。
4.精神性PS。精神性PS患者纹状体DAT与123I-FP-CIT的结合力正常。Booij等[45]的研究纳入31例原因不明的PS患者,其中4例被证实为精神性PS,其DAT结合力正常。另一项研究[62]中,9例疑诊精神性PS的患者中8例DAT结合力正常,另1例DAT结合力减低的患者被检测到parkin基因突变,提示在DAT功能显像确能有助于神经退行性PS诊断。
5.正常压力脑积水。正常压力脑积水的临床表现3个特征为:步态障碍、尿失禁、痴呆或认知减退。步态障碍通常为最早出现的症状,典型表现为步态失调,呈"胶水样"或"磁性"步态。尽管该类步态障碍特征与PD典型的曳行步态有所不同,但仍常被误诊为PD。通过CT或MRI检查可观察到明显扩张的脑室结构,有时可同时观察到萎缩的大脑皮质。由于正常压力脑积水不会引起突触前膜多巴胺能神经元的脱失,该病患者的纹状体DAT结合力正常,因此较易的与神经退行性PS相鉴别[63]。
6.多巴反应性肌张力障碍(dopa-responsive dystonia, DRD)。与青少年型PD一样,DRD属于遗传性疾病且发病年龄较早。DRD患者的症状表现为肌张力障碍,步态异常,行动缓慢,步态不稳,偶尔可出现肢体震颤。该病对多巴胺类药物治疗效果敏感。与青少年型PD不同的是,这类患者的纹状体DAT结合力正常[64,65]。因此在病史不明确时,DAT SPECT显像可鉴别DRD与青少年型PD。
在各种神经退化性痴呆症中,DLB的发病率逐年增加。如今,DLB患者在痴呆症患者中的比例已达到近30%。单凭临床症状很难将DLB与其他种类的痴呆症相区分,但鉴别诊断对临床治疗决策却非常重要,因为大量的DLB患者对胆碱酯酶抑制剂的治疗效果良好,且这类患者对抗精神病药物高度敏感,容易出现严重锥体外系不良反应[66]。
由于PD和DLB在临床和病理上的关联非常密切,PDD和DLB在许多方面都有相似之处,可以预测二者多巴胺能神经通路应具有相似变化。在临床上的鉴别仅是粗略地基于"一年原则",即:痴呆在锥体外系症状至少1年后出现,倾向于诊断为PDD;若痴呆和锥体外系症状同时出现则倾向于诊断为DLB。通过尸检脑组织及放射性自显影证实,DLB患者纹状体的突触前多巴胺能配体的结合水平显著降低[67]。研究[4,68,69]表明,通过观察纹状体DAT结合力的改变可有效将DLB患者与阿尔茨海默痴呆症患者区分开来。和PD、aPS一样,DLB患者也以纹状体DAT结合力降低为主要特征,因此在123I-FP-CIT SPECT图像上可观察到基底节区放射性摄取的减低(图1)。而阿尔茨海默痴呆症患者的DAT结合力一般正常或仅有轻度减低。通过目视判读和定量分析脑123I-FP-CIT SPECT图像可准确评估纹状体DAT的功能状态,进而鉴别DLB和阿尔茨海默痴呆症患者,灵敏度可达80%,特异性为90%~94%[4,68,69]。最近一项整合了4个临床研究(包括419例患者)的Meta分析[70]表明,123I-FP-CIT SPECT鉴别诊断DLB和非DLB患者的灵敏度和特异性分别为86.5%和93.6%。DAT显像结果异常也似乎有助于将那些诊断不明的"可能的DLB"类别患者("possible DLB")归入为"很可能的DLB"类别("probable DLB")[71]。更具有说服力的证据来自于123I-FP-CIT活体显像和尸检结果的对比:DAT功能显像诊断DLB的灵敏度为88%(7/8)、特异性为100%(12/12);而临床诊断的灵敏度为75%、特异性为45%[72]。这些研究推动了将DAT显像列入DLB相关的共识诊断标准的进程。最近1篇综述[73]提到,尽管其他一些影像学技术在DLB和阿尔茨海默痴呆症的鉴别诊断方面也有所帮助:如DLB患者123I-MIBG SPECT显示其心肌放射性摄取减少,18F-FDG PET显示枕叶糖代谢的降低,MRI示内侧颞叶体积无异常改变等,但123I-FP-CIT SPECT显像仍是目前鉴别DLB与阿尔茨海默痴呆症最可靠有效的方法。需要注意的是,通过123I-FP-CIT SPECT来鉴别DLB和额颞叶痴呆(frontotemporal dementia)可能有一定局限性。研究[74]显示,有1/3(4/12)额颞叶痴呆患者也伴有DAT结合的减低。因此,若要进行此类鉴别诊断,还需进一步定量研究额颞叶痴呆患者脑多巴胺能神经元缺失与DLB和(或)PDD相比是否有程度上的差异。
关于FP-CIT SPECT图像采集和数据处理这些技术层面的问题,例如:患者扫描前应当如何准备,如何制备放射性示踪剂,如何设置图像采集系统以获取充分的采集计数,如何选择恰当的像素大小,如何选择图像重建程序和滤波函数等请参照欧洲核医学学会和美国核医学分子影像学会的操作指南[16,17]。除上述问题以外,另有2个常被问及的问题:在分析123I-FP-CIT SPECT图像时是否需要对其进行定量分析?患者在检查前服药对扫描结果是否有影响?
在过去,临床医师只是根据视觉判读图像的结果给出判断,对于回答突触前多巴胺能神经元完整性是否受损的问题(结论为"是"或"否")有较高的灵敏度和特异性。对一些影像检查结果较为明确的患者,半定量分析的作用仅仅只是进一步验证视觉判读结果的准确性。而对一些影像结果不典型或处于边界状态的病例(如两侧纹状体摄取非对称性不明确;纹状体均匀性摄取减低;壳核-尾状核放射性浓度差异处于边界水平等)或治疗后复查的患者,定量分析可以协助判断。过去由于半定量分析缺乏标准化,也欠缺进行半定量分析的专用软件,加上缺乏大规模的参考数据库,导致了定量分析的应用价值一直被低估。尽管一些单中心研究在定量分析方面各自有较为成熟的数据处理方法,但不同研究中心之间共享参考值和数据库还存在诸多问题。最近已研发出1个大规模数据库,该数据库制定了不同年龄层的参考标准,并形成了商用软件包产品,从而可实现定量分析标准化。由此半定量分析的缺陷有望克服,其价值亦当受到重新评价[75]。目前,相关的对比研究正在进行中,以确定该套软件分析方法的作用。
关于患者在检查前服药是否会干扰DAT SPECT显像结果的问题,Booij和Kemp[76]在一篇综述中有详细描述。他们的建议是:如果临床可以接受,患者最好停止服用有关药物(包括不良用药行为)5个血浆半衰期后再行FP-CIT SPECT显像,以排除药物对扫描结果视觉判读和定量分析的影响。可能影响检查结果的药物有:可卡因(cocaine)、安非他命(amphetamines)、哌醋甲酯(methylphenidate)、苯丁胺(phentermine)、麻黄碱(ephedrine)、莫达非尼(modafinil);抗抑郁类药物,包括安非他酮(bupropion)、radafaxine、马吲哚(mazindol);抗胆碱能药物,如苯扎托品(benzatropine)。虽然选择性5-羟色胺再摄取抑制剂和选择性5-羟色胺或去甲肾上腺素再摄取抑制剂一定程度上会增加纹状体对放射性示踪剂的摄取,但一般影响较小(产生变化约10%),不至于导致误判图像,故一般不建议检查前停药。如果是出于科研目的,考虑到即使较小的差异也可能对研究结果产生影响,进行显像之前最好停用所有可能导致纹状体DAT结合力改变的药物。
本文主要讨论的是突触前DAT显像对PS诊断的应用价值,但在PS患者诊断路径中加入该影像检查技术所产生的经济效益影响也同样值得注意。一些研究[2,77,78]表明,仅通过临床症状来诊断PS有不确定性,通过DAT功能显像可提高诊断准确性,并改变了部分患者的临床治疗决策。例如,有相当一部分患者被误诊为神经退行性PS并服用多巴胺类药物进行治疗;反之,也有相当一部分真正需要这类药物治疗的PS患者由于被漏诊而得不到有效的治疗。因此,除了DAT功能显像对于临床的作用之外,对于这项技术的经济学评价也势在必行[79,80]。1项来自意大利的研究[81]表明,与传统的诊断路径(根据患者的临床症状)相比较,根据123I-FP-CIT SPECT显像结果来鉴别ET和PD的诊断路径降低了总体医疗费用。近期其他若干前瞻性多中心研究关注了123I-FP-CIT SPECT显像对临床未确诊PS患者治疗决策的影响,结果显示,接受DAT显像的亚组可在更早的时间点改变治疗方案;而且在初诊后4周、12周、1年的诊断可信度更高。因此,在未确诊PS患者的诊断路径中加入123I-FP-CIT SPECT检查,对明确诊断、提高诊断可信度、帮助治疗方案的正确制定都会产生重要的影响[82]。
正确诊断对PS患者的治疗决策和临床预后都有极其重要的影响。反映突触前多巴胺能神经元完整性的DAT功能显像已确立作为一项确诊或排除神经退行性PS的方法。患者纹状体DAT结合力正常提示其临床诊断可能是继发性PS(包括血管性、药源性或精神性等因素引起)、正常压力脑积水或震颤综合症(如ET)。但若通过检查结果发现DAT结合力已经减退,即可诊断该患者为神经退行性PS。进一步的鉴别诊断即为PD和各类aPS(包括多系统萎缩、进行性核上性麻痹、皮质基底节变性等),不过单凭脑DAT功能显像还无法完成鉴别诊断,尚需结合患者的临床表现,并且结合其他影像学检查方法,如突触后膜多巴胺受体显像、糖代谢显像等。另一方面,突触前DAT功能显像在神经退行性痴呆症的鉴别诊断中也发挥着越来越重要的作用,因为通过该项技术可准确诊断DLB并与阿尔茨海默痴呆相鉴别。此外,近期若干研究表明,在有关的临床情况下诊断路径加入DAT功能显像可降低总体医疗费用,产生良好的成本-效益。































