
血管活性药主要包括血管加压药、正性肌力药和血管扩张药,通过作用于肾上腺素能受体和非肾上腺素能受体来实现对心血管系统的调节。可通过对心肌的直接作用(有无正性肌力作用)和对血管张力的直接作用(收缩或扩张血管)分为强心扩张血管药(多巴酚丁胺、米力农)、强心收缩血管药(去甲肾上腺素、肾上腺素、多巴胺)、单纯收缩血管药(去氧肾上腺素、血管加压素)和单纯扩张血管药(硝普钠)。血管活性药的选择要根据临床病理生理状态及血流动力学情况,选择合适的血管活性药物及剂量,减少潜在不良反应。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血管加压药(vasopressors)、正性肌力药(inotropes)和血管扩张药(vasodilators)作为血管活性药物在临床广泛使用。一般来说,血管加压药是一类能引起动脉收缩使平均动脉压升高的药物,而正性肌力药则用于增加心肌收缩力。实际上,很多药物会产生一种以上临床效应。临床最常用的血管加压药和正性肌力药是合成的儿茶酚胺类药,这类药通过激动心脏和血管中的α、β肾上腺素受体、多巴胺受体发挥作用(表1)。不同的血管活性药因其作用于相同或不同受体而产生相似或不同的临床效果。本文主要就血管活性药物受体选择与使用进行综述。
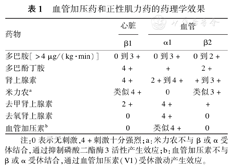
血管加压药和正性肌力药的药理学效果
血管加压药和正性肌力药的药理学效果
| 药物 | 心脏 | 血管 | |
|---|---|---|---|
| β1 | α1 | β2 | |
| 多巴胺[>4 μg/(kg·min)] | 0到3+ | 0到3+ | 0到2+ |
| 多巴酚丁胺 | 4+ | + | 2+ |
| 肾上腺素 | 4+ | 2+到4+ | +到3+ |
| 米力农a | 类似4+ | 0 | 类似3+ |
| 去甲肾上腺素 | 2+ | 4+ | + |
| 去氧肾上腺素 | 0 | 4+ | 0 |
| 血管加压素b | 0 | 类似4+ | 0 |
注:0表示无刺激,4+刺激十分强烈;a:米力农不与β或α受体结合,通过抑制磷酸二酯酶3活性产生效应;b:血管加压素不与β或α受体结合,通过血管加压素(V1)受体激动产生效应。
血管活性药的受体分为肾上腺素受体和非肾上腺素受体两大类。与血管活性相关的肾上腺素受体分为α1、β1、β2受体和多巴胺受体,非肾上腺素受体包括血管加压素受体1a。钙离子增敏剂通过抑制环磷酸腺苷(cAMP)代谢使细胞内钙离子浓度增加或对钙离子敏感性增加而实现类似受体激动效应。
α1肾上腺素受体:主要分布于血管壁平滑肌细胞,通过激动α1受体增加细胞内钙离子浓度,使血管收缩,主要是肠系膜、皮肤和肾脏小动脉收缩,提高外周血管阻力,血液重新分布。在感染性休克、暖休克/血管扩张型休克时,α1受体敏感性下降,需要高剂量血管加压药方能维持外周血管阻力[1]。
β肾上腺素受体:与血流动力学相关的主要是β1和β2受体。β1受体主要分布于心脏,药物激动β受体,尤其是β1受体,通过增加细胞内cAMP和钙离子浓度,使得心肌收缩。对正常心脏而言,即使无β受体激动也基本可排空心腔内血液;当心功能受损、收缩末期容积明显增大时,β受体激动后才会明显改善心搏量。此外,心功能正常者可基于β受体增加心率(β1受体激动)和增加心脏舒张(β2受体激动)的作用,在一定前负荷下增加心搏量和心输出量。β2受体主要分布于血管平滑肌和支气管平滑肌,激动后使血管舒张、支气管扩张;尤其是肌肉的血管平滑肌,运动时肌肉血流增加,有利于血液回流。肝脏β2受体激动可使葡萄糖和乳酸生成增加,为肌肉提供能量。慢性心力衰竭患者由于慢性β1受体下调引起β1受体敏感性下降[2]。
多巴胺受体:主要分布于肾脏、内脏(肠系膜血管)、冠状动脉和脑血管床,激动后引起相应血管收缩,还可使去甲肾上腺素释放致血管收缩。
钙增敏剂:一些药物可使心肌对钙内流引起收缩的敏感性增加,使得肌纤维张力增加,心肌收缩力增加(如左西孟旦)。这类药还有其他药理学特性,如磷酸二酯酶抑制剂,可抑制cAMP在肌细胞内的代谢,增加cAMP浓度而增强心肌收缩力并使血管扩张。
血管加压素1a受体(V1aRs):通过多重机制来模拟和增大α1受体的血管收缩效应。V1受体普遍存在于体循环血管平滑肌细胞,是非肾上腺素能受体[3]。
血管活性药物种类较多,可通过血管活性药对心肌的直接作用(有或无正性肌力作用)和对血管张力的直接作用(收缩或扩张血管)分4类:强心扩血管、强心缩血管、单纯缩血管、单纯扩血管。该分类可对血管加压药和正性肌力药等使用时的异同做区分。
常用多巴酚丁胺和米力农,通过正性肌力和正性节律增加心输出量,但同时可扩张血管。其不良事件包括因血管过于扩张致低血压,因心肌细胞钙超载致快速型心律失常,因心肌氧供需不匹配致心肌缺血[4]。
通过强刺激β1受体,轻到中度刺激β2受体和轻度刺激α1受体增强心肌收缩力,降低外周血管阻力。增加心搏量和心输出量的作用呈剂量依赖性,中度增快心率,对平均动脉压影响多变。大剂量时[>10~15 μg/(kg·min)],剂量依赖的α1受体可能占主导。因平均动脉压的变化由心输出量和血管阻力的基础值共同决定,故无法预测剂量增加时多巴酚丁胺对平均动脉压的总效应。可表现为心输出量明显增加而外周血管阻力适当下降,使平均动脉压增加,如心源性休克;也可呈心输出量升高不多,而周围血管阻力明显下降使平均动脉压下降,如高排低阻的血管扩张型休克。多巴酚丁胺对心率的影响呈剂量依赖性,低剂量时[<5 μg/(kg·min)]通过正性肌力增加心搏量,无明显心动过速;>10 μg/(kg·min)时,心率增快明显,左室舒张充盈时间缩短、心搏量下降,此时心输出量增加有限。
与多巴胺相比,多巴酚丁胺5~10 μg/(kg·min)时,心输出量更高,心室充盈压更低,但多巴胺的平均动脉压和外周血管阻力更高。心源性休克时两种药物[剂量分别为7.5 μg/(kg·min)]联合使用比单一药物剂量为15 μg/(kg·min)时的血流动力学改善更为明显,提示低血压患者可能需要小剂量正性肌力药联合治疗。但多巴酚丁胺与肾上腺素合用时效果较差,可能是二者竞争激动β1受体的相似部分所致。长期使用可因β1受体下调而耐受,需增加剂量。β受体阻滞剂可显著减弱多巴酚丁胺效应,故需更大剂量实现正性肌力效应[5]。多巴酚丁胺是脓毒症伴心功能受损时的一线强心药物[3]。
米力农通过抑制磷酸二酯酶3,增加细胞内cAMP浓度,增强β1、β2受体下游信号,呈类似β1、β2受体激动效应。米力农扩张肺动脉和周围血管,低排高阻患者使用后可维持平均动脉压,适合心源性休克伴右心衰竭患者[3]。部分低血容量或外周血管阻力过低者可能会致低血压,故休克患者并不是最优选。失代偿心力衰竭患者米力农0.5 μg/(kg·min)并不改善患者预后,可增加缺血性心肌病患者再入院率和病死率。因米力农不通过儿茶酚胺通路起效,对心肌β1受体减退、不敏感及药物阻断的心力衰竭患者,米力农可呈正性肌力作用,维持血流动力学[6]。故推荐用于长期使用β受体阻滞剂或长期慢性心力衰竭致肾上腺素受体不敏感者。
与多巴酚丁胺相比,米力农明显降低肺血管阻力,更适于右心功能不全者。多巴酚丁胺推荐用于低血压者,包括急性心源性休克、感染性休克伴心功能损害,也可用于严重肾功能不全者。米力农经肾代谢,肾功能不全者半衰期延长不推荐[3]。多巴酚丁胺更易发生心动过速、心律失常、高血压、心肌缺血,米力农则易引起低血压。
强心缩血管药可直接显著地收缩血管,并有正性肌力作用,如内源性儿茶酚胺类,即去甲肾上腺素、肾上腺素、多巴胺等。小剂量时,刺激心肌β1受体,增加心肌收缩力,同时增加心肌耗氧量,特别是多巴胺和肾上腺素;大剂量时,刺激α1受体,外周血管阻力和平均动脉压进行性增高[7]。小剂量多巴胺和肾上腺素增加心肌收缩力和心率;大剂量使用3种药物的目的为增加血管张力。不良反应为心动过速、快速型心律失常、心肌缺血、组织缺血。
强效α1受体激动剂,弱到中效β1受体激动和弱β2受体激动。血流动力学效应为α1受体激动后收缩血管,外周血管阻力增加;β1受体激活使心肌收缩,维持心输出量。增加剂量时,心输出量和静脉回流增加,改善液体反应性。去甲肾上腺素可强烈收缩血管、后负荷过高,使心输出量降低,特别是心功能受损者。但部分心源性休克伴血管扩张引起低血压,可通过去甲肾上腺素维持心输出量[8],可能系基础血管张力过低,去甲肾上腺素使后负荷轻度增加,同时β受体激动伴心肌收缩增强,心输出量并无明显降低。去甲肾上腺素提高平均动脉压的作用较肾上腺素弱,较多巴胺强100倍,较去氧肾上腺素强3~5倍[5]。去甲肾上腺素可升高平均动脉压并反射性使心率下降,β1激动也可致恶性心动过速。去甲肾上腺素是所有类型休克伴低血压时的一线用药,包括原因不明休克[9]。
强效激动α1和β1受体,β2受体激动效应强于去甲肾上腺素。小剂量[0.01~0.1 μg/(kg·min)]可激动β1、β2受体,增加心输出量和(或)心率。心脏术后,小剂量[0.03~0.04 μg/(kg·min)]肾上腺素可有效增加心搏量、心输出量和平均动脉压,较多巴胺[5 μg/(kg·min)]更少引起心动过速[5]。大剂量肾上腺素使α1受体相关血管收缩,效果与去甲肾上腺素联合多巴酚丁胺相似[3]。与去甲肾上腺素相比,感染性休克时肾上腺素降低动脉血pH值、血乳酸增高,可能是细胞代谢增加所致[7]。肾上腺素是治疗严重休克的二线血管活性药[10]。
不同剂量多巴胺可激活不同受体,产生不同效应。多巴胺可作用于多巴胺受体,并通过直接激动β1受体和间接增强α1受体信号产生肾上腺素受体激动效应[1]。多巴胺不再是治疗感染性休克一线药物。多巴胺能受体刺激还可影响下丘脑垂体系统,释放催乳素,使免疫受制[7]。小剂量[<4 μg/(kg·min)]时,激活多巴胺受体,内脏、肾血管扩张,增加尿量。多巴胺的肾脏效应很弱,且研究并未证明肾脏剂量的多巴胺能防止肾损伤进展或避免肾脏替代治疗[3,5]。中等剂量[5~10 μg/(kg·min)]时,激活心脏β1受体,通过正性肌力和正性节律增加心率、心搏量和心输出量,中等剂量多巴胺还可引起肺淤血[8]。大剂量[10~20 μg/(kg·min)]时,α1受体激动占主要地位,可逐渐增加外周血管阻力使平均动脉压增加,并不增加心输出量。与去甲肾上腺素相比,多巴胺更易发生快速型心律失常[9]。
单纯缩血管药包括去氧肾上腺素和血管加压素(抗利尿激素),是休克治疗时收缩血管的二线药物。作用为增加外周血管阻力,无正性肌力作用。交感神经压力性反射使心率、心搏量、心输出量减低,平均动脉压升高受限,故需强心药维持心输出量[5]。严重心功能受损者因后负荷增加,充盈压增高与心输出量不匹配,不能维持有效平均动脉压。缩血管药用于高排低阻型休克。外周血管阻力高、心输出量低时,血管收缩不能有效提升平均动脉压(冷休克),还可因心输出量减低加重组织缺氧。血管收缩药适用于强心刺激有害时,如未控制的心动过速、快速型心律失常或左室流出道梗阻。
系单纯α1受体激动剂,增加血管张力,对暖休克(分布性或血管扩张)心功能正常者,可维持心输出量[11]。多用于去甲肾上腺素引起的严重心律失常或者持续低血压伴高心输出量时。
系内生肽类激素,作用于血管平滑肌V1a受体,是非肾上腺素能血管加压药,其血流动力学效果与去氧肾上腺素相似。V1a受体在酸中毒时仍可收缩血管,此时肾上腺素α1受体活性下降。低剂量血管加压素可纠正休克时血管加压素缺乏的状态,改善平均动脉压;大剂量可有效升血压,但仅用于难治性血管扩张型休克,系因肠道缺血风险,不常规使用。在生理状态下,血管加压素有中度肺血管和肾脏血管收缩作用,且小剂量血管加压素可通过内皮细胞释放一氧化氮,与米力农联合使用治疗心脏术后患者可降低肺血管阻力,提高外周血管阻力,在右心衰患者治疗有优势[12],但能否降低感染性休克病死率仍有争议。休克者因受体敏感性降低,故对儿茶酚胺类药反应降低。对于心率过快、外周血管阻力低、心输出量合适者(暖休克),可考虑加用垂体后叶素,尤其是严重酸中毒时儿茶酚胺反应受限者。难治性血管扩张型休克者加用血管加压素可降低儿茶酚胺剂量,从而减少因大剂量儿茶酚胺引起的不良事件[13]。
单纯扩血管药如硝普钠可扩张动脉和静脉降低血压。硝普钠作用于体内的硫酰基使一氧化氮释放,致钙离子隔离和抑制细胞收缩,血管平滑肌舒张,降低血管张力;一氧化氮释放可降低脑血管阻力,脑血管扩张可致颅内压增高。硝普钠可致动静脉分流,内脏血流重新分配,增加肺分流,还可使脑、心肌氧供减低。血流动力学方面,硝普钠可扩张动脉和静脉,降低前后负荷,心室充盈压减低,血压降低,心输出量增加,常用于心脏手术围手术期控制血压、高血压危象和急性失代偿性心力衰竭。硝普钠用于严重低排高阻休克,降低后负荷,可能使一些特定情况下的患者获益。因硝普钠起效迅速,并可致严重低血压,故需从小剂量[0.5 μg/(kg·min)]开始,密切监测血压,注意代谢产物氰化物中毒可能[14]。
因其作用受体不同,血管活性药的不良反应不同。大量α1、V1a受体激动可使皮肤、胃肠、肾、冠状动脉血管强烈收缩、组织缺血,特别是低心输出量和低血压者。肾上腺素比多巴胺和去甲肾上腺素更易引起内脏灌注受累[15]。过多的α1受体激动使肾血管收缩可引起急性肾损伤。与单用去甲肾上腺素相比,加用垂体后叶素可能会改善尿量和(或)肌酐清除率,减轻肾损伤风险,可能是联用减少了去甲肾上腺素剂量[15,16]。过度刺激心脏β1、β2受体(包括磷酸二酯酶抑制剂)使心动过速和心肌细胞钙过载,可引起房性和室性心律失常。所有β1受体激动均增加心肌耗氧[7]。与肾上腺素和多巴胺相比,多巴酚丁胺可改善冠状动脉血流[10]。去氧肾上腺素和垂体后叶素减慢心率,不引起快速型心律失常,但可因冠状动脉收缩导致心肌缺血。β1受体激动剂可轻度降低胰岛素敏感性致高血糖。β2受体激动剂除引起高血糖,还可明显增高血清乳酸,以肾上腺素为著[4,17],可影响休克治疗时血乳酸水平的临床判定。
血管活性药物对机体的调控复杂。多数血管加压药通过激动肾上腺素α受体增加外周血管阻力;正性肌力药通过激动肾上腺素β受体增加心搏量,β受体激动还可增快心率、增加心输出量。必须权衡受体激动所致益处和风险,需根据病理生理状态及血流动力学情况,选择合适的血管活性药,采用能维持重要脏器灌注的最小剂量、最短使用时间,减少不良反应。



























