
探讨人类表皮生长因子受体2(HER-2)阳性早期乳腺癌患者采用多西他赛(docetaxel,T)、卡铂(carboplatin,C)联合曲妥珠单抗(trastuzumab,H)(TCH)方案新辅助治疗后的临床疗效。
选择2008年1月至2014年12月北京大学第一医院乳腺疾病中心实施TCH新辅助化疗并接受手术的HER-2阳性早期乳腺癌患者进行回顾性研究,并结合术后病理疗效评价进行预后分析。
共计77例临床病理资料及随访信息完整的患者进入本研究。其中,病理疗效评价有效率(G2+G3+G4+G5)84.4%。病理完全缓解率(pCR)39.0%(30/77)。5年无病生存率(DFS)87.3%,5年总生存率(OS)93.6%,病理评价有效与无效患者的DFS与OS差异均有统计学意义(DFS:χ2=6.762,P=0.009;OS:χ2=5.062,P=0.024)。
TCH方案是HER-2阳性乳腺癌患者有效的新辅助治疗方案,毒副反应可控。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1987年Slamon等[1]发现人类表皮生长因子受体2(HER-2)与乳腺癌复发转移和生存密切相关,并成为HER-2阳性乳腺癌的理想治疗靶点。基于HERA、NSABP B-31、N9831及BCIRG006等多项大型临床试验结论,术后辅助化疗联合抗HER-2治疗可以使HER-2阳性乳腺癌患者获得生存获益。2017年,美国国立综合癌症网络(NCCN)乳腺癌临床实践指南坚持推荐多西他赛(T)、卡铂(C)联合曲妥珠单抗(H)(TCH)方案作为HER-2阳性乳腺癌新辅助治疗的优选方案之一。本研究对北京大学第一医院乳腺疾病中心2008至2014年接受TCH方案新辅助治疗的HER-2阳性乳腺癌患者进行回顾性分析,并结合随访资料进行生存分析,现将结果报道如下。
选择2008年1月至2014年12月北京大学第一医院乳腺疾病中心接受TCH方案新辅助治疗的HER-2阳性早期乳腺癌患者进行回顾性分析。入组标准包括:治疗前空芯针穿刺组织病理确诊为HER-2阳性乳腺癌;同意接受TCH方案新辅助治疗;治疗期间MRI疗效评价完整;新辅助治疗结束后接受既定手术;术后组织病理疗效评价资料完整;接受随访且资料完整。
全部患者经基线检查确定为早期乳腺癌,无远隔部位转移。行血常规、血液生化,心电图、超声心动图等检查,全身评价无新辅助治疗禁忌证。治疗前采用B超进行腋窝淋巴结检查,腋窝淋巴结阳性病例选择细针穿刺活检证实,阴性病例选择前哨淋巴结活检评价。根据患者诊断日期,参考2007年及2013年美国临床肿瘤协会(ASCO)/美国病理学家协会(CAP)指南进行HER-2状态评价[2,3],HER-2阳性标准为免疫组化(IHC)+++,或原位免疫荧光杂交(FISH)基因扩增。
选择TCH方案,多西他赛75 mg/m2,第1天,每3周重复,卡铂血药浓度-时间曲线下面积(AUC)=5~6 mg·ml-1·min-1,第1天,每3周重复,联合曲妥珠单抗首次剂量8 mg/kg,以后6 mg/kg,每3周重复。每周期化疗前接受外周血、血生化、心电图检查,确定无化疗禁忌证,新辅助化疗后酌情使用促粒细胞集落刺激因子。基线、新辅助治疗开始后3、6和12个月用心脏超声进行左心室射血分数(LVEF)评价。新辅助治疗4周期后MRI疗效评价为SD的患者选择再次空芯针穿刺,病理评价为G1的患者经沟通后选择更换化疗:长春瑞滨25 mg/m2,第1、8天,每3周重复,顺铂75 mg/m2,分第1、2天,每3周重复,并继续曲妥珠单抗治疗(NPH方案),继续新辅助治疗4~6周期后接受手术;或放弃更改方案直接手术。4周期后MRI疗效评价PR患者完成6周期TCH方案化疗,然后接受手术。
新辅助治疗前及每两周期治疗后进行动态增强MRI检查,依据RECIST(response evaluation criteria in solid tumors)标准1.1版本进行临床疗效评价。采用Miller-Payne评价系统对比新辅助治疗前空芯针穿刺标本及手术后组织病理标本进行疗效评价[4]。定义病理完全缓解(pCR)为乳腺和腋窝淋巴结均无浸润性病灶(ypTis/0ypN0)。定义G1为治疗无效,定义G2+G3+G4+G5为治疗有效。
手术时间在末次化疗结束后10~14 d进行。新辅助治疗前腋窝淋巴结病理评价阳性患者行Ⅱ组腋窝淋巴结清扫术,阴性者不行腋窝淋巴结清扫。
继续使用曲妥珠单抗抗HER-2治疗维持1年。激素受体(HR)阳性患者术后接受内分泌治疗。治疗前原发肿瘤T3以上、淋巴结阳性及保乳术后患者接受辅助放疗。
采用CTCAE (common terminology criteria for adverse events,CTCAE) 4.0版进行不良事件(AEs)评价。
采用电话及信件随访。随访至患者死亡,末次随访日期为2016年12月31日。无病生存(DFS)定义为手术后第1天至首次出现局部复发、远处转移、非乳腺癌引起的死亡或随访终止时间,OS定义为从疾病确诊至任何原因导致患者死亡或者随访终止时间。
使用SPSS 24.0软件行统计分析,对新辅助治疗疗效与影响因子的相关性分析采用χ2检验或Fisher精确概率检验。生存分析采用Kaplan-Meier方法计算,并根据病理疗效评价分组进行Log-rank检验。P<0.05为差异有统计学意义。
2008年1月至2014年12月,北京大学第一医院乳腺疾病中心针对143例患者HER-2阳性早期乳腺癌患者进行新辅助治疗。其中,77例接受TCH方案新辅助治疗且资料完整的患者进入本研究(2008—2014年HER-2阳性早期乳腺癌新辅助治疗143例,其中非TCH方案61例,TCH方案82例中去除5例临床资料不全者)。全部患者均为女性,平均年龄50.8岁(23~69岁)。其中绝经前30例(39.0%),绝经后47例(61.0%)。在全部患者中,Luminal B型[ER和(或)PR阳性,HER-2阳性]39例(50.6%),HER-2阳性型(ER,PR阴性,HER-2阳性)38例(49.4%);60例患者新辅助治疗4周期后MRI疗效评价为PR。17例患者TCH 4周期后MRI评价临床疗效SD,其中5例再次粗针穿刺后病理疗效评价为G1,更改NPH方案4~6周期后接受手术(表1);7例评价为G2以上,继续接受TCH方案,完成6周期后接受手术治疗;其他6例患者拒绝再次穿刺和更换方案,直接接受手术治疗。新辅助治疗期间5例患者(6.5%)左室射血分数与基线比下降>10%,均无临床症状表现,后续监测未发现进行性下降。
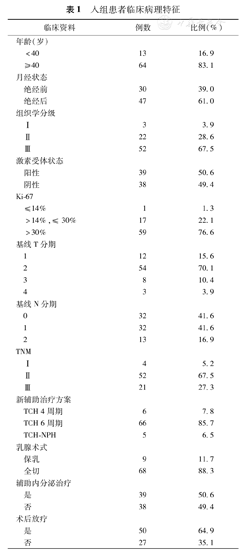
入组患者临床病理特征
入组患者临床病理特征
| 临床资料 | 例数 | 比例(%) | |
|---|---|---|---|
| 年龄(岁) | |||
| <40 | 13 | 16.9 | |
| ≥40 | 64 | 83.1 | |
| 月经状态 | |||
| 绝经前 | 30 | 39.0 | |
| 绝经后 | 47 | 61.0 | |
| 组织学分级 | |||
| Ⅰ | 3 | 3.9 | |
| Ⅱ | 22 | 28.6 | |
| Ⅲ | 52 | 67.5 | |
| 激素受体状态 | |||
| 阳性 | 39 | 50.6 | |
| 阴性 | 38 | 49.4 | |
| Ki-67 | |||
| ≤14% | 1 | 1.3 | |
| >14%,≤ 30% | 17 | 22.1 | |
| >30% | 59 | 76.6 | |
| 基线T分期 | |||
| 1 | 12 | 15.6 | |
| 2 | 54 | 70.1 | |
| 3 | 8 | 10.4 | |
| 4 | 3 | 3.9 | |
| 基线N分期 | |||
| 0 | 32 | 41.6 | |
| 1 | 32 | 41.6 | |
| 2 | 13 | 16.9 | |
| TNM | |||
| Ⅰ | 4 | 5.2 | |
| Ⅱ | 52 | 67.5 | |
| Ⅲ | 21 | 27.3 | |
| 新辅助治疗方案 | |||
| TCH 4周期 | 6 | 7.8 | |
| TCH 6周期 | 66 | 85.7 | |
| TCH-NPH | 5 | 6.5 | |
| 乳腺术式 | |||
| 保乳 | 9 | 11.7 | |
| 全切 | 68 | 88.3 | |
| 辅助内分泌治疗 | |||
| 是 | 39 | 50.6 | |
| 否 | 38 | 49.4 | |
| 术后放疗 | |||
| 是 | 50 | 64.9 | |
| 否 | 27 | 35.1 | |
(1)MRI疗效评价:采用动态增强MRI检查并参照RECIST(1.1)标准对新辅助治疗疗效进行评价,最终术前评价13例CR(16.9%),51例PR(66.2%),13例SD(16.9%),无PD病例。(2)病理疗效评价及相关因素分析:采用Miller-Payne标准对入组患者进行病理疗效评价,其中,G1组12例(15.6%)、G2组6例(7.8%)、G3组11例(14.3%)、G4组18例(23.4%)、G5组30例(39.0%)。共30例患者获得pCR,pCR率39.0%。新辅助治疗病理评价总有效率为(G2+G3+G4+G5)84.4%。选取年龄、月经状态、肿瘤组织学分级、激素受体表达情况、Ki-67表达情况、肿瘤T分期、N分期、临床分期进行单因素分析,上述因素与TCH新辅助化疗后pCR均无明显相关性(均P>0.05)(表2)。
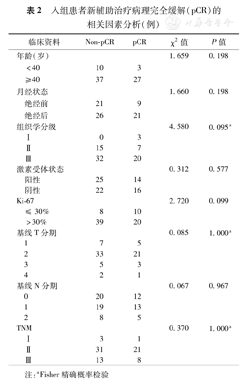
入组患者新辅助治疗病理完全缓解(pCR)的相关因素分析(例)
入组患者新辅助治疗病理完全缓解(pCR)的相关因素分析(例)
| 临床资料 | Non-pCR | pCR | χ2值 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁) | 1.659 | 0.198 | |||
| <40 | 10 | 3 | |||
| ≥40 | 37 | 27 | |||
| 月经状态 | 1.660 | 0.198 | |||
| 绝经前 | 21 | 9 | |||
| 绝经后 | 26 | 21 | |||
| 组织学分级 | 4.580 | 0.095a | |||
| Ⅰ | 0 | 3 | |||
| Ⅱ | 15 | 7 | |||
| Ⅲ | 32 | 20 | |||
| 激素受体状态 | 0.312 | 0.577 | |||
| 阳性 | 25 | 14 | |||
| 阴性 | 22 | 16 | |||
| Ki-67 | 2.720 | 0.099 | |||
| ≤ 30% | 8 | 10 | |||
| >30% | 39 | 20 | |||
| 基线T分期 | 0.085 | 1.000a | |||
| 1 | 7 | 5 | |||
| 2 | 33 | 21 | |||
| 3 | 5 | 3 | |||
| 4 | 2 | 1 | |||
| 基线N分期 | 0.067 | 0.967 | |||
| 0 | 20 | 12 | |||
| 1 | 19 | 13 | |||
| 2 | 8 | 5 | |||
| TNM | 0.370 | 1.000a | |||
| Ⅰ | 3 | 1 | |||
| Ⅱ | 31 | 21 | |||
| Ⅲ | 13 | 8 | |||
注:aFisher精确概率检验
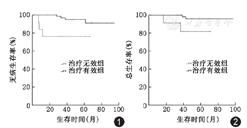
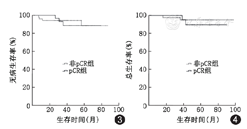
全部患者均接受随访,中位随访时间48.7个月(18.4~96.8个月)。5年DFS为87.3%,5年OS为93.6%。共7例患者发生事件,其中病理评价无效组3例,有效组4例,两组间DFS差异有统计学意义(72.7%与93.8%,χ2=6.762,P=0.009)(图1)。共4例患者肿瘤相关死亡,其中病理评价无效组2例,有效组2例,两组间OS差异有统计学意义(81.8%与96.9%, χ2=5.062,P=0.024)(图2)。但是,pCR与DFS(87.4%与87.5%,χ2=0.50,P=0.824)及OS差异均无统计学意义(95.4%与90.6%,χ2=0.209,P=0.648)(图3,图4)。


临床针对三阴型、HER-2阳性型以及肿瘤负荷大或具有高复发风险的乳腺癌选择术前新辅助治疗已经获得共识[5]。2017年,NCCN乳腺癌临床实践指南坚持推荐AC-TH(多柔比星/环磷酰胺序贯紫杉醇联合曲妥珠单抗)方案,以及TCH方案作为早期HER-2阳性型乳腺癌辅助治疗和新辅助治疗的一线方案。由于不含有蒽环类药物,TCH方案具有心肌毒性低、适应证更为宽泛的特点。对于心脏功能存在潜在危险的新辅助治疗适应证患者,TCH方案安全性更好。在本研究中,全部患者依从性良好,无3级以上心脏毒性也证实了这一优点。但是,近年来有关应用TCH方案进行新辅助治疗的前瞻性研究不多,少数回顾性研究也多以讨论近期疗效为主[6]。TCH方案对HER-2阳性早期乳腺癌患者新辅助治疗的近期疗效和远期预后,可为规范抗HER-2治疗提供借鉴。
文献报道,参照ypT0/isN0作为pCR标准,接受多西他赛联合曲妥珠单抗进行新辅助治疗的pCR率为29.0%[7],接受TCH方案pCR率为39%~43%[8,9],而Gepar Quattro试验将pCR定义为更为严格的ypT0N0以后,其pCR率为31.7%[10]。本研究采用TCH方案对77例HER-2阳性乳腺癌进行新辅助治疗,pCR率达到39%,与文献报道相似。本研究依据Miller-Payne病理疗效标准进行新辅助治疗疗效评价,并界定G1为病理疗效评价无效,G2~G5为病理疗效评价有效。结果发现,新辅助治疗病理评价总有效率可以达到84.4%,与文献报道相一致[11]。研究发现,TCH方案新辅助治疗有效组与无效组的5年DFS与OS存在显著性差异。证实接受TCH方案新辅助治疗的HER-2阳性乳腺癌患者,如果病理疗效评价有效可以带来生存获益。为今后临床新辅助治疗方案选择提供了有益的参考。
有关激素受体状态与HER-2阳性乳腺癌新辅助治疗后pCR相关性的研究屡见报道[7,10,12]。本研究针对年龄、月经状态、激素受体状态、Ki-67水平、组织学分级、T分期、N分期、TNM分期与pCR的关系进行了单因素分析,发现临床及免疫组化信息对于获得pCR不具有预测价值。我们认为,作为一种高度异质性的恶性肿瘤,现有的临床信息尚不足以覆盖乳腺癌的全部特征。根据新辅助治疗的反应,筛选疗效不佳患者并获得更改系统治疗的机会,也不失为新辅助治疗的一项获益。2014年,一项荟萃分析[13]报道了三阴型乳腺癌在新辅助化疗后获得pCR可以带来生存获益,该项研究为临床医生制定初始治疗决策提供了新的思考。追求高pCR率也成为临床关注的热点。但是,在本研究中并未获得pCR患者带来生存获益的结论。我们分析认为,HER-2阳性和三阴型乳腺癌是具有不同生物学特征的两个分子亚型。其中,除手术R0切除以外,细胞毒药物是三阴型乳腺癌患者长期获益的唯一治疗方式,通过新辅助治疗获得pCR可以带来远期生存获益的研究结论完全可以理解。但是,HER-2阳性乳腺癌在新辅助治疗后,无论是否获得pCR都需要接受1年曲妥珠单抗维持治疗为整体改善预后提供重要的帮助。同时,在本研究中部分患者HR阳性表达,并接受了至少5年规范的内分泌治疗。这些综合因素可能是HER-2阳性乳腺癌在新辅助治疗获得pCR之后并没有出现远期生存获益结论的重要原因。
2018年1月,AJCC第8版乳腺癌分期系统将在全球启动。新版分期系统除了继续坚持通过解剖学信息准确反映临床肿瘤负荷以外,首次增加了组织学分级(G)、ER、PR、HER-2四项生物学标志物,并形成了全新的预后分期系统。其中,以Ⅰ类证据推荐优先选择预后分期对乳腺癌患者进行评价是更新的亮点。已有文献报道预后分期对HER-2阳性型乳腺癌5年DFS和OS具有预测价值[14],说明反映肿瘤内在特性的生物学信息为临床医生理解肿瘤特性,制定个体化治疗决策提供了更加合理和多元化的参考依据。在预后分期系统中,HER-2阳性乳腺癌患者接受抗HER-2治疗已成为改善预后分期的重要依据。2017年,曲妥珠单抗正式成为中国乳腺癌辅助治疗医疗保险目录用药,首次以国家认证形式推动了我国HER-2阳性乳腺癌临床规范化治疗的进程。可以期待更多HER-2阳性乳腺癌将获得更加规范的综合治疗。而TCH方案作为HER-2阳性乳腺癌患者有效的新辅助治疗方案之一,安全性更高,值得在临床推荐。



























