
探讨血清脂蛋白相关磷脂酶A2(Lp-PLA2)与缺血性脑卒中后血管性痴呆(VD)的相关性。
收集2013年6月至2016年10月在郑州大学人民医院就诊的缺血性脑卒中患者226例,根据认知功能障碍程度分为VD组(104例)和非痴呆组(122例),并将非痴呆组分为认知正常组(54例)和非痴呆性认知功能障碍(VCIND)组(68例)。统计所有患者一般资料,并测定血清Lp-PLA2、同型半胱氨酸(Hcy)、超敏C反应蛋白(hs-CRP)及血脂指标。建立Logistic回归模型分析Lp-PLA2是否为VD的危险因素,而后利用相关性及ROC曲线分析Lp-PLA2与认知障碍病情的相关性以及诊断界限值。
VD组血清Lp-PLA2水平[(221±84) ng/ml]显著高于非痴呆组[(133±60) ng/ml],VCIND组Lp-PLA2[(148±65) ng/ml]高于认知正常组[(114±48 ) ng/ml],差异有统计学意义(P<0.05);Logistic回归分析结果表明,血清Lp-PLA2是与VD密切相关的危险因素[OR(95%CI)=1.015(1.010~1.021)],且其水平与认知功能评分呈负相关;Lp-PLA2水平在VD组和非痴呆组间的界限值为164.65 ng/ml,认知正常组和VCIND组间的界限值为120.8 ng/ml。
血清Lp-PLA2是缺血性脑卒中后VD发生的相关危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血管性痴呆(vascular dementia,VD)是脑血管疾病引发的痴呆,表现为记忆力、认知和行为能力等全面的大脑功能下降[1,2]。缺血性脑卒中是常见的脑血管疾病之一,也是VD主要的病因之一[3]。我国是脑血管病高发的国家,因而VD的发病率也逐年增加,给社会和家庭带来了沉重的护理和经济负担。对于VD目前尚无有效的治疗手段,仍以预防为主,因此,VD发病的危险因素分析已成为脑血管病领域的研究重点之一。脂蛋白相关磷脂酶A2 (lipoprotein associated-phospholipase A2 ,Lp-PLA2)是一种血管特异性炎症标志物,已被证实是多种心脑血管疾病的独立危险因素[4],且与病情以及认知功能障碍的发生发展相关[5]。目前关于Lp-PLA2与VD相关性的研究尚不多见,且Lp-PLA2水平对于VD病情的提示意义尚不明确。本研究拟通过分析脑卒中后血管性痴呆患者及未发生痴呆患者的血清Lp-PLA2水平,探讨Lp-PLA2对脑卒中后VD的提示意义从而为VD的及早预防提供一定研究基础。
病例来自于2013年6月至2016年10月在郑州大学人民医院神经内科门诊或住院的缺血性脑卒中患者。病例纳入标准:(1)经MRI或其他影像学手段确诊的缺血性脑卒中患者,诊断标准为中华医学会关于脑卒中的诊断标准[6]以及世界卫生组织制定的脑卒中定义:脑部局部或全面缺血病灶,出现神经功能缺损情况并持续超过24 h;(2)60岁≤年龄<80岁;(3)发病时间距离就诊或入院14 d内;排除标准:(1)出血性脑卒中患者;(2)短暂性脑缺血发作(TIA)患者;(3)脑肿瘤或其他非血管性脑部疾病造成神经功能缺损的患者;(4)混合型痴呆,或有精神病史;(5)汉密尔顿抑郁量表<7分。所有患者入院后均进行抗血小板凝集治疗或他汀治疗,严格戒烟戒酒,并控制血糖和血压等。患者于发病后3~6个月内复诊,在复诊时根据血管性痴呆的诊断标准将患者分为VD组和非痴呆组,VD的诊断标准为《美国精神障碍诊断与统计手册》第Ⅴ版(DSM-Ⅴ),即存在明确的脑血管病变且明确为痴呆发生的原因;而后根据认知功能差异将非痴呆组分为认知功能正常和非痴呆型血管性认知功能障碍(vascular cognitive impairment no dementia,VCIND)两类,VCIND的诊断标准为伴有认知功能下降但未达到DSM-Ⅴ规定的痴呆的标准[7]。本研究共收集缺血性脑卒中患者226例,其中VD患者104例,认知功能正常者54例,VCIND患者68例。本研究经郑州大学人民医院伦理委员会批准[郑州大学人民医院(2013)伦审第(10)号],所有参与研究的患者均取得本人或家属的知情同意。
统计所有患者的性别、年龄、文化程度、抽烟、饮酒、家族史等一般资料,统计影像学检查结果中的梗死病灶部位和面积大小;对患者进行简易精神量表(MMSE)和蒙特利尔认知量表(Mo-CA)测定;统计是否合并有高血压、高血脂、糖尿病、冠心病或有既往病史等情况;诊断标准:高血压诊断标准为收缩压≥140 mmHg(1 mmHg=0.133 kPa),舒张压≥90 mmHg[8];高血脂诊断标准为血清总胆固醇(TC)≥6.2 mmol/L,三酰甘油(TG)≥2.3 mmol/L;高密度脂蛋白胆固醇(HDL-C)<1.0 mmol/L,低密度脂蛋白胆固醇(LDL-C)≥4.1 mmol/L[9];高血糖诊断标准为空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.0 mmol/L。
生化指标检测方法:采集所有患者清晨空腹静脉血5 ml,送检验科测定TC、TG、HDL-C、LDL-C、超敏C反应蛋白(hs-CRP)、同型半胱氨酸(Hcy)指标;将部分血液样本离心取上清,酶联免疫吸附法(ELISA)测定Lp-PLA2蛋白含量(试剂盒购自上海酶联生物科技有限公司,操作按照说明书进行)。
数据采用SPSS 19.0进行分析。计量资料采用 ±s表示,组间比较采用独立样本t检验,计数资料组间比较采用χ2检验,均以P<0.05为差异有统计学意义。纳入两组间差异接近有意义的指标(P<0.2)进行多因素Logistic回归,分析脑卒中后VD的相关危险因素;最后采用Pearson相关性分析和ROC曲线分析血清Lp-PLA2和认知功能障碍病情的相关性及界限值。
±s表示,组间比较采用独立样本t检验,计数资料组间比较采用χ2检验,均以P<0.05为差异有统计学意义。纳入两组间差异接近有意义的指标(P<0.2)进行多因素Logistic回归,分析脑卒中后VD的相关危险因素;最后采用Pearson相关性分析和ROC曲线分析血清Lp-PLA2和认知功能障碍病情的相关性及界限值。
本研究中纳入的226例脑卒中患者中,年龄(68±6)岁,男120例(53.10%),抽烟者122例(53.98%),喝酒者97例(42.92%),小学及以下文化程度者140例(61.94%),有痴呆家族史者54例(23.89%),合并高血压者126例(55.75%),合并高血脂96例(42.48%),合并高血糖66例(29.20%),合并冠心病58例(25.66%)。VD组和非痴呆组一般资料比较如表1所示。从表1可以看出,两组在年龄、喝酒、文化程度、梗死灶面积、hs-CRP、Hcy和Lp-PLA2指标方面具有统计学差异(P<0.05),其余指标差异不具有统计学意义。
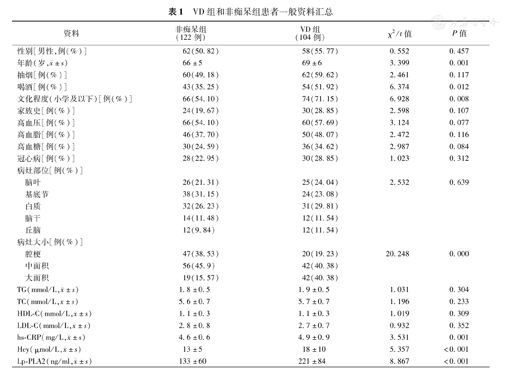
VD组和非痴呆组患者一般资料汇总
VD组和非痴呆组患者一般资料汇总
| 资料 | 非痴呆组(122例) | VD组(104例) | χ2/t值 | P值 | |
|---|---|---|---|---|---|
| 性别[男性,例(%)] | 62(50.82) | 58(55.77) | 0.552 | 0.457 | |
年龄(岁, ±s) ±s) | 66±5 | 69±6 | 3.399 | 0.001 | |
| 抽烟[例(%)] | 60(49.18) | 62(59.62) | 2.461 | 0.117 | |
| 喝酒[例(%)] | 43(35.25) | 54(51.92) | 6.374 | 0.012 | |
| 文化程度(小学及以下)[例(%)] | 66(54.10) | 74(71.15) | 6.928 | 0.008 | |
| 家族史[例(%)] | 24(19.67) | 30(28.85) | 2.598 | 0.107 | |
| 高血压[例(%)] | 66(54.10) | 60(57.69) | 3.124 | 0.077 | |
| 高血脂[例(%)] | 46(37.70) | 50(48.07) | 2.472 | 0.116 | |
| 高血糖[例(%)] | 30(24.59) | 36(34.62) | 2.987 | 0.084 | |
| 冠心病[例(%)] | 28(22.95) | 30(28.85) | 1.023 | 0.312 | |
| 病灶部位[例(%)] | |||||
| 脑叶 | 26(21.31) | 25(24.04) | 2.532 | 0.639 | |
| 基底节 | 38(31.15) | 24(23.08) | |||
| 白质 | 32(26.23) | 31(29.81) | |||
| 脑干 | 14(11.48) | 12(11.54) | |||
| 丘脑 | 12(9.84) | 12(11.54) | |||
| 病灶大小[例(%)] | |||||
| 腔梗 | 47(38.53) | 20(19.23) | 20.248 | 0.000 | |
| 中面积 | 56(45.9) | 42(40.38) | |||
| 大面积 | 19(15.57) | 42(40.38) | |||
TG(mmol/L, ±s) ±s) | 1.8±0.5 | 1.9±0.5 | 1.031 | 0.304 | |
TC(mmol/L, ±s) ±s) | 5.6±0.7 | 5.7±0.7 | 1.196 | 0.233 | |
HDL-C(mmol/L, ±s) ±s) | 1.1±0.3 | 1.1±0.3 | 1.019 | 0.309 | |
LDL-C(mmol/L, ±s) ±s) | 2.8±0.8 | 2.7±0.7 | 0.932 | 0.352 | |
hs-CRP(mg/L, ±s) ±s) | 4.6±0.6 | 4.9±0.9 | 3.531 | 0.001 | |
Hcy(μmol/L, ±s) ±s) | 13±5 | 18±10 | 5.357 | <0.001 | |
Lp-PLA2(ng/ml, ±s) ±s) | 133±60 | 221±84 | 8.867 | <0.001 | |
纳入表1中差异接近有统计学意义(P<0.2)的指标——年龄、抽烟、喝酒、文化程度、家族史、高血压、高血脂、高血糖、梗死面积、hs-CRP、Hcy和Lp-PLA2,进行多因素Logistic回归分析,结果如表2所示。从表2可以看出,年龄、文化程度、hs-CRP、Hcy和Lp-PLA2是缺血性脑卒中后VD发生的密切相关因素,而高血脂、大面积梗死病灶是VD的可能相关因素。
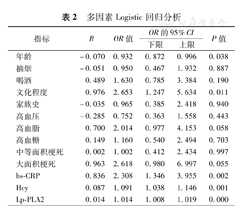
多因素Logistic回归分析
多因素Logistic回归分析
| 指标 | B | OR值 | OR的95%CI | P值 | |
|---|---|---|---|---|---|
| 下限 | 上限 | ||||
| 年龄 | -0.070 | 0.932 | 0.872 | 0.996 | 0.038 |
| 抽烟 | -0.051 | 0.950 | 0.467 | 1.932 | 0.887 |
| 喝酒 | 0.489 | 1.630 | 0.785 | 3.384 | 0.190 |
| 文化程度 | 0.976 | 2.653 | 1.247 | 5.634 | 0.011 |
| 家族史 | -0.035 | 0.965 | 0.385 | 2.418 | 0.940 |
| 高血压 | -0.285 | 0.752 | 0.363 | 1.558 | 0.443 |
| 高血脂 | 0.700 | 2.014 | 0.977 | 4.153 | 0.058 |
| 高血糖 | 0.149 | 1.160 | 0.540 | 2.494 | 0.703 |
| 中等面积梗死 | 0.002 | 1.002 | 0.412 | 2.434 | 0.997 |
| 大面积梗死 | 0.963 | 2.618 | 0.980 | 6.997 | 0.055 |
| hs-CRP | 0.836 | 2.308 | 1.346 | 3.955 | 0.002 |
| Hcy | 0.087 | 1.091 | 1.038 | 1.146 | 0.001 |
| Lp-PLA2 | 0.014 | 1.014 | 1.008 | 1.019 | 0.000 |
Lp-PLA2在VD组和非痴呆组以及认知正常组和VCIND组之间的差异有统计学意义(P<0.05)。Pearson相关性分析结果显示,Lp-PLA2和MMSE及MoCA评分之间存在负相关性(r=-0.467,P<0.001;r=-0.422,P<0.001),即与认知功能障碍严重程度呈正相关性(表3)。
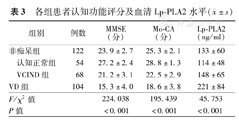
各组患者认知功能评分及血清Lp-PLA2水平( ±s)
±s)
各组患者认知功能评分及血清Lp-PLA2水平( ±s)
±s)
| 组别 | 例数 | MMSE(分) | Mo-CA(分) | Lp-PLA2(ng/ml) | |
|---|---|---|---|---|---|
| 非痴呆组 | 122 | 23.9±2.7 | 25.3±2.1 | 133±60 | |
| 认知正常组 | 54 | 27.2±2.4 | 28.8±1.3 | 114±48 | |
| VCIND组 | 68 | 21.2±3.1 | 22.5±2.9 | 148±65 | |
| VD组 | 104 | 15.3±4.0 | 18.6±3.8 | 221±84 | |
| F/χ2值 | 224.038 | 195.439 | 45.753 | ||
| P值 | <0.001 | <0.001 | <0.001 | ||
分别绘制Lp-PLA2对于VD组和非痴呆组、认知正常组和VCIND组的ROC曲线,并根据尤登指数计算出两组间的最佳界限值。结果显示,Lp-PLA2对于鉴别VD组和非痴呆组的特异性和敏感度均较高,两组间界限值为164.65 ng/ml;鉴别认知正常组和VCIND组的特异性较高,两组间界限值为120.80 ng/ml。即164.65 ng/ml和120.80 ng/ml分别为缺血性脑卒中后痴呆和非痴呆、认知障碍和认知正常之间的标准值(图1,表4)。
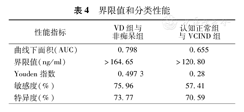
界限值和分类性能
界限值和分类性能
| 性能指标 | VD组与非痴呆组 | 认知正常组与VCIND组 |
|---|---|---|
| 曲线下面积(AUC) | 0.798 | 0.655 |
| 界限值(ng/ml) | >164.65 | >120.80 |
| Youden指数 | 0.497 3 | 0.28 |
| 敏感度(%) | 75.96 | 57.41 |
| 特异度(%) | 73.77 | 70.59 |
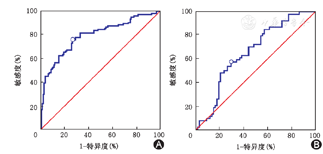

注:A:VD组和非痴呆组之间;B:非痴呆组内认知正常组和VCIND组之间
VD是造成脑区低灌注的脑血管性疾病发生后出现的认知功能障碍,是脑卒中的常见后遗症之一。大部分VD是由缺血性脑卒中引起的,此外普遍认为高龄、吸烟、饮酒、家族史、文化程度和高Hcy等是VD发生的独立危险因素[10,11,12]。本研究结果显示,除常见危险因素外,hs-CRP和Lp-PLA2也是VD的危险因素之一。
本研究首次发现了Lp-PLA2和VD的相关性,表明其是与缺血性脑卒中后VD发生密切相关的危险因素。Lp-PLA2已被报道与多种心脑血管疾病的发生发展相关,且与认知功能障碍有一定相关性。Lin等[13]发现Lp-PLA2是轻微脑卒中和短暂性脑缺血发作后复发的危险因素,而反复的脑缺血发作是导致VD发生的重要原因。Jiang等[14]检测了1 374名中国社区居民的血清Lp-PLA2水平以及MMSE认知能力评分后发现,高Lp-PLA2水平的成年人有更高的风险出现认知功能障碍。俞春江等[15]研究发现,各种类型认知功能障碍患者血清中Lp-PLA2水平均显著高于对照组,且VD组高于轻度认知功能障碍组,即随着病情的进展Lp-PLA2水平逐渐升高。Fitzpatrick等[16]研究了3 340例受试者发现,Lp-PLA2是合并有心脑血管疾病患者出现痴呆的独立危险因素,高Lp-PLA2者出现痴呆的风险比低Lp-PLA2者高出50%。最新的研究表明,Lp-PLA2还参与视黄醇结合蛋白4、神经突起导向因子的信号通路,导致合并有脑梗死的糖尿病患者出现认知功能障碍[17]。本研究结果同样显示,VD组Lp-PLA2水平高于VCIND组,而VCIND组高于认知正常组,其水平与认知功能障碍严重程度呈正相关,即Lp-PLA2越高意味着认知能力越低,VD越容易发生。
Lp-PLA2由血管内膜的淋巴细胞、巨噬细胞分泌,是血管类疾病的一种炎症标志物[18]。血管炎性反应和认知功能的关系已得到许多研究的证实,包括CRP、IL-6在内的许多炎性因子已成为脑血管事件后VD发生的标志物之一[19,20],其机制是炎症反应加速了血栓的形成和脑部血管的损伤[21]。本研究结果也表明,hs-CRP是缺血性脑卒中后VD发生的相关危险因素。Lp-PLA2产生血管炎性反应的机制主要为与低密度脂蛋白结合,而后生成脂类促炎物质-游离脂肪酸和血溶性卵磷脂,促进动脉粥样硬化斑块的形成[22];同时,Lp-PLA2也是一种血管斑块水解酶,促使较脆弱的粥样硬化斑块破裂、脱落,导致脑血管事件发生从而增大认知功能损害以及痴呆发生的风险。因此可以推测,血清Lp-PLA2水平越高,越容易导致心脑血管疾病的发生,以及血管事件发生后的认知功能障碍以及痴呆的出现,或加重原有血管损伤的病理状态。近年来,血管性认知功能障碍被分为VD和VCIND两类,VCIND随着病情的进展可以发展为VD,被视为VD的早期阶段。本研究结果提示,VD组Lp-PLA2水平高于非痴呆组,且Lp-PLA2水平与认知功能评分呈反比,表明该指标与认知功能障碍病情严重程度有关。此外,Lp-PLA2已作为血管特异性炎症标志物被应用于脑卒中等血管疾病的临床预测,但其标准尚未取得明确结论。本研究中,ROC曲线显示VD和非痴呆组之间的界限值164.65 ng/ml,认知正常组和VCIND组的界限值为120.80 ng/ml,可以为临床提供一定参考。
综上所述,血清Lp-PLA2可以作为预测缺血性脑卒中后VD发生风险的标志物,同时该指标具有血管特异性,比Hcy、CRP具有更高的临床应用前景。临床上可以通过检测该指标并结合患者个人的综合因素,对病情进行控制和判断。此外,初步分析其机制与血管炎性反应有关,但更深层次的机制尚需要进一步研究确证。但本研究仍存在一些局限性和不足,如分析从脑卒中到VD进展过程中Lp-PLA2的动态变化对临床的意义,以及该指标与脑卒中病灶位置和大小的关系等。在下一步的研究中,作者会增加样本量和随访研究时间,进行多中心、大样本的深入研究,以期取得更为科学的结论。































