
探讨甘草酸对支气管哮喘(简称哮喘)小鼠细胞外调节蛋白激酶(ERK)1/2和p38丝裂原活化蛋白激酶(MAPK)信号通路的影响。
(1)体内实验:BALB/c小鼠60只按随机数字表法随机分为对照组、哮喘组、低浓度甘草酸(25 mg/kg)组、高浓度甘草酸(100 mg/kg)组、U0126(0.1 mg/kg)干预组及SB203580(5 mg/kg)干预组各10只。末次激发24 h后,肺组织HE和AB-PAS染色,免疫组化法和Western印迹法检测肺组织ERK1/2和p38 MAPK的相对表达量。(2)体外实验:磁珠分选哮喘小鼠脾脏CD4+T细胞,经抗CD3单抗(1 μg/ml)(CD3组)预处理后,分别以不同浓度甘草酸(10 μg/ml、100 μg/ml)、U0126(10 μmol/L)及SB203580(10 μmol/L)干预,培养72 h后,Western印迹法检测CD4+T细胞ERK1/2和p38 MAPK的相对表达量。
(1)体内实验:哮喘组气管黏膜充血水肿,血管壁及管周有大量炎症细胞浸润,气管上皮杯状细胞化生,管腔黏液高分泌,高浓度甘草酸组和U0126及SB203580干预组的气道炎症反应和上皮杯状细胞化生程度较哮喘组轻。免疫组化结果:高浓度甘草酸组和U0126干预组肺组织p-ERK1/2表达(0.090±0.022、0.072±0.017)均显著低于哮喘组(0.143±0.022)(均P<0.05);高浓度甘草酸组和SB203580干预组肺组织p-p38 MAPK表达(0.072±0.019、0.061±0.015)均显著低于哮喘组(0.121±0.022)(均P<0.05)。Western印迹法结果:高浓度甘草酸组和U0126干预组肺组织p-ERK1/2表达(0.385±0.186、0.117±0.051)均显著低于哮喘组(0.783±0.133)(均P<0.05);高浓度甘草酸组和SB203580干预组肺组织p-p38 MAPK表达(0.275±0.089、0.108±0.043)均显著低于哮喘组(0.649±0.095)(均P<0.05)。(2)体外实验:高浓度甘草酸组和U0126干预组p-ERK1/2表达(0.579±0.184、0.249±0.082)均显著低于CD3组(1.028±0.147)(均P<0.05);高浓度甘草酸组和SB203580干预组p-p38 MAPK表达(0.445±0.081、0.249±0.082)均显著低于CD3组(0.902±0.107)(均P<0.05)。
哮喘小鼠存在ERK1/2和p38 MAPK信号通路激活,甘草酸可抑制哮喘小鼠ERK1/2和p38 MAPK信号通路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(简称哮喘)是一种以气流阻塞、黏液高分泌和炎症细胞浸润及气管重塑为特征的常见的慢性气管炎症性疾病,其发病涉及多条信号通路。近来的研究认为,丝裂原活化蛋白激酶(MAPK)家族激活后可促使辅助性T细胞(Th)2细胞的增殖、分化和募集,促进白细胞介素(IL)-4、IL-5和IL-13等Th2型细胞因子的产生[1]。如何通过影响MAPK信号通路,从而诱导对吸入抗原的Th2免疫应答偏移,目前已成为哮喘发病机制研究中的又一热点。
研究表明,植物甘草提取物甘草酸具有包括抗炎、抗氧化、免疫调节及抗过敏等多种生物活性[2,3]。本研究观察甘草酸对哮喘小鼠细胞外调节蛋白激酶(ERK)1/2和p38 MAPK信号通路的影响,探讨其在哮喘气管炎症中的可能作用机制。
6~8周健康清洁级雌性BALB/c小鼠60只(由苏州大学实验动物中心提供),体质量(20.0±2.0)g。12 h光照,室温为22~25 ℃,湿度为40%~70%,不含致敏原的特殊饲料喂养。
鸡卵清白蛋白(OVA)、甘草酸铵、U0126、二甲基亚砜(DMSO)(美国Sigma公司);2%氢氧化铝凝胶(美国InvivoGen公司);SB203580(美国Selleck公司);阿利新蓝-过碘酸雪夫(AB-PAS)染色试剂盒(北京雷根生物技术有限公司);兔抗小鼠胞外信号调节激酶(ERK)1/2单克隆抗体、兔抗小鼠p-ERK1/2单克隆抗体(p代表磷酸化)(美国eBioscience公司);兔抗小鼠p38 MAPK单克隆抗体和兔抗小鼠p-p38 MAPK单克隆抗体(美国Cell Signaling公司);辣根过氧化酶-羊抗兔IgG、大鼠抗小鼠CD3抗体(美国Biolegend公司);二喹啉甲酸(BCA)蛋白定量试剂盒(美国Promega公司)、30%聚丙烯酰胺(美国Thermo公司)、预染蛋白质Marker(北京索莱宝科技有限公司)、6×十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)蛋白上样缓冲液(英国BioLab公司)、聚偏二氟乙烯(PVDF)膜(江苏碧云天生物技术研究所);链霉菌抗生物素蛋白-过氧化物酶(SP)免疫组化试剂盒(PV9000);二氨基联苯胺(DAB)酶底物显色试剂盒(北京中杉生物技术公司)。小鼠CD4 T细胞阳选磁珠试剂盒(德国Miltenyi Biotec公司);10%胎牛血清(FCS)1640培养基(美国Gibco公司)。402 AI超声雾化器(上海鱼跃医疗设备有限公司);图像采集系统(德国Leica公司);Image Pro Plus 6.0图像分析软件(美国Media Cybernetics公司);凝胶成像分析系统(美国Bio-Rad公司)。
适应环境1周后,按随机数字表法将60只小鼠均分为6组:(1)哮喘组:于第0、7、14天给予OVA混悬液[含OVA(V级)20 μg和氢氧化铝凝胶20 mg]0.2 ml腹腔注射致敏,第21~27天将小鼠置于20 cm×20 cm×20 cm自制雾化箱中,雾化吸人2%OVA溶液,30 min/d,以小鼠出现呼吸加快、喘息、口唇发绀、站立不稳等表现为激发成功,连续激发7 d。(2)低、高浓度甘草酸组:前期制备同哮喘组,从雾化激发开始,每日雾化前30 min,给予甘草酸(25、100 mg/kg)腹腔注射,1次/d,共7 d。(3)ERK1/2抑制剂U0126干预组和p38 MAPK抑制剂SB203580干预组:前期制备同哮喘组,从雾化激发开始,每日雾化前1 h,给予U0126(0.1 mg/kg)或SB203580(5 mg/kg)腹腔注射,1次/d,共7 d。(4)对照组:给予等量生理盐水致敏和雾化激发。
各组在末次雾化激发24 h后,按200 mg/kg腹腔注射2%戊巴比妥钠溶液,固定于操作台,取右肺组织,置于10%多聚甲醛溶液中固定,常规石蜡包埋、切片;取左肺组织,迅速置入液氮中,然后保存在-80 ℃冰箱中行Westem印迹法检测。
石蜡切片脱蜡水化后行HE染色,脱水,透明,封片,光镜下观察比较各组小鼠气道炎症浸润情况。
石蜡切片脱蜡水化后行AB-PAS染色,光镜下观察比较各组小鼠气管上皮杯状细胞增生改变及黏液分泌情况。
严格按试剂盒说明方法操作。取右肺组织切片常规脱蜡、水化,高压加热沸腾修复抗原,3% H2O2去离子水以阻断内源性过氧化物酶活性,分别滴加兔抗小鼠ERK1/2抗体(1∶100)、兔抗小鼠p-ERK1/2抗体(1∶50)、兔抗小鼠p38 MAPK抗体(1∶100)和兔抗小鼠p-p38 MAPK抗体(1∶50)50 μl(一抗),室温孵育1 h,滴加生物素标记的山羊抗小鼠IgG 50 μl(二抗),室温孵育30 min,PBS冲洗2 min×3次,每张切片滴加DAB显色剂100 μl,室温显色,镜下控制反应时间,PBS洗涤,苏木精复染,常规脱水,透明,中性树胶封片。阳性染色结果判定:用Image Pro Plus 6.0图像分析系统采集显微镜下图像,以终末支气管、呼吸性支气管上皮或肺泡上皮细胞、淋巴细胞染成棕黄色为免疫组化阳性染色,在光镜10×40放大倍数下每张切片随机选取3个视野摄片,测量并分析每张图片的吸光度值以及图片中表达阳性区域的面积并计算平均吸光度值(吸光度值/阳性区域的面积),取算术平均数表示。
将超低温冻结的小鼠肺组织适量,迅速转移至用液氮预冷的研钵中研磨,加入500 μl预冷的PBS,充分匀浆,4 ℃ 14 000 r/min离心5 min(离心半径82 mm),弃上清。加入适量蛋白裂解液,冰上裂解30 min,4 ℃ 14 000 r/min离心20 min,取上清,BCA蛋白质定量法测定蛋白浓度,取等量蛋白30 μl行SDS-PAGE凝胶电泳,转膜至PVDF膜,2 h,5%脱脂牛奶室温封闭2 h。在4 ℃下加相应一抗(1∶1 000)与膜接触孵育过夜,用洗膜缓冲液在脱色摇床下洗膜15 min×3次,用2%BSA/TBST缓冲液稀释辣根过氧化物酶偶联的二抗(1∶5 000),室温下孵育2 h后,TBST洗膜,加入增强化学发光蛋白(ECL)在室温下反应3 min后成像,采用Image Pro Plus 6.0图像分析软件以β-肌动蛋白为内参定量分析ERK1/2和p38 MAPK条带相对灰度值。
无菌条件下取出哮喘小鼠脾脏,置于预冷的1640培养基中,注射器针芯研磨后过滤,获得细胞悬液。磁珠分离的CD4+ T细胞用10%FCS 1640培养基重悬计数,按照2×105个/孔铺板,分组如下:对照组、抗CD3单抗(1 μg/ml)激发组(CD3组)、抗CD3单抗加10 μg/ml甘草酸干预组(低浓度甘草酸组)、抗CD3单抗加100 μg/ml甘草酸干预组(高浓度甘草酸组)、抗CD3单抗加10 μmol/L SB203580干预组(SB203580组)、抗CD3单抗加10 μmol/L U0126干预组(U0126组),每孔总容量为200 μl。各组于37 ℃ CO2细胞培养箱培养72 h,收集细胞行Western印迹检测。复孔数为3。
采用SPSS 17.0统计软件分析,正态分布的计量数据以 ±s表示,组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD法,若方差不齐,则作非参数Kruskal Walli′s检验,以P<0.05为差异有统计学意义。
±s表示,组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD法,若方差不齐,则作非参数Kruskal Walli′s检验,以P<0.05为差异有统计学意义。
对照组气管周围无炎症细胞浸润,肺泡结构完整;哮喘组气管黏膜充血水肿,气管、血管周围有大量炎症细胞浸润,肺泡结构破坏;各干预组气道炎症反应较哮喘组减轻(图1)。
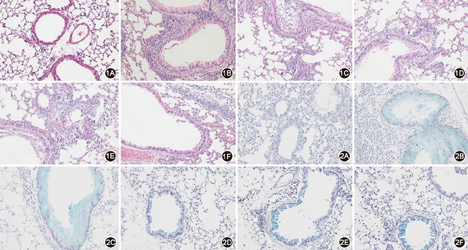

注:1A~1F、2A~2F分别为对照组、哮喘组、低浓度甘草酸组、高浓度甘草酸组、U0126组和SB203580组HE、AB-PAS染色结果(×200)
对照组气管上皮杯状细胞化生极少;哮喘组肺组织气管上皮杯状细胞化生增多,管腔黏液高分泌;各干预组皮杯状细胞化生及黏液分泌较哮喘组减轻(图2)。
ERK1/2、p-ERK1/2、p38和p-p38 MAPK免疫组化染色均主要表达在淋巴细胞和上皮细胞的胞质和细胞核内。哮喘组肺组织p-ERK1/2和p-p38 MAPK表达均显著高于对照组(均P<0.05),甘草酸干预组肺组织p- ERK1/2和p-p38 MAPK表达低于哮喘组,此作用在高浓度甘草酸组中尤其明显(均P<0.05);U0126组p-ERK1/2表达和SB203580组p-p38 MAPK表达均显著弱于哮喘组(均P<0.05),而各组之间ERK1/2和p38 MAPK表达差异均无统计学意义(均P>0.05)(图3,图4,图5,图6,表1)。
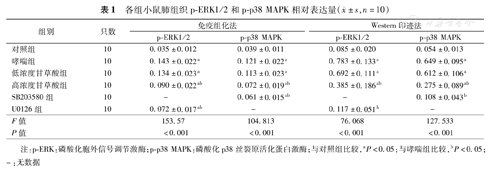
各组小鼠肺组织p-ERK1/2和p-p38 MAPK相对表达量( ±s,n=10)
±s,n=10)
各组小鼠肺组织p-ERK1/2和p-p38 MAPK相对表达量( ±s,n=10)
±s,n=10)
| 组别 | 只数 | 免疫组化法 | Western印迹法 | ||
|---|---|---|---|---|---|
| p-ERK1/2 | p-p38 MAPK | p-ERK1/2 | p-p38 MAPK | ||
| 对照组 | 10 | 0.035±0.012 | 0.039±0.011 | 0.085±0.020 | 0.054±0.013 |
| 哮喘组 | 10 | 0.143±0.022a | 0.121±0.022a | 0.783±0.133a | 0.649±0.095a |
| 低浓度甘草酸组 | 10 | 0.134±0.023a | 0.113±0.023a | 0.692±0.111a | 0.612±0.106a |
| 高浓度甘草酸组 | 10 | 0.090±0.022ab | 0.072±0.019ab | 0.385±0.186ab | 0.275±0.089ab |
| SB203580组 | 10 | - | 0.061±0.015ab | - | 0.108±0.043b |
| U0126组 | 10 | 0.072±0.017ab | - | 0.117±0.051b | - |
| F值 | 153.57 | 104.813 | 76.068 | 127.533 | |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | |
注:p-ERK:磷酸化胞外信号调节激酶;p-p38 MAPK:磷酸化p38丝裂原活化蛋白激酶;与对照组比较,aP<0.05;与哮喘组比较,bP<0.05;-:无数据
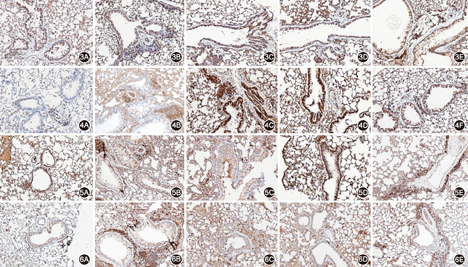

注:3A~3E、4A~4E分别为对照组、哮喘组、低浓度甘草酸组、高浓度甘草酸组和U0126组胞外信号调节激酶(ERK)1/2、磷酸化ERK(p-ERK)1/2免疫组化染色结果(×200);5A~5E、6A~6E分别为对照组、哮喘组、低浓度甘草酸组、高浓度甘草酸组和SB203580组p38、磷酸化p38丝裂原活化蛋白激酶(p-p38 MAPK)免疫组化染色结果(×200)
哮喘组肺组织p-ERK1/2和p-p38 MAPK表达均显著高于对照组(均P<0.05),甘草酸干预组肺组织p-ERK1/2和p-p38 MAPK表达低于哮喘组,此作用在高浓度甘草酸组中尤其明显(均P<0.05)。U0126组p-ERK1/2表达和SB203580组p-p38 MAPK表达均显著低于哮喘组(均P<0.05),而各组之间ERK1/2和p38 MAPK的表达差异均无统计学意义(均P>0.05)(表1)。
体外实验中,CD3组p-ERK1/2和p-p38 MAPK表达均显著高于对照组(均P<0.05),高浓度甘草酸干预组p-ERK1/2和p-p38 MAPK表达均显著低于CD3组(均P<0.05);U0126组p-ERK1/2和SB203580组p-p38 MAPK表达均显著低于CD3组(均P<0.05);而各组间ERK1/2和p38 MAPK表达差异均无统计学意义(均P>0.05)(表2)。
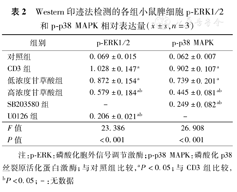
Western印迹法检测的各组小鼠脾细胞p-ERK1/2和p-p38 MAPK相对表达量( ±s,n=3)
±s,n=3)
Western印迹法检测的各组小鼠脾细胞p-ERK1/2和p-p38 MAPK相对表达量( ±s,n=3)
±s,n=3)
| 组别 | p-ERK1/2 | p-p38 MAPK |
|---|---|---|
| 对照组 | 0.069±0.015 | 0.062±0.007 |
| CD3组 | 1.028±0.147a | 0.902±0.107a |
| 低浓度甘草酸组 | 0.872±0.154a | 0.739±0.201a |
| 高浓度甘草酸组 | 0.579±0.184ab | 0.445±0.081ab |
| SB203580组 | - | 0.249±0.082ab |
| U0126组 | 0.206±0.021ab | - |
| F值 | 23.386 | 26.908 |
| P值 | <0.001 | <0.001 |
注:p-ERK:磷酸化胞外信号调节激酶;p-p38 MAPK:磷酸化p38丝裂原活化蛋白激酶;与对照组比较,aP<0.05;与CD3组比较,bP<0.05;-:无数据
哮喘是一种异质性疾病,其发病机制复杂,临床上患者具有不同的严重程度和对各种药物不同的治疗反应,即使按照GINA的规范化治疗,仍然有约10%的患者得不到有效控制[4,5]。
甘草酸具有抗炎、抗变态反应以及免疫调节等作用,并具有安全无毒的特点[3]。研究表明,甘草酸及其衍生物可抑制慢性哮喘小鼠模型的气道炎症和气道重构,对Th1/2偏移有调节作用[6,7]。前期研究表明,甘草酸可能通过下调树突细胞表面分子的表达,抑制OX40/OX40L共刺激途径,从而抑制Th2极化反应,降低过敏性哮喘小鼠的气道高反应和减轻气道炎症[8,9]。
MAPK是一组细胞内广泛分布的丝氨酸/苏氨酸蛋白激酶。研究表明,MAPK信号途径参与细胞增殖、分化、炎症反应及凋亡等生理过程,在调节固有免疫及适应性免疫方面发挥重要作用,与许多疾病的发生和发展密切相关[10]。目前发现在哺乳动物细胞中有三种MAPK:ERK、c-Jun氨基末端激酶(JNK)和p38蛋白激酶。ERK主要有ERK1和ERK2(ERK1/2)两种,有研究表明ERK磷酸化级联活化过程调节多种炎症蛋白基因的表达,是哮喘气道慢性炎症和气道高反应性重要的调控因子[11,12]。p38 MAPK包括α、β、γ和δ四个亚型,在应激条件下,p38 MAPK激活后由胞质转移到胞核,通过磷酸化激活各种转录因子调控相关基因的表达。研究表明,p38 MAPK调节Th1/Th2相关免疫反应,促进气道中性粒细胞和嗜酸粒细胞迁移,增加气道平滑肌收缩力,释放基质金属蛋白酶,促进气道平滑肌的增殖引起气道结构重塑[13,14,15,16]。p38 MAPK与激素抵抗或激素非敏感性哮喘有关,针对p38γ和p38α/β治疗被认为能恢复对激素的敏感性[17]。选择性靶向作用于ERK1/2和p38 MAPK的治疗被认为在影响疾病的严重度和疾病进展方面发挥重要的作用。
本实验用免疫组化法和Western印迹法检测小鼠肺组织ERK1/2和p38 MAPK的表达及活性,结果显示哮喘小鼠肺组织中p-ERK1/2和p-p38 MAPK表达均显著高于对照组,证实了在哮喘发病过程中存在ERK1/2和p38 MAPK信号通路的激活。分别应用U0126和SB203580干预后,哮喘小鼠气道的炎症细胞浸润、杯状细胞增生和黏液高分泌等过敏性炎症的特征性反应均减弱,进一步证实ERK1/2和p38 MAPK参与了该病的发生和发展。在高剂量甘草酸干预组也出现了相似的结果,腹腔注射剂量为100 mg/kg的甘草酸能抑制ERK1/2和p38 MAPK的激活,肺组织内ERK1/2和p38 MAPK磷酸化水平下降。在体外实验中,浓度为100 μg/ml的甘草酸能抑制哮喘小鼠CD4+T淋巴细胞的p-ERK1/2和p-p38 MAPK表达。
综上所述,哮喘小鼠存在ERK1/2和p38 MAPK信号通路激活,推测甘草酸可能通过抑制ERK1/2和p38 MAPK信号通路,减轻哮喘小鼠气管炎症。作为一个具有免疫调节作用的中药单体,甘草酸的作用可能会有多个靶点,其是直接作用于MAPK信号通路还是通过MAPK途径的上游信号发挥作用?这仍需进一步研究。



























