
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
偏侧舞蹈症是指由近端和远端肌肉收缩造成的,局限于一侧肢体及面部快速的、不规则的、无意识的舞蹈样动作,主要继发于糖尿病、卒中、脑肿瘤、脑皮质变性、风湿热、外伤以及丘脑术后等。卒中后偏侧舞蹈症大多由锥体外系的基底神经节或丘脑底核病变导致。国外罕见额叶或枕叶梗死致偏侧舞蹈病例报道,目前国内未见皮质区卒中致偏侧舞蹈相关报道,现将我们收治的1例表现为额叶皮质微小梗死灶的急性偏侧舞蹈症报道如下。
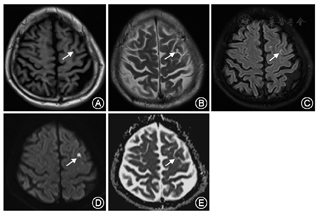
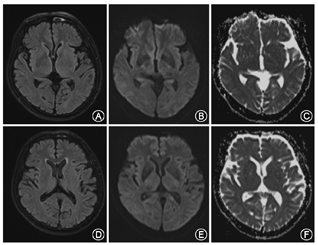
患者男性,65岁,以"右侧肢体不自主运动3 d"为主诉于2017年5月20日入我院。患者3 d前无明显诱因出现右侧肢体无意识、不规则的画图样运动,其特点为臂内旋、肘膝关节屈曲、足背屈样偏身不自主运动,鼻唇沟变浅,额纹未消失,右上肢麻木,紧张感。既往有高血压病史10余年,血压最高达160/90 mmHg(1 mmHg=0.133 kPa);否认吸烟饮酒史以及毒物接触史,否认糖尿病史以及神经变性疾病的家族史。神经系统体检示:意识清楚,语言流利,反应灵敏,双侧瞳孔等大同圆,对光反射灵敏,颈强直阴性;四肢肌力正常,足底略屈曲,左侧肢体肌张力正常,右侧肢体肌张力减弱;双侧肱二头肌、肱三头肌反射正常,双侧膝腱、跟腱反射正常,双侧巴宾斯基征、双侧霍夫曼征未引出;振动觉、位置觉、轻触觉、痛觉等未见明显异常。实验室检查结果:血清甘油三酯2.36 mmol/L(正常值0~1.70 mmol/L),血清总胆固醇6.91 mmol/L(正常值0~5.72 mmol/L),血糖、血清电解质、尿糖、尿酮体、铜蓝蛋白及甲状旁腺激素等均未见明显异常。颅脑CT平扫(64排)未见明显异常。胸片及心电图示无明显异常。颅脑MRI示:左侧额中回类圆形长T1、长T2信号影;液体衰减反转恢复序列(FLAIR)高信号影(图1A~C)。弥散加权成像(DWI)示左侧额中回皮质区类圆形极高信号影,表观弥散系数(ADC)在同一位置呈低信号影(图1D、图1E);提示该患者左侧额叶急性梗死。同时,基底神经节、丘脑以及丘脑底核未见异常信号影(图2)。因此给予患者改善循环、营养神经、联合抗血小板、降脂稳定斑块等综合治疗,另给予患者氯硝西泮0.5 mg,3次/d,口服;硫必利50 mg,3次/d,口服。出院2个月后随访,患者不自主运动,鼻唇沟变浅等症状消失,且未出现额外的非自主运动,右侧肢体麻木、紧张感缓解。


运动障碍性疾病作为卒中的临床表现罕见报道[1]。卒中后运动障碍可表现在运动功能减退综合征,特别是血管性帕金森综合征或广泛的过动症中,如舞蹈病、颤搐、手足徐动症、肌张力障碍、震颤、肌阵挛、刻板和静坐不能,其中最常见的是偏侧舞蹈症,其次为肌张力障碍[2]。卒中后运动障碍的自然史和进程是变化多样的,可发生在卒中发病最初的5 d里,通常作为卒中的起始和唯一表现;也可以延迟或进展为卒中永久的表现,潜伏期通常是2周至4年[3,4]。本例患者即是以偏侧舞蹈症作为皮质微小急性梗死的首发表现。目前,大量的神经病理和神经影像学研究支持基底神经节在运动障碍性疾病的病理生理过程中起重要作用,其中最常见的是豆状核病变[5]。锥体外系是由多种神经元构成的不同功能的复杂环路,不同功能的神经元相互拮抗、调整,以维持功能的平衡,其主要通路是皮质纹状体-苍白球-丘脑-皮质环路,病变波及环路的任一部分均可能诱发偏侧舞蹈症[6]。基底神经节和丘脑结构损害或功能改变常被认为是卒中后肌张力障碍的核心问题。偏侧舞蹈症的病理生理学与该结构的直接和间接通路有关:直接通路病变可以减少对丘脑的抑制作用,从而有利于运动;间接通路包括外部苍白球和丘脑底核,其病变可抑制运动。通常,丘脑底核可刺激内部苍白球和黑质,当苍白球到丘脑传出抑制信号时,丘脑与运动皮质的活动被抑制,出现正常的可控动作[7,8,9]。因此,在传统的偏侧舞蹈症中,丘脑底核损坏可使间接通路被抑制,与直接通路产生协同作用,导致不可抑制的偏侧投掷或偏侧舞蹈。然而,卒中后锥体外系症状并不完全与基底节功能障碍有关,基底节外的损伤破坏了小脑、纹状体、丘脑和皮质之间高度组织化的复杂相互作用,也可引起锥体外系表现[10]。目前的研究表明,皮质区病变对偏侧舞蹈症的发病机制有独立的贡献,甚至没有明显的基底神经节和丘脑受累[11]。
额叶主要功能与随意运动和高级精神活动有关,其主要功能区包括皮质运动区,运动前区以及皮质侧视中枢等。既往研究常提示额叶功能障碍可导致痴呆、癫痫、眼球运动障碍、把握和摸索反射、人格改变等[12]。目前,偏侧舞蹈症继发于皮质梗死十分罕见,国外可见额叶和顶叶受累致偏侧舞蹈或偏侧投掷的个案报道,额中回梗死致偏侧舞蹈症国内未见报道[13]。皮质运动区(中央前回)前方,即运动前区是锥体外系的皮质中枢,发出纤维到丘脑、基底神经节和红核,与运动和姿势协调有关;额叶脑桥小脑束也在这个区域,与协调运动有关。在临床上,我们常常观察到影像学发现皮质有较大的梗死灶,而临床未出现不自主运动的表现;抑或DWI序列仅表现微小的弥散受限信号影,而没有任何临床症状和体征。本例患者仅为额叶皮质微小梗死灶所致急性偏侧舞蹈症,我们认为尽管该患DWI提示在皮质仅有一个极小的梗死灶,但可能还存在着皮质下,甚至底节区有低灌注的可能,所以才产生对侧面肌轻度无力和上下肢广泛的不自主运动的表现。任何发生在皮质到脑干运动系统的卒中,无论病因分型或病变大小均可出现卒中后不自主运动[14]。然而,没有任何一种卒中后运动障碍类型可归因于特定的病灶位置,颅脑磁共振成像可更精确的定位受累的结构,使每个综合征可具体到病变类型。目前,有报道认为各种过多或过少运动障碍可归因于分水岭或边缘区梗死,其与发生在位于不同动脉供血的血管边界之间的低灌注区,影响额叶皮质下区伴或不伴有纹状体受累有关[15]。
脑梗死所致的偏侧舞蹈症可通过损伤协调作用大大增加发病率,因此需短期治疗。虽然卒中所致的运动障碍通常具有自限性,但与常见类型脑梗死不同,除由于低灌注血流动力学导致的肢体抖动综合征需要紧急手术治疗外,其余运动障碍首先应对症治疗[2]。药物治疗主要包括抗多巴胺疗法:通过阻断多巴胺受体起作用的传统和新型抗精神病药物,如氟哌啶醇、奥氮平等[16]。这些药物虽然有效,但具有药物诱发帕金森病和迟发性运动障碍的风险,因此,多巴胺耗竭剂——四苯喹嗪成为该病最好的选择,因为它不引起迟发性运动障碍[17]。氯硝西泮、丙戊酸钠以及托吡酯成功治疗该病也可见报道[3]。本例患者给予氯硝西泮以及硫必利控制症状,症状消失后停药,2个月后随访患者舞蹈症状消失,且未出现额外的不自主运动。有报道称,立体定向毁损以及丘脑核腹侧后部或中间的深部脑刺激似乎使难治性脑卒中后偏侧舞蹈症得到良好控制[18,19]。卒中后运动障碍的功能预后取决于运动障碍的类型。一项20例偏侧舞蹈症患者的研究显示,应用1或2种上述药物症状完全恢复的患者占45%~56%,部分缓解患者占37%~45%[20]。另一项56例局灶性舞蹈症或偏侧舞蹈症研究显示,11%的患者可自发地完全恢复,83%患者部分恢复[4]。
总之,偏侧舞蹈症可发生在脑卒中的急性期,亦可位于额中回等皮质区,不单单局限于基底节区和丘脑底核病变。该病具有自限性,与常见类型脑梗死不同,首先应对症治疗。本例报道可以提高临床对偏侧舞蹈症的认识,为缺血性卒中后偏侧舞蹈症的诊断与治疗提供新思路。
无


























