
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,44岁。因右附件占位于2017年4月就诊于四川大学华西第二医院。患者3年前在外院腹腔镜下行右侧卵巢囊肿剥除术,术后病理诊断为成人型粒层细胞瘤,1年前B型超声检查提示右附件占位,大小1.8 cm×1.0 cm×1.0 cm,定期复查发现右附件占位逐渐长大,20 d前CT提示右附件囊实性占位,大小6.3 cm×6.3 cm×4.0 cm,盆腹腔多处结节影,并见右侧"卵巢血管蒂"征,有肿瘤复发可能。术前血清肿瘤标志物检查:CA125、CA19-9、癌胚抗原(CEA)和甲胎蛋白(AFP)均在正常范围内。行剖腹探查,术中见血性腹水100 mL,右附件区包块大小7 cm×6 cm×5 cm,未见正常卵巢组织,腹腔内广泛分布粟粒样、菜花样质脆新生物。术中取腹腔结节送检,冷冻切片报告为低分化恶性肿瘤。患者于全麻下行经腹全子宫切除术+双附件切除术+盆腔淋巴结清扫术+腹主动脉旁淋巴结清扫术+恶性肿瘤细胞减灭术。
病理检查:(1)血性腹水标本:100 mL,均分为2份,1份取沉淀液涂抹常规涂片,HE染色,剩余沉淀物用于制作细胞块;另1份沉淀物用于液基薄层细胞制片,巴氏染色。镜下观察:常规细胞涂片中可见在多量增生的间皮细胞和淋巴细胞的背景上,肿瘤细胞松散或紧密聚集成团,其细胞较小,胞质稀少,红染,核圆、卵圆形或梭形,核无明显异型性,染色质细腻,小核仁,核膜清楚,部分细胞有纵行核沟(图1),未见明显核分裂象(图4)。还可见一些裸核细胞。在薄层液基细胞制片中可见细胞形态与常规涂片一致,但背景更加干净,肿瘤细胞较为集中(图2)。(2)送检标本:右附件占位大小7 cm×6 cm×5 cm,囊实性,实性区为主,切面灰白/灰黄,灶性出血。在细胞块中可见肿瘤细胞较涂片和液基制片更为集中,部分区域可见Call-Exner小体(图3)。肿瘤细胞对α-抑制素、Calretinin、CD56、S-100蛋白、WT1均阳性表达,对上皮细胞膜抗原(EMA)阴性表达。右附件占位肿瘤细胞呈岛状或梁索状排列,部分区域呈滤泡状排列。肿瘤细胞呈多角形、圆形或梭形,胞质较少,红染,胞界不清楚。核圆或卵圆形、梭形,核膜清楚,部分细胞核内有一小核仁,部分细胞有纵行核沟,未见明显核分裂象(图4)。肿瘤细胞免疫表型与细胞块一致。
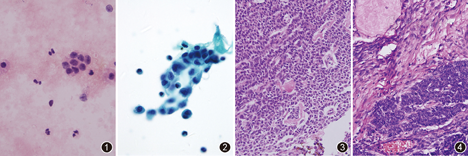

病理诊断:右侧卵巢粒层细胞瘤复发伴转移,腹水中查见肿瘤细胞。
随访:术后患者己接受多个疗程化疗,随访8个月,生命体征平稳,未见肿瘤复发。
卵巢粒层细胞瘤(ovarian granulosa cell tumor,OGCT)是常见的卵巢性索-间质来源的肿瘤,其发病率占所有卵巢恶性肿瘤的2%~5%,根据2014版WHO女性生殖器官肿瘤分类,OGCT分为成人型粒层细胞瘤(adult granulosa cell tumor, AGCT)和幼年型粒层细胞瘤(juvenile granulosa cell tumor, JGCT),分别占比95%和5%。AGCT的总体复发率为20%~30%,复发或转移通常在初诊5年后发生,但是一些病例可能会在20年后发生远期复发[1,2,3]。
对浆膜腔积液开展细胞学检查有利于对肿瘤进行更准确的临床分期,只有极少的英文文献报道了盆腹腔积液中粒层细胞瘤的细胞学特征[4,5,6,7,8,9,10],中文文献中未检索出报道。我们报道了1例成年型粒层细胞瘤的腹水细胞学特点,并复习相关文献,以提高对该肿瘤的认识水平。在胸腹水或盆腔冲洗液中进行细胞学检查对于肿瘤的准确分期是非常重要的,但是对于不常见肿瘤,其脱落肿瘤细胞的诊断常常是非常困难的。传统常规涂片检查中由于制片缺陷,存在细胞重叠、细胞的成分较少、检出率偏低等不足。近年来,采用液基薄层细胞检测系统对胸腹水细胞学样本进行处理,改善了传统制片方式的缺陷,但是对少见肿瘤、可疑肿瘤标本、反应性间皮细胞以及间皮瘤等鉴别准确率较低,只能采用免疫组织化学等方法进行深入检查。送检的胸腹水细胞学样本在完成常规涂片或液基细胞学检查后,在剩余的标本中还有大量细胞,通过对剩余的标本作进一步处理制作成细胞块能够进行石蜡切片,同时可以完成免疫组织化学染色,从而提高胸腹水恶性细胞的检出率和诊断的准确性。
对于成人型粒层细胞瘤,只检索出数篇英文文献,总计17例,对其在腹水或盆腔冲洗液中的细胞学特征进行了描述,其出现的概率由多到少依次为:肿瘤细胞松散或紧密聚集(17/17)、富于细胞(15/16)、小核仁(11/12)、裸核细胞(12/14)、核沟(13/17)和Call-Exner小体(9/17)[4,5,6,7,8,9,10]。这其中最重要的诊断线索是核沟和Call-Exner小体。鉴别诊断包括类癌、小细胞癌、未分化癌、Brenner瘤和甲状腺乳头状癌。类癌肿瘤细胞染色较深,没有核沟,染色质呈粗颗粒状,核仁不明显,胞质嗜酸。肿瘤细胞对CgA、突触素和CD56阳性表达[4,9]。小细胞癌肿瘤细胞核浓染,没有核沟,核仁明显,胞质稀少,核分裂象易见[9]。未分化癌肿瘤细胞异型性大,细胞核浓染,核沟罕见,核仁不明显,核分裂象易见[5]。具有核沟并不是粒层细胞瘤肿瘤细胞才具有的特点,Brenner细胞瘤也可出现这种特点,仅进行细胞学检查无法准确区分这2种肿瘤,制成细胞块并完成免疫组织化学检测有助于鉴别诊断。AGCT对α-抑制素或Calretinin阳性表达,而Brenner瘤通常对uroplakin Ⅲ阳性表达[4,6]。甲状腺乳头状癌肿瘤细胞也可出现核沟,但具有核内包涵体,甲状腺球蛋白阳性表达[11]。此外,AGCT具有远期复发的可能性,发生复发的患者距离其初诊的最长时间为21年,部分患者的复发、转移部位较为罕见,如乳腺、脾脏、肝脏和肺,尤其后两者可能会产生浆膜腔的积液,在进行细胞学诊断时一定要注意结合病史,加强鉴别诊断,避免误诊[3]。在本例中,腹水涂片中核沟、裸核细胞等特征容易观察到,但没有找到典型的Call-Exner小体,因此结合临床病史,收集腹水或腹腔冲洗液制成细胞块并完成免疫组织化学检测,才能作出正确的诊断,有利于判断预后。


























