版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,来自携带遗传风险的人群和临床认知正常的老年人的荟萃证据表明,阿尔茨海默病(Alzheimer′s disease, AD)的发生是一个连续的病理过程,这一进程在临床诊断为痴呆的多年前就已经开始[1]。由于针对AD痴呆期的新药临床试验屡屡失败,研究人员逐渐认识到AD研究的重点应该转移到AD痴呆前阶段。
2011年在美国国立老化研究所和阿尔茨海默病协会(NIA-AA)制定的AD新的诊断标准中明确提出了AD临床前阶段的概念[2]。AD痴呆阶段是指AD病理生理发展到一定程度而出现临床症状的时期,相当于传统意义上的AD,而AD痴呆前阶段(pre-dementia stage)是一个新的概念,此阶段可有AD病理生理改变,无或有临床症状,包括临床前AD(preclinical stages of AD)和AD源性轻度认知功能障碍(mild cognitive impairment due to AD,MCI due to AD)。将临床前AD和AD源性轻度认知障碍合称为AD痴呆前阶段的意义在于:(1)与临床前AD和AD源性轻度认知障碍的概念相比,AD痴呆前阶段的概念更容易理解,有利于唤起研究人员和公众对这一阶段的重视;(2)目前对AD的干预研究主要是前移至临床前AD和AD源性轻度认知障碍阶段,而这两个阶段都包含在AD痴呆前阶段的概念中。
临床前AD是AD发生的最早期,此期没有认知障碍的临床表现或者仅有极轻微的记忆力减退主诉,部分患者有家族遗传史,可通过脑脊液或影像学检查如PET淀粉样蛋白成像来诊断[3]。需要指出的是,目前临床前AD的概念和框架主要用于科研和药物临床试验,不宜用于临床诊断,一方面是目前临床前AD的诊断方法仍不成熟,另一方面临床前AD的患者只是进入了AD病理生理进程的早期,在患者的有生之年并不一定会发展为AD,如果冠以临床前AD的诊断,会引起不必要的压力和恐慌。
神经生物学和分子影像学等研究领域的最新进展提供了在活体体内检测AD病理生理过程的方法,这包括Aβ在脑内的沉积、脑脊液中Aβ和tau蛋白含量与修饰的动态变化等。这些变化已被证实出现于认知正常的老年人,并且表现出与轻度认知障碍和AD痴呆患者相同的模式。
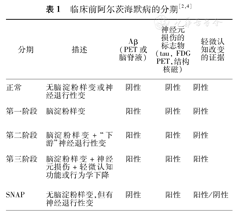
2011年,美国国立老化研究所与阿尔茨海默病协会正式提出了临床前AD的概念性框架和用于研究的标准[2]。该标准对临床前AD进行了分期,包括第一阶段,无症状脑淀粉样变的阶段;第二阶段,淀粉样蛋白阳性+突触功能障碍和(或)早期神经退行性变阶段;第三阶段,淀粉样蛋白阳性+神经退行性变的证据+极轻微的认知下降[2](表1)。该标准强调了生物标志物在临床前AD早期诊断中的价值:通过PET淀粉样蛋白显像上示踪剂保留增多和(或)脑脊液中Aβ42含量下降来追踪脑内淀粉样变,通过脑脊液tau或磷酸化tau水平增高、FDG-PET脑内AD样代谢减低以及特定解剖分布(顶叶后部和中部、后扣带回和后颞叶)的灰质丢失、海马萎缩来追踪早期神经退行性变。
研究人员随后又对该框架和分期做了补充[4],增加了正常组和可疑非AD病理组(suspected non-Alzheimer pathology,SNAP)。正常组没有任何脑淀粉样变或神经退行性变的证据,而SNAP组患者有神经退行性变的影像学或生物标志物的改变,但没有脑淀粉样变的证据。SNAP组患者能够占到认知正常的老年人队列的四分之一[4,5],对于研究非淀粉样蛋白致病机制在AD发病中的作用具有重要意义。
2007年的IWG和2014年的IWG-2诊断标准对临床前AD也做了详细描述[6,7,8]。该标准将临床前AD分为两种亚型,即AD无症状风险期(asymptomatic at-risk state for AD)和AD症状前期(presymptomatic AD)。AD无症状风险期是指已经有了脑淀粉样变和神经退行性变的影像学或生物标志物的客观证据,但患者的临床表现和神经心理学检查仍未达到MCI的标准。这部分患者尽管脑内已经开始了AD的病理生理进程,但在有生之年并不一定会进展为AD,所以称为AD无症状风险期。而AD症状前期特指携带了PSEN1、PSEN2、APP等常染色体显性遗传致病基因突变或其他致病遗传基因(包括21三体综合征),但未达到MCI诊断标准的患者。由于这部分患者必定会发展为AD,所以称之为AD症状前期。
两个诊断标准对临床前AD的分类和描述方法尽管存在差异,但都同样强调了AD存在一个临床无症状,但脑内已经开始了AD病理生理进程的阶段,这一阶段在临床症状出现前的20~25年就已经开始。NIA-AA标准对临床前阶段的分期和描述更为详细,同时包括了正常组和SNAP组,更适用于临床前AD研究的开展。
AD痴呆前阶段概念的提出对AD的早期预警具有重要意义。一方面,在这个阶段,神经元还没有大量凋亡,疾病进程在一定程度上是可逆的[9]。另一方面,如同心脑血管病、糖尿病等其他慢性病的早期筛查,如果能够在临床症状出现前对患者进行识别,就有望大大延缓疾病的进展。一项研究显示,如果能将AD的发病延迟5年,将可使AD的患者数目减少57%,将医疗费用从6 270亿美元减少到3 440亿美元[2]。
AD痴呆前阶段的早期识别为AD的早期干预提供了可能,目前国际上已经启动了多个针对AD痴呆前阶段的早期药物干预研究。这些研究大部分是使用无症状的AD高遗传风险的个体作为研究对象,如美国的DIAN-TU研究正在验证两种不同的Aβ单克隆抗体,solanezumab和gantenerumab,对携带有PSEN1、PSEN2和APP致病基因突变的个体的早期干预效果[10]。API(Alzheimer′s Prevention Initiative)研究以哥伦比亚的PSEN1家系和携带有APOE ε4纯合子的高遗传风险个体作为干预对象,验证Aβ的另一种单克隆抗体crenezumab的治疗作用[11]。A4(Anti-Amyloid Treatment in Asymptomatic Alzheimer′s Disease)研究则以非AD高遗传风险人群为干预对象,通过Aβ/tau PET和脑脊液生物标志物来识别AD痴呆前阶段个体,进而验证solanezumab在这些AD痴呆前阶段个体中的早期干预作用[12]。这些针对AD痴呆前阶段开展的早期干预研究将有望找到能够改变AD疾病进程的治疗药物。
另一方面,尽管我们目前还没有能够改变AD疾病进程的药物,我们仍可通过指导患者早期控制胆固醇、血压、糖尿病等与AD发生发展密切相关的血管性危险因素,健康饮食,早期开展认知功能和体力锻炼,来延缓AD的发生和发展。一系列的回顾性研究、前瞻性研究和荟萃分析都已证实中年期的高血压[13]、高胆固醇血症[14]、糖尿病[15]和腹型肥胖[15]均会导致AD发病风险显著增高,吸烟[16]和大量饮酒[17]也是AD发病的重要危险因素,因此在AD痴呆前阶段,特别是中年期加强对这些危险因素的控制将有望降低AD发病的风险,延缓AD发展的进程。然而目前针对这些危险因素开展干预的随机对照临床试验(randomized controlled trials, RCTs)都是以老年期人群为研究对象,其结果未能证实控制血管性危险因素对AD发病的保护作用。如一项纳入8项RCTs的研究,共计2 282例患者的荟萃分析结果显示降压治疗并不能降低痴呆的风险[18]。三项共纳入748例50~90岁研究对象的RCTs研究也并没有显示他汀类药物对痴呆或AD发病有保护作用[19,20,21]。只有针对中年期,特别是痴呆前阶段开展干预研究,才能证实危险因素的控制对AD发病作用。
除了血管性危险因素,生活方式的调整也是AD痴呆前阶段早期干预的重要途径。地中海饮食,即主要摄入鱼类、水果蔬菜、富含多不饱和脂肪酸的橄榄油,适度饮用红酒而较少食用猪肉等红肉,已被多个研究证实能够降低AD的发病风险[22,23,24],并且这种保护作用不受体力活动和伴随的脑血管病等因素的影响(Ⅰ级证据)。一项荟萃分析研究纳入了11项以55岁以上认知功能正常的成年人为主要研究对象的RCTs研究,分析结果显示有氧体力锻炼能够改善特定认知功能,包括认知速度,以及听觉和视觉的注意力[25](Ⅰ级证据)。在认知训练方面,由于认知训练的方法一直在改进,因此RCTs的结果仍然混杂,一项纳入17项研究的荟萃分析显示,认知训练能改善MCI患者的认知功能和日常能力,尽管可能仅限于特定认知域[26]。2014年发表的ACTIVE研究进一步证实了认知训练对认知功能和日常生活能力的改善作用[27](Ⅰ级证据)。2015年发表的FINGER研究表明,将饮食调整、体力锻炼和认知训练结合起来,能够有效预防老年风险人群的认知功能下降[28](Ⅰ级证据)。
【推荐】
针对临床前AD开展早期诊断和早期干预。(专家共识)
在AD痴呆前阶段对危险因素进行干预和控制,结合认知训练有可能延缓认知功能下降。(A级推荐)
AD痴呆前阶段的饮食为地中海饮食。(A级推荐)
执笔:贾建平(首都医科大学宣武医院神经疾病高创中心,神经内科);唐毅(首都医科大学宣武医院神经内科)
统稿:赵坦(首都医科大学宣武医院神经内科)
专家委员会成员(按照姓氏笔画为序):于恩彦(浙江省人民医院精神卫生科);王延江(第三军医大学大坪医院神经内科);吕佩源(河北省人民医院神经内科);纪勇(天津市环湖医院神经内科);杜怡峰(山东大学附属省立医院神经内科);李焰生(上海交通大学附属仁济医院神经内科);汪凯(安徽医科大学第一附属医院神经内科);张杰文(郑州大学人民医院神经内科);陈晓春(福建医科大学附属协和医院神经内科);武力勇(首都医科大学宣武医院神经内科),罗本燕(浙江大学医学院附属第一医院神经内科);周爱红(首都医科大学宣武医院神经内科);屈秋民(西安交通大学第一附属医院神经内科);贾建平(首都医科大学宣武医院神经疾病高创中心,神经内科);贾建军(解放军总医院神经内科);高晶(北京协和医院神经科);郭起浩(复旦大学附属华山医院神经内科);唐牟尼(广州市脑科医院神经内科);唐毅(首都医科大学宣武医院神经内科);章军建(武汉大学中南医院神经内科);彭丹涛(中日友好医院神经内科);谭兰(青岛市市立医院神经内科);魏翠柏(首都医科大学宣武医院神经内科)