
探讨超声造影(CEUS)检查对提高乳腺第5版乳腺影像报告和数据系统(BI-RADS) 4类肿块良恶性诊断的价值。
收集2016年1月至2017年12月在山西医科大学第一医院就诊患者72例,最终经穿刺活检或手术病理结果确诊的乳腺肿块共79个。根据常规超声对所有肿块行BI-RADS分类,并行CEUS检查。根据CEUS预测模型结果,重新判定乳腺BI-RADS 4类肿块良恶性:(1)常规超声BI-RADS分类+CEUS预测模型:两者均提示恶性时诊断为恶性;(2)利用CEUS预测模型重新调整BI-RADS分类:若为恶性CEUS预测模型,则上调一类,若为良性CEUS预测模型,则下调一类。比较两种方法对乳腺BI-RADS 4类肿块良恶性的诊断效能。
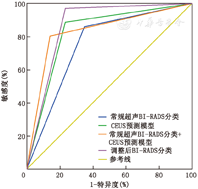
(1)79个乳腺肿块中,恶性肿块36个,良性肿块43个;常规超声BI-RADS分类、CEUS预测模型、常规超声BI-RADS分类+CEUS预测模型及调整后BI-RADS分类诊断的敏感度、特异度、准确性、阳性预测值、阴性预测值分别为86.1%、65.1%、74.7%、67.4%、84.8%;88.9%、76.7%、82.3%、76.2%、89.2%;80.6%、86.0%、83.5%、82.9%、84.1%;97.2%、76.7%、86.1%、77.8%、97.1%。(2)以病理结果为金标准,常规超声BI-RADS分类、CEUS预测模型、常规超声BI-RADS分类+CEUS预测模型及调整后BI-RADS分类ROC曲线下面积分别为0.756、0.828、0.833、0.870,调整前、后BI-RADS分类比较差异有统计学意义(Z=2.322,P<0.05)。
利用CEUS预测模型调整乳腺BI-RADS 4类肿块分类后诊断效能更高,可以减少不必要的穿刺活检。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
为进一步规范影像学评估术语和评估结果,2013年美国放射学会颁布了第5版乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS),但其中未涉及超声造影(contrast-enhanced ultrasound,CEUS)内容。该指南中BI-RADS 4类肿块恶性概率跨度大,常令临床医师感到困惑。如何利用乳腺良恶性病灶CEUS预测模型,结合常规超声BI-RADS分类,提高乳腺BI-RADS 4类肿块良恶性诊断的正确率,减少不必要的穿刺活检是本研究的目的。
收集2016年1月至2017年12月山西医科大学第一医院就诊患者72例,最终经穿刺活检或手术病理结果确诊肿块共79个。患者均为女性,年龄21~76岁,平均(46±12)岁。纳入标准:(1)常规超声BI-RADS分类4类;(2)所有乳腺肿块行超声检查前未经任何临床干预。排除标准:(1)妊娠或哺乳期妇女;(2)自身状况无法接受CEUS检查等禁忌证患者;(3)单侧乳腺肿块个数>1个的患者。本研究经伦理委员会审核通过,所有患者均签署CEUS知情同意书。
GE LOGIQ E9超声诊断仪,配备9L及ML6-15探头。超声造影剂采用声诺维。
患者仰卧位,双臂外展,充分暴露乳腺及双侧腋窝。首先选择常规超声模式,从外上象限开始,以乳头为中心,呈轮辐状沿顺时针方向分别检查双侧乳房。对乳腺肿块行多切面重点扫查,观察记录肿块大小、位置、形态、边缘、肿块内部及其后方回声特征、钙化及血流分布情况等。选择肿块血流丰富的最大切面,切换至CEUS模式,显示图像包括肿块及其周围部分正常乳腺组织。嘱患者保持体位不变,平静呼吸,经肘静脉快速团注4.8 ml造影剂,随即冲注0.9%氯化钠溶液5 ml,探头始终保持同一切面,连续实时观察并保存肿块动态灌注过程3 min。
图像由2名有经验的超声医师采用盲法独立完成阅片。两人诊断结果不一致时商议决定。(1)常规超声图像分析:根据第5版BI-RADS分类标准[1],对乳腺肿块进行分类,以4A与4B之间为诊断截点,≤4A类提示良性可能,≥4B类提示恶性可能。(2)CEUS图像分析:根据罗俊等[2]提出的乳腺良恶性病灶CEUS预测模型对乳腺肿块进行分类。恶性预测模型有以下3种:A.高增强伴增强后病灶扩大,伴或不伴有形态不规则;B.向心性高增强伴充盈缺损,伴或不变增强后增大;C.快进或同进伴高增强或等增强,出现滋养血管或蟹足征,伴或不伴充盈缺损。良性预测模型有以下3种:D.快进高增强,增强后无增大,边界清楚;E.同进或慢进,等增强,增强后难以分辨边界及形态;F.同进或慢进,低增强,增强后无增大或缩小。(3)常规超声BI-RADS分类联合CEUS预测模型方法:两者均提示恶性时诊断为恶性,其余情况视为良性。CEUS预测模型对常规超声BI-RADS分类调整方法:若为恶性CEUS预测模型,则分类上调一类,若为良性CEUS预测模型,则分类下调一类。
采用SPSS 20.0软件,计量资料用 ±s表示,计算不同方法的敏感度、特异度、准确性、阳性预测值及阴性预测值。采用Medcalc软件,以病理结果为金标准,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)。采用Z检验比较ROC曲线下面积的差异,以P<0.05为差异有统计学意义。
±s表示,计算不同方法的敏感度、特异度、准确性、阳性预测值及阴性预测值。采用Medcalc软件,以病理结果为金标准,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)。采用Z检验比较ROC曲线下面积的差异,以P<0.05为差异有统计学意义。
79个乳腺肿块中,恶性肿块36个(浸润性导管癌23个,浸润性癌6个,导管原位癌2个;浸润性小管癌1个,导管内乳头状癌1个,低级别导管内癌1个,实性乳头状癌伴浸润1个,浸润性导管癌伴高级别导管内癌1个);良性肿块43个(乳腺增生症13个,纤维腺瘤13个,乳腺增生伴纤维腺瘤形成8个,炎症反应2个,乳腺增生伴炎症反应2个,导管内乳头状瘤1个,浆细胞性乳腺炎1个,硬化性腺病1个,乳腺导管扩张症1个,乳腺导管扩张伴炎症1个)。
常规超声BI-RADS分类提示良性肿块33个,恶性肿块46个;CEUS预测模型提示良性肿块37个(D模型13个,E模型11个,F模型13个),恶性肿块42个(A模型22个,B模型9个,C模型11个);常规超声BI-RADS分类+CEUS预测模型提示良性肿块44个,恶性肿块35个;调整后BI-RADS分类提示良性肿块34个,恶性肿块45个(表1)。常规超声BI-RADS分类+CEUS预测模型及调整后BI-RADS分类诊断错误的肿块病理类型见表2。
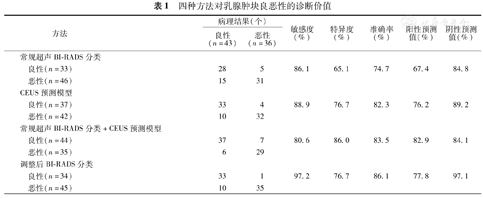
四种方法对乳腺肿块良恶性的诊断价值
四种方法对乳腺肿块良恶性的诊断价值
| 方法 | 病理结果(个) | 敏感度(%) | 特异度(%) | 准确率(%) | 阳性预测值(%) | 阴性预测值(%) | ||
|---|---|---|---|---|---|---|---|---|
| 良性(n=43) | 恶性(n=36) | |||||||
| 常规超声BI-RADS分类 | ||||||||
| 良性(n=33) | 28 | 5 | 86.1 | 65.1 | 74.7 | 67.4 | 84.8 | |
| 恶性(n=46) | 15 | 31 | ||||||
| CEUS预测模型 | ||||||||
| 良性(n=37) | 33 | 4 | 88.9 | 76.7 | 82.3 | 76.2 | 89.2 | |
| 恶性(n=42) | 10 | 32 | ||||||
| 常规超声BI-RADS分类+CEUS预测模型 | ||||||||
| 良性(n=44) | 37 | 7 | 80.6 | 86.0 | 83.5 | 82.9 | 84.1 | |
| 恶性(n=35) | 6 | 29 | ||||||
| 调整后BI-RADS分类 | ||||||||
| 良性(n=34) | 33 | 1 | 97.2 | 76.7 | 86.1 | 77.8 | 97.1 | |
| 恶性(n=45) | 10 | 35 | ||||||
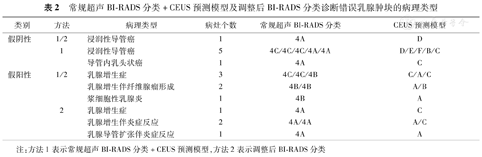
常规超声BI-RADS分类+CEUS预测模型及调整后BI-RADS分类诊断错误乳腺肿块的病理类型
常规超声BI-RADS分类+CEUS预测模型及调整后BI-RADS分类诊断错误乳腺肿块的病理类型
| 类别 | 方法 | 病理类型 | 病灶个数 | 常规超声BI-RADS分类 | CEUS预测模型 |
|---|---|---|---|---|---|
| 假阴性 | 1/2 | 浸润性导管癌 | 1 | 4A | D |
| 1 | 浸润性导管癌 | 5 | 4C/4C/4C/4A/4A | D/E/F/B/C | |
| 导管内乳头状癌 | 1 | 4A | C | ||
| 假阳性 | 1/2 | 乳腺增生症 | 3 | 4C/4C/4B | C/A/C |
| 乳腺增生伴纤维腺瘤形成 | 2 | 4B/4B | A/B | ||
| 浆细胞性乳腺炎 | 1 | 4B | A | ||
| 2 | 乳腺增生症 | 1 | 4A | C | |
| 乳腺增生伴炎症反应 | 2 | 4A/4A | A/C | ||
| 乳腺导管扩张伴炎症反应 | 1 | 4A | A |
注:方法1表示常规超声BI-RADS分类+CEUS预测模型,方法2表示调整后BI-RADS分类
常规超声分类4A、4B、4C类的乳腺肿块恶性诊断符合率分别为15.2%(5/33),43.5%(10/23),91.3%(21/23)。根据BI-RADS分类调整方法,79个乳腺肿块调整后3类25个,4A类9个,4B类11个,4C类14个,5类20个(表3)。
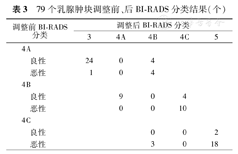
79个乳腺肿块调整前、后BI-RADS分类结果(个)
79个乳腺肿块调整前、后BI-RADS分类结果(个)
| 调整前BI-RADS分类 | 调整后BI-RADS分类 | |||||
|---|---|---|---|---|---|---|
| 3 | 4A | 4B | 4C | 5 | ||
| 4A | ||||||
| 良性 | 24 | 0 | 4 | |||
| 恶性 | 1 | 0 | 4 | |||
| 4B | ||||||
| 良性 | 9 | 0 | 4 | |||
| 恶性 | 0 | 0 | 10 | |||
| 4C | ||||||
| 良性 | 0 | 0 | 2 | |||
| 恶性 | 3 | 0 | 18 | |||
常规超声BI-RADS分类、CEUS预测模型、常规超声BI-RADS分类+CEUS预测模型及调整后BI-RADS分类诊断的敏感度、特异度、准确性、阳性预测值、阴性预测值分别为86.1%、65.1%、74.7%、67.4%、84.8%;88.9%、76.7%、82.3%、76.2%、89.2%;80.6%、86.0%、83.5%、82.9%、84.1%;97.2%、76.7%、86.1%、77.8%、97.1%(表1)。以病理结果为金标准,常规超声BI-RADS分类、CEUS预测模型、常规超声BI-RADS分类+CEUS预测模型及调整后BI-RADS分类ROC曲线下面积分别为0.756、0.828、0.833、0.870。组间两两比较,仅调整前、后BI-RADS分类差异有统计学意义(Z=2.322,P<0.05)(图1,图2,图3)。

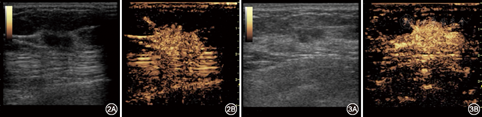

乳腺超声BI-RADS分类已广泛应用于临床,其主要依据乳腺肿块的二维征象进行分类,包括形态、方位、边缘、回声模式、后方回声特点、钙化、相关征象等[1]。然而,乳腺肿块表现多样,有些缺乏特征性,良恶性征象部分存在重叠[3],BI-RADS 4类肿块诊断最为困惑,恶性风险跨度大,可达2%~95%,造成许多良性肿块不必要的穿刺活检和过度治疗[4]。Raza等[5]研究显示,4类肿块的阳性预测值仅为15.5%~20.0%。因此,如何利用CEUS技术对鉴别诊断乳腺肿块良恶性提供更多依据,优化BI-RADS分类,减少不必要的穿刺活检已成为研究热点。
恶性肿瘤的生长、侵袭和转移主要依靠新生血管。Huang等[6]研究结果表明,良恶性肿瘤的血管特征存在明显差异。恶性肿块新生血管数目增多、基底膜不完整、走形迂曲不规则且易形成动静脉瘘。良性肿块诱发血管生成较少,血管稀疏,分支较少,走行自然。CEUS是纯血池显像,可以清晰显示肿瘤组织的血流灌注模式、微血管形态变化、走行特征及整体分布状态,以及肿瘤血管灌注时间顺序与空间分布的相应差异,弥补BI-RADS分类对血流信息概括简单的不足。
本研究应用CEUS预测模型联合及调整常规超声BI-RADS分类两种方法鉴别乳腺肿块良恶性,结果显示,常规超声BI-RADS分类+CEUS预测模型诊断效能较单一应用常规超声BI-RADS分类及CEUS预测模型未见明显优势,ROC曲线下面积分别为0.833、0.756、0.828,差异均无统计学意义;而调整后BI-RADS分类相较其他三种方法可提高肿块良恶性诊断的正确率,诊断效能最高,ROC曲线下面积为0.870,且与常规超声BI-RADS分类比较差异有统计学意义。此外,虽然调整后BI-RADS分类的特异度虽略低于常规超声BI-RADS分类+CEUS预测模型,但其敏感度及正确性最高,分别达97.2%、86.1%,更适用于乳腺癌早发现、早诊断、早治疗的临床原则,有利于乳腺癌的预后和提高患者的生存质量。调整后24个良性肿块降为3类,可以短期随访代替穿刺活检,18个恶性肿块升为5类,使肿块诊断更加明确,而BI-RADS 4类肿块降至34个,使57.0%(45/79)肿块避免了穿刺活检,且仅有3.8%(3/79)肿块发生漏诊、误诊。
常规超声BI-RADS分类及CEUS预测模型提示结果不一致时,仍可通过结合其他检查方法,尤其是穿刺活检纠正漏诊、误诊,决定是否手术治疗;而由于两者同时提示良性造成的漏诊和同时提示恶性造成的误诊更值得注意。本研究共1个因同时诊断为良性造成的漏诊,该肿块常规超声显示形态不规则,边缘光整,与皮肤呈平行位,分为BI-RADS 4A类,CEUS从中心向周边迅速增强,呈均匀高增强,增强后形态规则,未见明显增大,归为D模型,调整为BI-RADS 3类,病理结果为浸润性导管癌。漏诊的原因可能与医师对CEUS预测模型分类经验不足或欠严谨有关。本研究共6个因同时诊断为恶性造成的误诊病例,病理结果为乳腺增生症3个,乳腺增生症伴纤维腺瘤形成2个,浆细胞性乳腺炎1个。乳腺增生症病理组织形态多样,病变所处阶段不同,超声表现不同,当局灶性结节形成,常规超声显示病灶形态不规则,边缘不光整或成角,难以与早期乳腺癌相鉴别[7];CEUS常表现为边界不清,形态不规则,但慢进低增强或同进等增强或完全与周围腺体融为一体,极少出现滋养血管或充盈缺损等表现有助于鉴别[4,8]。乳腺纤维腺瘤由于腺管和纤维结缔组织的比例和排列构型差异,部分病例可出现大汗腺化生、腺管囊性扩张、钙化及出血性梗死等形态改变,常伴周围组织增生改变,使常规超声表现复杂[9]。本研究中1例乳腺增生症及1例乳腺增生伴纤维腺瘤形成CEUS呈高增强且范围扩大,归为A模型,2例乳腺增生症CEUS呈高增强且周围伴有滋养血管,归为C模型,1例乳腺增生伴纤维腺瘤形成CEUS呈向心性高增强伴充盈缺损,归为B模型而导致误诊,原因可能与导管上皮增生活跃,细胞排列紊乱,局部血管增生明显有关;1例浆细胞性乳腺炎CEUS呈高增强且范围扩大,归为A模型导致误诊,原因可能与导管内聚集分泌物分解、溢出,造成导管周围炎症及小叶结构破坏,形成以浆细胞浸润为主的肉芽肿,新生物局部血管数量和血管通透性增加有关。因此,我们在诊断时应密切结合患者病史、症状、体征,并自己触诊,以避免单纯、过度依赖影像学检查可能造成的误诊、漏诊。
综上,利用CEUS预测模型调整BI-RADS分类这一方法对鉴别乳腺BI-RADS 4类肿块良恶性的效能更高。
本研究的局限性:(1)样本例数较少,有待扩大样本量进一步研究;(2)CEUS模式判定存在一定的主观性。



























