
探讨新生儿胃穿孔的临床特点及预后相关因素。
回顾性分析2005年1月1日至2017年6月30日就诊于首都医科大学附属北京儿童医院外科,年龄≤28 d,明确诊断为胃穿孔的患儿27例,男21例(77.78%),女6例(22.22%),平均年龄4.05 d(3.24~7.01 d)。12例(44.44%)患儿病因为胃壁肌层缺损,1例(3.71%)患儿为应激性胃溃疡穿孔;14例(51.85%)无明确病因。16例患儿(59.26%)穿孔位于胃壁大弯侧,3例(11.11%)位于胃壁小弯侧,6例(22.22%)位于胃前壁,2例(7.41%)位于胃后壁。分析其临床特点;根据患儿是否存活,将其分为病死组与存活组,对比两组患儿胃穿孔相关指标间的差异,以探讨影响预后的相关因素;对存活组患儿进行随访,了解其生存情况。
符合纳入标准的27例患儿中,病死组10例(37.04%),存活组17例(62.96%),两组间年龄、性别、是否早产、是否低出生体重、是否存在围生期不良事件、是否伴发消化道畸形、症状到手术时间、穿孔长度、是否存在胃壁肌层缺损均无统计学差异(P>0.05);而是否存在胃肠道缺血坏死(P=0.002)和病程中是否出现多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)在两组中差异有统计学意义(P<0.001)。对存活组17例患儿随访(39.40±26.33)个月,患儿一般情况及生长发育良好,其中2例(11.76%)因术后粘连性肠梗阻再次手术治疗。
新生儿胃穿孔病死率高达37.04%,患儿围生期情况及有无消化道畸形对预后影响不大,而疾病的严重程度决定患儿预后,早期的诊断、积极手术干预对改善预后至关重要。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新生儿胃穿孔是罕见的新生儿期特有疾病,发病率较低,常在生后1周内骤然起病[1],病情进展迅速,若延迟诊治或者未行手术,其病死率可高达25%~55%[2,3]。目前新生儿胃穿孔病因尚不明确,并且对于其临床特点及预后分析报道不多,因此本研究回顾性分析近12年间本中心诊治的27例新生儿胃穿孔病例,总结其临床特点,并初步分析预后相关因素,以期提高对该病的诊疗水平。
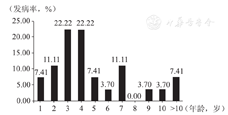
2005年1月1日至2017年7月1日就诊于首都医科大学附属北京儿童医院外科,年龄≤28 d,明确诊断为胃穿孔并且行手术治疗,病历及随访资料完整的27例患儿。男21例(77.78%),女6例(22.22%),平均年龄4.05 d(3.24~7.01 d),发病率与发病年龄的关系如图1。

27例患儿中,早产10例(37.04%),低出生体质量9例(33.33%);合并坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)2例(7.41%);合并消化道畸形5例(18.52%),其中肠旋转不良3例,食管裂孔疝1例,另有1例患儿同时合并梅克尔憩室和十二指肠膜式狭窄。
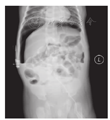
患儿发病前均无明确诱因,其临床表现为腹胀及呕吐(12例,44.44%)、腹胀(9例,33.33%)、反应差(3例,11.11%)及呼吸困难(3例,11.11%)。典型的新生儿胃穿孔立位腹部X线片表现为双侧膈下大量游离气体,内脏受压下移,严重者肝脏受压可呈半月形或马蹄形,胃泡变小甚至消失,出现横贯腹腔的大液气平面(图2)。

回顾性收集本研究27例患儿的临床资料,根据患儿是否存活,将其分为病死组与存活组。对比分析两组患儿以下指标有无差异:年龄;性别;围生期情况(有无早产、低出生体质量、围生期不良事件);出现症状到手术时间;术中所见及病理结果(穿孔长度、是否存在胃壁肌层缺损、有无胃肠道缺血坏死、是否合并消化道畸形);是否合并多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。对存活组患儿进行规律随访,以了解患儿生存情况。
采用SPSS 19.0软件进行统计学处理。正态性分布计数资料采用两独立样本t检验分析,非正态性分布计数资料采用两独立样本Mann-Whitney秩和检验进行分析,等级资料采用卡方检验分析。P<0.05为差异有统计学意义。
除去1例术后胃溃疡穿孔患儿,其余26例患儿经急诊入院,严重腹胀导致呼吸困难者,在剑突下穿刺放气,缓解腹腔压力。27例患儿均行手术治疗,术中探查见16例(59.26%)穿孔位于胃壁大弯侧,3例(11.11%)位于胃壁小弯侧,6例(22.22%)位于胃前壁,2例(7.41%)位于胃后壁。27例患儿行胃壁修补术,其中3例合并肠旋转不良的患儿同期行Ladd术,1例合并坏死性小肠结肠炎(necrotizingenterocolitis,NEC)的患儿同期行回肠造瘘术,另1例合并NEC患儿同期行胃大部分切除及回肠造瘘术。
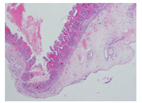
12例(44.44%)患儿术中证实病因为胃壁肌层缺损,病理结果表现为胃壁肌层缺损,固有层及黏膜下层水肿,散在较多淋巴、中性粒细胞浸润(图3);1例(3.71%)患儿因完全型大动脉转位、动脉导管未闭、卵圆孔未闭行低温体外心内直视Switch手术,术后20 d出现应激性胃溃疡穿孔;另外14例(51.85%)无明确病因。

27例患儿中,病死组10例(37.04%),存活组17例(62.96%)。病死组患儿死亡时间为术后(15.80±15.58) h。
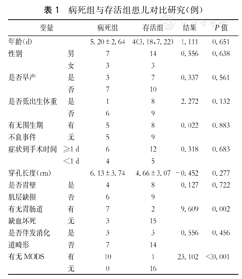
对病死组与存活组患儿进行对比分析,结果如表1。两组间年龄、性别、是否早产、是否低出生体质量、是否存在围生期不良事件、症状到手术时间、穿孔长度、是否存在胃壁肌层缺损、是否伴发消化道畸形均无统计学差异(P>0.05);而是否存在胃肠道缺血坏死(P=0.002)和病程中是否出现MODS(P<0.001)在两组中差异有统计学意义,死亡组胃肠道缺血坏死及MODS的患儿比例高。
病死组与存活组患儿对比研究(例)
病死组与存活组患儿对比研究(例)
| 变量 | 病死组 | 存活组 | 结果 | P值 | ||
|---|---|---|---|---|---|---|
| 年龄(d) | 5.20±2.64 | 4(3.18,7.22) | 1.111 | 0.651 | ||
| 性别 | 男 | 7 | 14 | 0.556 | 0.638 | |
| 女 | 3 | 3 | ||||
| 是否早产 | 是 | 3 | 7 | 0.337 | 0.561 | |
| 否 | 7 | 10 | ||||
| 是否低出生体重 | 是 | 1 | 8 | 2.272 | 0.132 | |
| 否 | 6 | 9 | ||||
| 有无围生期 | 有 | 5 | 8 | 0.022 | 0.883 | |
| 不良事件 | 无 | 5 | 9 | |||
| 症状到手术时间 | ≥1 d | 6 | 12 | 0.318 | 0.683 | |
| <1 d | 4 | 5 | ||||
| 穿孔长度(cm) | 6.13±3.74 | 4.66±3.07 | -0.452 | 0.277 | ||
| 是否胃壁 | 是 | 4 | 8 | 0.127 | 0.722 | |
| 肌层缺损 | 否 | 6 | 9 | |||
| 有无胃肠道 | 有 | 7 | 2 | 9.609 | 0.002 | |
| 缺血坏死 | 无 | 3 | 15 | |||
| 是否伴发消化 | 是 | 3 | 3 | 0.556 | 0.456 | |
| 道畸形 | 否 | 7 | 14 | |||
| 有无MODS | 有 | 10 | 1 | 23.102 | <0.001 | |
| 无 | 0 | 16 | ||||
对存活组17例患儿进行规律随访,随访时间为(39.40±26.33)个月,17例患儿中2例(11.76%)分别于术后3个月、4个月因粘连性肠梗阻行肠粘连松解术,其余15例患儿均无肠梗阻症状。17例患儿术后一般情况良好,无腹胀、呕吐、黑便等消化道症状,胃穿孔无复发;并且17例患儿生长发育情况良好,无严重营养不良病例。
胃穿孔是新生儿期致命性疾病,常于生后1周内骤然起病,男性发病高于女性,由于该病病死率高而发病率较低,且目前临床上对于此病预后特点的研究不多,因此本研究回顾性分析近12年本中心收治的27例新生儿胃穿孔患儿临床特点及预后情况,从而进一步为该病的诊治提供理论依据。
文献报道新生儿胃穿孔发病年龄多在生后1周之内[4,5,6],本研究85.19%患儿生后1周内发病,与文献报道一致。Gryboski[7]研究表明新生儿胃肠道肌群蠕动功能于出生3d后才能逐渐趋于协调,因此生后3 d之内,患儿胃肠道蠕动功能尚不协调,导致胃内压力不平衡,成为胃穿孔发病高峰,本研究发现生后第3、4天是新生儿胃穿孔发病高峰,生后1~4 d整体发病率高达62.96%,与文献结论相符。
新生儿胃穿孔最常见的病因为胃壁肌层缺损,本研究12例(44.44%)患儿明确诊断胃壁肌层缺损。既往研究认为,患儿进食或吞入空气等可导致胃内压增高,缺损处胃壁黏膜层、黏膜下层及浆膜层膨出形成膜样的胃壁薄弱区;若胃内压力进一步增高,导致该处破裂,发生胃穿孔[2]。除此之外,研究发现部分患儿因肠旋转不良[8,9]、肠闭锁、十二指肠膜式狭窄或闭锁[10,11]等先天性消化道畸形导致胃肠道梗阻,使得胃内压增高,导致胃穿孔;另外,NEC患儿可出现消化道多发穿孔。本研究14例无明确发病原因的患儿中,有4例合并消化道畸形,1例肠旋转不良,1例食道裂孔疝,2例NEC患儿;其余10例(37.04%)考虑为自发性胃穿孔。此外,本研究中1名患儿因先天性心脏病行手术治疗后出现应激性胃溃疡穿孔。文献中报道的其他新生儿胃穿孔病因还包括胃壁缺血[12]、腹部外伤、胃扭转[9]、Cajal间质细胞(ICC)减少[13,14,15]、激素及非甾体抗炎药物的应用等。虽然胃穿孔病因多样,但最终导致穿孔部位以胃壁大弯侧为主,本研究中大弯侧穿孔比例高达59.26%。考虑胃壁大弯侧扩张性最强,最容易导致胃壁缺血坏死从而发生胃穿孔;另外,王志强等[16]分析新生儿胃穿孔病因时,发现新生儿胃壁肌层中环形肌纤维连接存在间距,并且在胃底大弯侧最多见,构成潜在的胃壁薄弱区,当胃内压力明显增高时,可发生穿孔或破裂,是穿孔最易发生在胃壁大弯侧的另一原因。
这种肌纤维间距在早产儿中更易被发现,Lin等[17]认为胃壁结构发育不良和胃肠道蠕动功能不佳是早产儿胃穿孔的主要病因,但是早产是否构成胃穿孔预后不良的因素,国内外研究尚存在争议。一些学者认为早产、低出生体质量患儿预后不良[17,18],Byun等[6]研究表明早产、低出生体重与病死率无关。本研究发现早产、低出生体质量在死亡组与生存组间差异无统计学意义,不构成预后影响因素。除此之外,是否存在围生期不良事件,以及是否合并消化道畸形在两组间差异亦无统计学意义,表明患儿围生期情况及有无消化道畸形对预后的影响不大。
但是,本研究中新生儿胃穿孔病死率高达37.04%,进一步分析患儿疾病严重程度与预后的相关性,发现在穿孔长度、病因是否为胃壁肌层缺损、胃肠道缺血坏死情况及MODS中,后两者在死亡组中比例明显高于存活组,差异有统计学意义。推测胃肠道缺血坏死易引发严重感染,患儿病情重进展为MODS,最终导致预后不佳。分析胃穿孔患儿病情十分危重的原因有以下几方面:胃液对于腹膜的强烈化学性刺激,导致严重的腹膜炎;胃穿孔后消化道细菌进入腹腔,导致腹腔感染;与肠穿孔不同,胃穿孔后胃酸、胃蛋白酶不仅对于腹腔脏器产生强烈的刺激,并且对腹腔脏器产生一定的腐蚀作用,从而加速脏器衰竭的发生;与结肠穿孔不同,胃穿孔后腹腔内的胃液不易于局限形成包裹,容易扩散,导致弥漫性腹腔感染;新生儿免疫功能不完善,抗感染能力较弱[19]。
患儿疾病的严重程度是决定患儿预后的关键因素,因此危重患儿的早期诊治至关重要,研究表明[6]新生儿胃穿孔患儿出现症状到手术时间短者预后相对好。然而,本研究发现死亡组与存活组患儿出现症状到手术时间并无显著差异,考虑两组内病情重的患儿由于腹胀、呕吐、呼吸困难、反应差等症状重,内环境稳态失衡、代谢紊乱已出现,家长携患儿就诊及手术时间均较早,所以导致两组间差异无统计学意义。因此,早期的诊断治疗,尤其是在出现酸碱平衡及水电解质紊乱之前[17],仍是改善预后的关键因素。
由于死亡组患儿病情十分危重,其死亡时间为术后(15.80±15.58) h,本研究中最大值为术后43 h,表明新生儿胃穿孔患儿术后2 d之内是死亡高发期。存活的患儿在长达(39.40±26.33)个月的随访中,其胃肠道消化功能良好,生长发育状况良好,无再发穿孔者,仅11.76%的患儿因粘连性肠梗阻需要再次手术治疗。因此手术是新生儿胃穿孔有效的治疗方式;而对于严重腹胀导致呼吸困难者,紧急选择剑突下穿刺放气,缓解腹腔压力,以争取进一步治疗机会。
综上,新生儿胃穿孔多在生后1周内起病,主要发病部位为胃壁大弯侧,其病死率高达37.04%,但是围生期情况及有无消化道畸形对于预后影响不大,而疾病的严重程度决定患儿预后,早期的诊治对预后至关重要。因此,临床上应早期识别新生儿胃穿孔患儿并积极予以手术干预,努力提高术后患儿生存率。
无



























