
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是治疗冠心病的主要手段之一[1]。尤其是急性冠状动脉综合征(acute coronary syndrome,ACS)患者存在凝血系统激活,凝血酶活性增加,凝血和纤溶系统动态平衡失调,血液处于高凝状态[2],PCI的有创性操作和导管接触血管内皮表面又可诱发内/外源性凝血系统激活,活化凝血酶,促使纤维蛋白原转变成纤维蛋白最终形成血栓,因此PCI围术期前中后阶段均为血栓事件的高发时期。综上,ACS应尽早启动抗凝治疗,合理规范应用抗凝药物是保证介入手术疗效和安全的关键环节[3,4,5]。
PCI围术期非口服抗凝药物的选择与应用直接决定手术的成败,影响患者近、远期预后。合理的抗凝药物应在有效抗栓的同时降低或不增加出血风险。但对于急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者溶栓和介入治疗,在普通肝素(unfractionated heparin,UFH)早期应用方面存在着诸多误区。鉴于我国ACS发病率及介入干预数量逐年增加,为合理规范围手术期非口服抗凝药物的应用、制定合理的个体化用药策略,中华医学会心血管病学分会介入心脏病学组联合中国医师协会心血管内科医师分会血栓防治专业委员会专家,结合现有国内外有关指南、循证证据及临床应用现状[1,6,7,8,9],特编写本共识,以期为临床实践提供参考。
目前国内可应用的围术期非口服抗凝药物包括UFH、低分子肝素(low molecular weight heparin,LMWH)、磺达肝癸钠和比伐芦定。由于依诺肝素是循证证据最充分的用于PCI围术期抗凝治疗的LMWH,故本共识中LMWH仅推荐依诺肝素。这些药物的药理特征见表1。
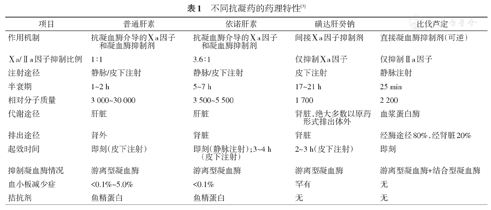
不同抗凝药的药理特性[3]
不同抗凝药的药理特性[3]
| 项目 | 普通肝素 | 依诺肝素 | 磺达肝癸钠 | 比伐芦定 |
|---|---|---|---|---|
| 作用机制 | 抗凝血酶介导的Ⅹa因子和凝血酶抑制剂 | 抗凝血酶介导的Ⅹa因子和凝血酶抑制剂 | 间接Ⅹa因子抑制剂 | 直接凝血酶抑制剂(可逆) |
| Ⅹa/Ⅱa因子抑制比例 | 1∶1 | 3.6∶1 | 仅抑制Ⅹa因子 | 仅抑制Ⅱa因子 |
| 注射途径 | 静脉/皮下注射 | 静脉/皮下注射 | 皮下注射 | 静脉注射 |
| 半衰期 | 1~2 h | 5~7 h | 17~21 h | 25 min |
| 相对分子质量 | 3 000~30 000 | 3 500~5 500 | 1 700 | 2 200 |
| 代谢途径 | 肝脏 | 肝脏 | 肾脏,绝大多数以原药形式排出体外 | 血浆蛋白酶 |
| 排出途径 | 肾外 | 肾脏 | 肾脏 | 经酶途径80%,经肾脏20% |
| 起效时间 | 即刻(皮下注射) | 即刻(静脉注射);3~4 h (皮下注射) | 2~3 h(皮下注射) | 即刻 |
| 抑制凝血酶情况 | 游离型凝血酶 | 游离型凝血酶 | 游离型凝血酶 | 游离型凝血酶+结合型凝血酶 |
| 血小板减少症 | <0.1%~5.0% | <0.1% | 罕有 | 无 |
| 拮抗剂 | 鱼精蛋白 | 鱼精蛋白 | 无 | 无 |
UFH被广泛应用于PCI围术期抗凝治疗已有近30余年,迄今仍是我国PCI术中应用最多的、高效、可靠的一线抗凝药物,具有即刻起效、抗凝效果确切和廉价等优点。尤其是对于STEMI患者,由于凝血酶(Ⅱa因子)在STEMI血栓形成过程中起到了核心作用,而UFH对凝血酶具有很强的抑制作用,能够快速、有效地阻断凝血瀑布,抑制体内外(血管内、导管内)血栓的发生发展,防止梗死面积扩大,因此UFH是STEMI溶栓或PCI前最关键的基础性治疗,国内外指南均给予UFHⅠ类推荐[1,6,7,8,9]。在一定范围内,UFH的药物半衰期与其一次性静脉注射的剂量呈正相关:一次性静脉注射25 U/kg,其半衰期为30 min;一次性静脉注射100 U/kg,其半衰期增加至60 min;一次性静脉注射400 U/kg,其半衰期可达150 min[10]。但UFH存在一定局限性,如个体间对凝血酶的抑制作用存在差异、需要频繁的实验室监测、存在发生肝素诱导的血小板减少症(heparin-induced thrombocytopenia,HIT)的风险、对血栓内已和纤维蛋白结合的凝血酶无效等[11]。
LMWH是通过化学或酶学解聚的方法从UFH中衍生出来的片段,其长度约为UFH的1/3,国内通常把相对分子质量<8 000的统称为LMWH。鉴于其他LMWH在PCI围术期疗效和安全性的证据不足,不能替代依诺肝素。
依诺肝素是目前国内外指南唯一推荐的用于ACS患者PCI围术期的LMWH,广泛适用于STEMI和非ST段抬高型ACS(non ST-segment elevation ACS,NSTE-ACS)患者。依诺肝素的相对分子质量是3 500~5 500,具有较高的抗Ⅹa活性和较低的抗Ⅱa活性。在推荐的剂量范围内,依诺肝素的药代动力学是线性的,一次性静脉注射0.5 mg/kg,数分钟即可达到有效治疗浓度,可维持2 h;1 mg/kg皮下注射(2次/d),3~4 h后可达有效治疗浓度并维持5~7 h;重度肾功能不全患者[估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)<30 ml/min]需减少剂量[12]。目前临床中依诺肝素的使用存在很多不规范,如抗凝启动不及时、用量不足等,易导致导管内血栓和支架内血栓,因此需强调规范化使用依诺肝素。
磺达肝癸钠是一种纯化学合成的戊聚糖钠甲基衍生物,是高选择性的游离Ⅹa因子抑制剂,对Ⅱa因子无作用,导管内血栓风险较高。磺达肝癸钠不能抑制血小板的聚集,也不与血小板因子4相互作用,临床罕有HIT发生。半衰期为17 h,有效作用时间可维持24 h。
新型直接凝血酶抑制剂比伐芦定是水蛭素衍生物。与UFH或LMWH相比,比伐芦定与凝血酶可逆性结合,对游离型及结合型凝血酶均有抑制作用,不激活血小板,不与血浆蛋白结合,不引起HIT,药代动力学呈线性。一次性静脉注射5 min内即可达到峰浓度,肾功能正常者半衰期为25 min,治疗结束后1~2 h内凝血参数恢复正常[13,14,15]。比伐芦定的清除与eGFR密切相关,轻微肾功能损伤不影响其清除,肾功能中重度损伤(eGFR<60 ml/min)的患者其清除率下降约20%,血液透析患者的清除率约25%。但其价格较高,因半衰期较短且与凝血酶呈可逆结合,早期停药易引发急性支架内血栓(acute stent thrombosis,AST)形成。2016年3月美国食品药品管理局公布的比伐芦定安全标签更改清单中标注:接受直接PCI的STEMI患者,应用比伐芦定较UFH可增加AST(<4 h)形成风险(1.2%比0.2%),直接PCI术中应用比伐芦定的患者应密切监测24 h,警惕发生缺血事件,PCI后应适当延长给药时间。
应根据患者的临床表现决定最佳抗凝强度。与接受择期PCI的稳定性冠心病患者相比,ACS患者PCI围术期需要较高强度的抗凝治疗,建议STEMI患者在平衡缺血、出血的基础上,一经诊断,即刻启动抗凝治疗。
SCAD包括慢性稳定性劳力性心绞痛、ACS后稳定期、无症状型心肌缺血等[16,17]。SCAD患者PCI围术期抗凝推荐详见表2。除非存在其他抗凝指征,PCI后建议停止抗凝治疗。

稳定性冠心病患者PCI围术期抗凝治疗的推荐
稳定性冠心病患者PCI围术期抗凝治疗的推荐
| 抗凝药物 | 应用建议 | 证据来源 |
|---|---|---|
| 普通肝素 | 术中应用70~100 U/kg,静脉注射 | 文献[1,8,18,19] |
| 比伐芦定 | 如有HIT,使用比伐芦定(一次性静脉注射0.75 mg/kg,随后1.75 mg·kg-1·h-1维持至术后3~4 h),用药5 min后监测ACT,术中维持250~300 s,术后4 h如有必要再以低剂量0.2 mg·kg-1·h-1至术后20 h | 文献[1,8,20,21,22,23,24] |
| 高出血风险患者,使用比伐芦定(一次性静脉注射0.75 mg/kg,随后1.75 mg·kg-1·h-1维持至术后3~4 h) | ||
| 如果比伐芦定一次性静脉注射0.75 mg/kg后5 min ACT<225 s,追加比伐芦定0.3 mg/kg | ||
| 依诺肝素 | 一般患者可单次给予0.5 mg/kg静脉注射,手术复杂预计时间长者可给予0.75 mg/kg静脉注射 | 文献[1,8,25,26,27] |
| 磺达肝癸钠 | 不推荐磺达肝癸钠作为择期PCI中单药抗凝使用 | 文献[1,8,28,29] |
注:PCI为经皮冠状动脉介入治疗,HIT为肝素诱导的血小板减少症,ACT为活化凝血时间
优选70~100 U/kg方案进行术中抗凝,与15 000 U抗凝治疗的有效性和安全性相当,但鞘管拔除时间和术后转移至普通病房的时间更短[18]。ISAR-React 3A研究也发现UFH 100 U/kg组在主要终点发生率上[死亡、心肌梗死(myocardial infarction, MI)、紧急靶血管再次血运重建及院内主要出血]不劣于UFH 140 U/kg组,且出血并发症发生率较低[19]。
STEEPLE研究提示择期PCI术中一次性静脉注射0.5 mg/kg或0.75 mg/kg依诺肝素是简单、安全、有效的抗凝方案,与血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂(glycoprotein Ⅱb/Ⅲa inhibitor,GPI)合用时不需调整剂量[25,26]。STEEPLE试验亚组研究发现,依诺肝素注射后抗Ⅹa因子测定>0.9 U/ml可达到最佳的风险/获益比[27]。
NSTE-ACS包括不稳定性心绞痛和NSTEMI,两者发病机制和临床表现相似,而严重程度有所不同。对此类患者应在早期进行危险分层,依据患者情况选择治疗策略。对接受PCI的NSTE-ACS患者围术期抗凝治疗推荐见表3。

NSTE-ACS患者PCI围术期抗凝治疗的推荐
NSTE-ACS患者PCI围术期抗凝治疗的推荐
| 抗凝药物 | 应用建议 | 证据来源 |
|---|---|---|
| 总体原则 | 所有NSTE-ACS患者一经诊断,尽早启动抗凝治疗,联合抗血小板治疗;综合考虑缺血和出血风险,合理选择抗凝药物;除非存在高缺血风险及其他抗凝指征,PCI后停止抗凝治疗 | 文献[1,8,30,31] |
| 普通肝素 | 术前:拟行PCI且未接受任何抗凝治疗的患者使用普通肝素70~100 U/kg静脉注射,合用GPI时,则给予普通肝素50~70 U/kg静脉注射 | 文献[1,8,30,31,32] |
| 术中:PCI中可在ACT指导下追加普通肝素(维持ACT≥225 s) | ||
| 比伐芦定 | 术中:HIT和高出血风险患者优选比伐芦定;比伐芦定(一次性静脉注射0.75 mg/kg,随后1.75 mg· kg-1·h-1静脉滴注,如5 min后ACT<225 s,追加0.3 mg/kg)可作为普通肝素合用GPI的替代治疗;应注意防止鞘管内血栓形成,必要时增加抗凝药物的使用 | 文献[1,8,30,31,33,34,35,36] |
| 术后:建议比伐芦定维持1.75 mg·kg-1·h-1静脉滴注至术后4 h,4 h后如有必要再以低剂量0.2 mg· kg-1·h-1至术后20 h | ||
| 依诺肝素 | 术前:建议1 mg/kg,皮下注射,2次/d至PCI | 文献[1,8,30,31,37,38,39,40,41] |
| 术中:对已接受依诺肝素抗凝治疗的患者,建议PCI术中继续应用依诺肝素:(1)如果在PCI术前最后一次使用依诺肝素的时间>12 h或初始未接受任何抗凝药物治疗的,建议术中给予依诺肝素0.5 mg/kg静脉注射,病变复杂预计手术时间长的患者给予0.75 mg/kg静脉注射;(2)PCI术前8~ 12 h接受过标准剂量(1 mg/kg皮下注射,2次/d)依诺肝素,或皮下注射少于2次的,于PCI前静脉追加0.3 mg/kg的依诺肝素;(3)PCI前8 h内接受过标准剂量(1 mg/kg皮下注射,2次/d)依诺肝素,无需追加依诺肝素;(4)应防止鞘管内血栓形成,必要时增加抗凝药物的使用;(5)不建议普通肝素与依诺肝素交叉使用 | ||
| 术后:临床指征需继续抗凝,则给予依诺肝素1 mg/kg皮下注射,2次/d,根据肾功能调整剂量,维持抗凝2~8 d或至出院,并严密监测出血风险;如使用维生素K拮抗剂后需继续抗凝,则给予依诺肝素40 mg皮下注射,1次/d | ||
| 磺达肝癸钠 | 术前:建议2.5 mg皮下注射,1次/d至PCI | 文献[1,8,25,30,31,42,43,44,45,46,47,48] |
| 术中:正在接受磺达肝癸钠(2.5 mg皮下注射,1次/d)治疗的患者行PCI时,建议一次性给予普通肝素85 U/kg静脉注射(联合应用GPI时静脉注射60 U/kg)或比伐芦定(一次性静脉注射0.75 mg/kg,随后1.75 mg·kg-1·h-1,如5 min后ACT<225 s,追加比伐芦定0.3 mg/kg静脉注射) | ||
| 术后:如术中应用比伐芦定抗凝,建议术后比伐芦定维持1.75 mg·kg-1·h-1至术后4 h,4 h后如有必要再以低剂量0.2 mg·kg-1·h-1至术后20 h |
注:NSTE-ACS为非ST段抬高型急性冠状动脉综合征,PCI为冠状动脉介入治疗,ACT为活化凝血时间
FUTURA-8研究发现,在应用磺达肝癸钠的基础上,50 U/kg UFH±GPI较85 U/kg或60 U/kg UFH±GPI不减少主要出血发生风险,却增加缺血事件发生率,提示NSTE-ACS患者围术期抗凝应选择常规剂量UFH。
SYNERGY研究分析显示[37],PCI围术期使用依诺肝素抗凝的NSTE-ACS患者,与使用UFH相比,30 d死亡/心肌梗死、GUSTO严重出血和TIMI主要出血发生风险相当。但如果患者术前接受皮下依诺肝素或UFH预处理后,PCI术中改用UFH或依诺肝素抗凝,出血并发症风险增加,提示应避免依诺肝素和UFH间的交叉使用[38]。A to Z研究、ACUTEⅡ研究和INTERACT研究提示高危NSTE-ACS患者给予依诺肝素+GPI 24~96 h,疗效和安全性至少等于或优于UFH+GPI,说明PCI术中应用依诺肝素+GPI是安全的,与GPI合用时无需调整剂量[39,40,41]。
STEMI患者由于冠状动脉内血栓形成导致急性冠状动脉闭塞,起病急、病情重,应尽早开通梗死相关动脉,恢复心肌灌注。直接PCI和溶栓后PCI围术期抗凝治疗的推荐详见表4。

STEMI患者PCI围术期抗凝治疗的推荐
STEMI患者PCI围术期抗凝治疗的推荐
| 抗凝药物 | 应用建议 | 证据来源 |
|---|---|---|
| 总体原则 | 所有STEMI患者一经诊断,尽早启动抗凝治疗,联合抗血小板治疗;综合考虑缺血和出血风险,合理选择抗凝药物 | 文献[1,7,8,9,49] |
| 普通肝素 | 术前:(1)直接PCI术前:静脉注射普通肝素70~100 U/kg,监测APTT或ACT至对照值的1.5~2.0倍(APTT约50~70 s,ACT约250~300 s);(2)溶栓至PCI前:按照说明书静滴溶栓药后,当APPT值低于正常上限2倍时,应给予普通肝素。其剂量应根据APTT值调整,需维持APTT值在50~70 s(参考值的1.5~2.0倍) | 文献[1,7,8,9,49] |
| 术中:(1)直接PCI中:继续应用UFH,若联合GPI可将UFH用量适当降低,一般静脉注射50~70 U/kg,维持ACT在250~300 s;(2)溶栓后PCI中:继续应用UFH,一般静脉注射70 U/kg,维持ACT在250~300 s | ||
| 比伐芦定 | 术前:溶栓至PCI前:由于证据不足,不建议比伐芦定用于常规溶栓后至PCI术前的抗凝治疗 | 文献[1,7,8,9,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69] |
| 术中:(1)HIT和高出血风险患者优选比伐芦定;(2)直接PCI:使用比伐芦定(一次性静脉注射0.75 mg/kg,随后1.75 mg·kg-1·h-1静脉滴注),如果比伐芦定一次性静脉注射0.75 mg/kg后5 min ACT<225 s,追加比伐芦定0.3 mg/kg静脉注射;(3)溶栓后PCI:仅见于瑞替普酶溶栓时,如果溶栓期间采用普通肝素抗凝,术中可应用比伐芦定(预先应用普通肝素,等待30 min,比伐芦定静脉注射0.75 mg/kg,随后1.75 mg·kg-1·h-1静脉滴注),如果比伐芦定一次性静脉注射0.75 mg/kg后5 min ACT<225 s,追加比伐芦定0.3 mg/kg静脉注射 | ||
| 术后:建议比伐芦定维持1.75 mg·kg-1·h-1静脉滴注至术后3~4 h | ||
| 依诺肝素 | 术前:延迟PCI:建议1 mg/kg皮下注射,2次/d至PCI溶栓至PCI前。(1)年龄<75岁:一次性静脉注射30 mg,15 min后继以1 mg/kg,皮下注射,2次/d至PCI(前2次单次最大剂量100 mg);(2)年龄≥75岁:仅需0.75 mg/kg,皮下注射,2次/d至PCI(前2次单次最大剂量75 mg);(3)eGFR<30 ml/min,无论年龄,均给予1 mg/kg,皮下注射,1次/d至PCI | 文献[1,7,8,9,49,70,71,72,73] |
| 术中:对已接受依诺肝素抗凝治疗的患者,建议PCI术中继续应用依诺肝素代替普通肝素:(1)如果在PCI术前最后一次使用依诺肝素的时间>12 h或初始未接受任何抗凝药物治疗的,建议术中给予依诺肝素0.5 mg/kg静脉注射,病变复杂预计手术时间长的患者给予0.75 mg/kg静脉注射;(2)PCI术前8~ 12 h接受过标准剂量(1 mg/kg皮下注射,2次/d)依诺肝素,或皮下注射少于2次的,于PCI前静脉追加0.3 mg/kg的依诺肝素;(3)PCI前8 h内接受过标准剂量(1 mg/kg皮下注射,2次/d)依诺肝素,无需追加依诺肝素;(4)应防止鞘管内血栓形成,必要时增加抗凝药物的使用;(5)不建议普通肝素与依诺肝素交叉使用 | ||
| 术后:临床指征需继续抗凝,则给予依诺肝素1 mg/kg皮下注射,2次/d,根据肾功能调整剂量,维持抗凝2~8 d或至出院,并严密监测出血风险,如使用维生素K拮抗剂后需继续抗凝,则给予依诺肝素40 mg皮下注射,1次/d | ||
| 磺达肝癸钠 | 术前:溶栓至PCI前:接受链激酶溶栓患者可用磺达肝癸钠抗凝,静脉注射2.5 mg,随后2.5 mg,皮下注射,1次/d至PCI | 文献[1,7,8,9,49,74,75] |
| 术中:不宜作为直接或溶栓后PCI的术中抗凝选择,溶栓后PCI术前应用磺达肝癸钠抗凝的患者,术中建议更换为普通肝素抗凝 |
注:STEMI为ST段抬高型心肌梗死,PCI为冠状动脉介入治疗,APTT为活化部分凝血活酶时间,ACT为活化凝血时间
虽然目前并没有评估UFH用于STEMI直接PCI围术期抗凝的安慰剂对照临床研究,但UFH仍是STEMI患者中常用的抗凝药,并在长期临床实践中积累了大量使用经验[49]。
ExTRACT-TIMI 25 PCI亚组研究中,接受溶栓后PCI的STEMI患者在术前及术中使用依诺肝素较UFH显著降低30 d死亡和非致命性MI的风险[70,71]。ATOLL研究[73]证实,直接PCI术前一次性静脉注射依诺肝素0.5 mg/kg,较UFH可显著降低死亡和心肌梗死发生率,且出血风险更低。另一项包含10 243例STEMI患者的荟萃分析[73]发现,直接PCI术前一次性静脉注射依诺肝素0.5 mg/kg与UFH相比有效性和安全性相当。
OASIS-6研究结果显示[74],与UFH相比,磺达肝癸钠组STEMI患者9、30 d和3~6个月死亡和再梗死联合终点事件发生率差异无统计学意义。但OASIS-5和OASIS-6研究的汇总分析发现,磺达肝癸钠组患者导管内血栓风险较UFH/依诺肝素组增加3.98倍[75]。
HORIZONS-AMI[50,51,52,53]和EuroMax研究[54,55,56]显示,STEMI患者行直接PCI期间使用比伐芦定与UFH(常规或临时合用GPI)相比,前者可显著减少死亡和主要出血事件,但均伴有AST风险增高。2项研究的汇总分析发现[56],比伐芦定组患者AST主要发生在PCI后4 h内。但发生早期支架内血栓(<30 d)的患者中,比伐芦定组30 d内病死率为6.7%(4/60),UFH±GPI组为40%(16/40)[63]。而HEAT-PPCI研究发现与单用UFH相比,比伐芦定不减少主要出血风险,反而显著增加缺血事件(主要是AST风险显著增高)[57]。但由于该研究单中心、不良事件未经过独立第三方判定、术中ACT显著低于其他相关研究等缺陷引发了很大争议。BRIGHT研究采用PCI后高剂量延时注射比伐芦定的方式[PCI后持续静脉滴注术中剂量(1.75 mg·kg-1·h-1)比伐芦定3~4 h],发现急性心肌梗死(AMI)患者直接PCI期间,使用比伐芦定相比UFH或UFH+GPI可减少总不良事件和出血风险,且不增加AST风险[58]。BRIGHT研究女性[59]和经桡动脉路径[60]亚组结果同样显示,与UFH相比,直接PCI后持续高剂量注射比伐芦定可显著减少女性和经桡动脉路径患者出血风险,且AST风险无增高。MATRIX研究发现比伐芦定组患者死亡和出血发生率显著低于UFH组[61,62],且PCI术后延长使用高剂量比伐芦定组患者不良事件发生率显著低于低剂量和未延长应用组。近期Shah等[64]的网状荟萃分析,以及英国单中心注册研究[66]、国内多中心回顾性研究[67,68,69]均发现,PCI后持续高剂量应用比伐芦定可降低AST风险,而PCI后低剂量应用比伐芦定或停用比伐芦定患者AST发生风险增加。
应用建议:(1)依诺肝素:eGFR 30~89 ml/min患者无需调整剂量,用药期间应严密监测出血风险;eGFR<30 ml/min患者不用负荷量,应用1 mg/kg皮下注射,1次/d。(2)磺达肝癸钠:禁用于eGFR<20 ml/min的患者;eGFR 20~30 ml/min的患者,推荐剂量为1.5 mg皮下注射,1次/d;eGFR 30~50 ml/min的患者,根据药代动力学模拟结果可考虑使用1.5 mg皮下注射,1次/d。(3)比伐芦定:eGFR 30~89 ml/min的患者无需调整剂量,一次性0.75 mg/kg,随后1.75 mg·kg-1·h-1;eGFR<30 ml/min的患者应减少给药剂量,一次性静脉注射0.75 mg/kg,随后1.0 mg·kg-1·h-1;血液透析的患者,一次性静脉注射0.75 mg/kg,随后0.25 mg·kg-1·h-1。
STEEPLE研究行择期PCI的慢性肾病患者(eGFR≤60 ml/min)中,与UFH组相比,依诺肝素组非冠状动脉旁路移植术的主要出血发生率有降低趋势[76]。Extract-TIMI 25研究显示eGFR<30、30~60、60~90和>90 ml/min患者大出血发生率分别为5.7%、3.5%、2.3%和1.2%,中度肾功能不全患者发生临床事件和出血事件的危险性即有增加,eGFR<30 ml/min患者大出血发生率增加最明显[71]。因此,在中度肾功能不全患者用药期间应严密监测出血风险,严重肾功能不全患者应用依诺肝素应减少剂量。
OASIS-5研究[77]中,磺达肝癸钠组肾功能不全患者的出血发生率显著低于依诺肝素组,其中eGFR≥20 ml/min的肾功能受损患者磺达肝癸钠未调整剂量,出血风险仍显著低于调整剂量(eGFR≤30 ml/min减量至1 mg/kg,1次/d)的依诺肝素,因此eGFR≥20 ml/min的ACS患者不需要减少给药剂量。
REPLACE-2研究肾功能不全患者亚组分析显示[78],eGFR<60 ml/min的患者中比伐芦定组与UFH+GPI组相比,30 d死亡、心肌梗死和紧急再次血运重建复合终点及主要出血发生率相当,全部出血发生率比伐芦定组优于UFH+GPI组。BRIGHT研究亚组分析[58]结果显示,比伐芦定组eGFR>60 ml/min的患者与eGFR 30~60 ml/min的患者同样获益,且eGFR 30~60 ml/min的患者获益更明显。因此,慢性肾病患者PCI围术期应用比伐芦定安全有效,但eGFR<30 ml/min的患者应根据肾功能水平调整用药剂量。
应用建议:(1)依诺肝素:年龄<75岁:起始给予30 mg静脉负荷量,随后1 mg/kg皮下注射、1次/d;年龄≥75岁:停用起始负荷量,直接给予0.75 mg/kg皮下注射,2次/d。(2)无肾功能受损的老年患者(≥75岁)无需调整磺达肝癸钠和比伐芦定的剂量。
Extract-TIMI 25研究发现依诺肝素组30 d轻度出血和大出血发生率分别为2.6%和2.1%,高于UFH组的1.8%和1.4%,其中主要见于年龄>75岁和GFR<30 ml/min的患者[71]。所以建议依诺肝素按年龄调整药物剂量。
OASIS-5研究中,>65岁患者出血发生率明显高于<65岁患者,但与依诺肝素比较,磺达肝癸钠出血危险仍较低。ACUITY研究年龄亚组结果显示[79],比伐芦定用药方式不变的情况下,<55、55~64、65~74和≥75岁行PCI的NSTE-ACS患者中,比伐芦定单药治疗组30 d非冠状动脉旁路移植术的主要出血发生率分别为1.7%、3.0%、4.2%和6.1%,均显著低于UFH+GPI组。BRIGHT研究的结果同样表明比伐芦定疗效不受年龄的限制,≥65岁的AMI患者接受比伐芦定治疗与UFH±GPI相比获益更明显[58]。因此,>75岁无肾功能受损的老年患者PCI围术期无需调整磺达肝癸钠和比伐芦定的剂量。
应用建议:采用比伐芦定进行PCI围术期抗凝[80]。
UFH和LMWH均可诱发HIT,但UFH导致HIT的发生率是LMWH的10倍[81]。发生HIT时往往会导致严重的血栓栓塞事件,血小板严重下降。比伐芦定与血小板无相互作用,不会导致HIT。ATBAT研究评价了HIT患者PCI围术期应用比伐芦定抗凝的疗效与安全性,给予比伐芦定一次性静脉注射1 mg/kg,随后2.5 mg·kg-1·h-1(高剂量组),或一次性静脉注射0.75 mg/kg,随后1.75 mg·kg-1·h-1(低剂量组),发现仅有1例高剂量组患者发生主要出血事件,无患者发生血小板减少(计数<50×109/L)[82]。HORIZONS-AMI和EUROMAX研究的汇总分析结果显示[56],比伐芦定与UFH±GPI相比,30 d血小板减少发生率显著降低。BRIGHT研究[58]发现,比伐芦定组30 d血小板减少症发生率为0.1%,肝素组为0.7%,肝素+GPI组为1.1%。上述研究均提示HIT患者PCI围术期应用比伐芦定抗凝安全有效。因此,可疑或确诊HIT时应该立即停用UFH或LMWH,并采用比伐芦定替代。
应用建议:(1)择期PCI患者围术期无需停用口服抗凝药,以避免桥接治疗带来的额外的出血和缺血风险[8]。对于国际标准化比值(INR)>2.5的患者,PCI围术期无需给予额外的抗凝药物治疗;INR≤2.5的患者,PCI中应用UFH静脉注射50~70 U/kg。除非紧急情况,应避免使用GPI。(2)建议直接PCI患者围术期不停用口服抗凝药,且应补充非口服抗凝药物。推荐使用比伐芦定,其出血风险小于UFH或LMWH。如术前应用直接Ⅹa因子抑制剂,应优先使用依诺肝素。除非紧急情况,应避免使用GPI[8]。
抗凝药的循证医学证据正在不断丰富,为PCI患者制定更加安全有效的围术期抗凝策略和个体化治疗提供了指导。临床医生在选择合适的药物、调节给药剂量、监测药效及减少出血事件中的作用至关重要。希望本共识能有助于临床医生在冠心病患者PCI围术期正确、合理、规范地使用抗凝药物方面提供有实用价值的信息,以期进一步改善冠心病患者预后。
(执笔:韩雅玲,傅向华)
专家组成员(按姓氏拼音):曹蘅(皖南医学院弋矶山医院),常荣(青海省人民医院),陈纪言(广东省人民医院),陈绍良(南京市第一医院),崔鸣(北京大学第三医院),丁世芳(广州军区武汉总医院),杜志民(中山大学附属第一医院),冯颖青(广东省人民医院),傅国胜(浙江大学医学院附属邵逸夫医院),傅向华(河北医科大学第二医院),高传玉(河南省人民医院),高炜(北京大学第三医院),葛均波(复旦大学附属中山医院),郭延松(福建省立医院),韩雅玲(原沈阳军区总医院),何奔(上海交通大学附属胸科医院),侯静波(哈尔滨医科大学附属第二医院),侯玉清(南方医科大学附属南方医院),华琦(首都医科大学宣武医院),惠永明(北京丰台医院),贾大林(中国医科大学附属第一医院),贾绍斌(宁夏大学总医院),江洪(武汉大学人民医院),江力勤(嘉兴学院附属第二医院),荆全民(沈阳军区总医院),荆志成(中国医学科学院 北京协和医学院 阜外医院),黎辉(大庆油田总医院),李保(山西省心血管病医院),李春坚(江苏省人民医院),李潞(沈阳医学院附属沈洲医院),李攀(海军军医大学附属长海医院),李晓东(中国医科大学附属盛京医院),李晓燕(原济南军区总医院),李妍(空军军医大学附属西京医院),李毅(原沈阳军区总医院),李洋(沈阳军区总医院),李拥军(河北医科大学第二医院),梁春(海军军医大学附属长征医院),梁振洋(沈阳军区总医院),刘斌(吉林大学第二医院),刘朝中(空军总医院),刘健(北京大学人民医院),马丽萍(海军军医大学附属长海医院),牛丽丽(陆军总医院),乔树宾(中国医学科学院 北京协和医学院 阜外医院),史旭波(首都医科大学附属北京同仁医院),苏国海(济南市中心医院),孙艺红(中日友好医院),陶剑虹(四川省人民医院),田军(武警后勤学院附属医院),王斌(沈阳军区总医院),王刚(鞍山市中心医院),王海昌(空军军医大学附属唐都医院),王建昌(空军总医院),王守力(解放军第三〇六医院),王效增(沈阳军区总医院),吴翔(南通大学附属医院),徐亚伟(上海市第十人民医院),许锋(北京医院),许俊堂(北京大学人民医院),杨丽霞(昆明军区总医院),杨新春(首都医科大学附属朝阳医院),于波(哈尔滨医科大学附属第二医院),袁晋青(中国医学科学院 北京协和医学院 阜外医院),张俊杰(南京市第一医院),张明(辽宁省金秋医院),张奇(上海交通大学附属东方医院),张抒扬(中国医学科学院 北京协和医学院 北京协和医院),张文琪(吉林大学中日联谊医院),张育民(长沙市第三医院),张钲(兰州大学第一医院),赵昕(沈阳军区总医院),钟诗龙(广东省人民医院),周玉杰(首都医科大学附属安贞医院)
无

























