
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尽早拔除人工气道是减少机械通气相关并发症的重要措施。上气道通畅和较好的气道保护能力是影响人工气道拔除成功与否的关键因素[1],其中咳嗽能力的评价是判断气道保护能力强弱的重要内容,但目前临床仍缺乏机械通气患者咳嗽能力规范化评价的共识意见或建议。近些年来,学者们对机械通气患者咳嗽能力的评价及其临床意义进行了大量的临床研究和探索。现将对机械通气尤其是建立人工气道患者咳嗽能力的评价及临床意义阐述如下。
正常咳嗽反射动作分为4个步骤[2]:首先,气道上各类炎性、物理、化学或温度等不良刺激引起延髓咳嗽中枢产生咳嗽反射;接着吸气肌肉用力收缩产生深吸气动作(吸气量1~2 L);然后声门紧闭,呼气肌肉用力收缩,胸内压在短时间内(0.2 s)急剧增加,并超过100 mmHg(1 mmHg=0.133 kPa);最后,声门骤然开放,此时胸内压的瞬间释放会显著增加呼出气体的流量(峰流量一般能达到12 L/s),剪切、粉碎气道内分泌物并排出体外。影响上述任一步骤的因素均会降低患者的有效咳嗽。
机械通气患者咳嗽过程较非机械通气的患者有所不同,临床中诸多因素会降低机械通气患者的咳嗽能力[2]。临床使用镇静剂和肌松剂会影响感觉神经的灵敏性和神经冲动的传导,影响咳嗽第1个步骤;术后疼痛、神经肌肉异常影响咳嗽的第2个步骤;影响第3个步骤的因素有喉神经损伤、人工气道存在,声门的闭合作用消失;影响第4个步骤的因素有气道阻塞、腹部肌肉无力,无法形成大的呼气流速。
在重症监护病房(ICU)中,还有许多因素会影响咳嗽的全过程。在ICU长期制动和机械通气会使膈肌血供显著减少,导致膈肌肌纤维萎缩,膈肌功能障碍,严重可导致ICU获得性肌无力[3]会影响咳嗽时呼吸肌肉的做功。还有影响正常黏液纤毛清除的疾病,如囊性纤维化、支气管扩张,重症肌无力等。另外,高吸入氧浓度、湿化不足或湿化过度以及各种原因导致的纤毛黏液系统受损,也会影响分泌物排出。
临床常通过以下几种方法评价患者的咳嗽能力:
测量个体在咳嗽过程中最大的呼气流量,是反映患者咳嗽能力的最重要和最常用的量化指标[4],亦可以通过多次测量来评价患者咳嗽能力的变化趋势[5]。测量时患者应取坐位或床头抬高30°~45°,由呼吸治疗师或其他专业人员指导患者做咳嗽动作,随后将峰流量测量仪连接到人工气道末端,因咳嗽峰流量具有容积依赖性[5],故需嘱患者深吸气至肺总量后进行用力呼气,连续记录3次咳嗽峰流量,取其中最大值[6]。
咳嗽能力减弱是拔管失败的独立危险因素[8]。对于神经重症的患者,Salam等[6]的试验中,评价了神志状态、咳嗽能力和分泌物对于拔管结果的影响,共纳入88例患者,拔管成功者(74例)和拔管失败者(14例)咳嗽峰流量的比较结果为(79.9±4.1)L/min和(58.1±4.6)L/min(P<0.01)。文章指出预测拔管失败的3个独立高危因素分别是咳嗽峰流量(<60 L/min)、痰量(>2.5 ml/h)和简单指令动作(睁眼、眼球运动、握手、伸舌头)[6]。咳嗽峰流量小,分泌物多,不能完成指令动作的拔管失败率分别增加5、3和4倍,且指令动作完成情况与咳嗽峰流量大小相关[6]。
对于非神经重症的患者,有数据显示咳嗽能力弱的患者拔管失败率是咳嗽能力强的患者4倍,中到大量的痰液相对于没有或者少量痰液的患者拔管失败率要高8倍[7]。Thille等[9]对于72 h和7 d内无效咳嗽对拔管失败预测的意义,结果显示72 h和7 d的内拔管失败率并无明显差异,拔管失败大部分发生于拔管后的72 h内,因此临床中应该对拔管后72 h内的患者给予更多关注。
不同研究中对于咳嗽峰流量的界定有所不同(表1)。目前尚没有统一的预测拔管失败率的咳嗽峰流量。针对气管插管患者,目前国内外研究结果将低咳嗽峰流量设定为<60 L/min[10,11,12,13],低咳嗽峰流量患者的机械通气时间延长,且具有较高的再插管率。
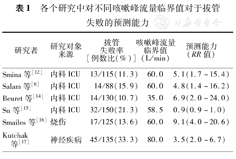
各个研究中对不同咳嗽峰流量临界值对于拔管失败的预测能力
各个研究中对不同咳嗽峰流量临界值对于拔管失败的预测能力
| 研究者 | 研究对象来源 | 拔管失败率[例数比(%)] | 咳嗽峰流量临界值(L/min) | 预测能力(RR值) |
|---|---|---|---|---|
| Smina等[12] | 内科ICU | 13/115(11.3) | 60.0 | 5.1(1.7~15.4) |
| Salam等[6] | 内科ICU | 14/88(15.9) | 60.0 | 4.8(1.4~16.2) |
| Beuret等[14] | 内科ICU | 14/130(10.7) | 35.0 | 6.9(2.0~24.0) |
| Su等[15] | 内科ICU | 32/150(21.3) | 58.5 | 0.9(0.9~1.0) |
| Smailes等[16] | 烧伤 | 17/125(13.6) | 60.0 | 9.1(4.0~20.6) |
| Kutchak 等[17] | 神经疾病 | 45/135(33.3) | 80.0 | 3.5(2.0~6.7) |
气道分泌物多或排痰障碍是NPPV的相对禁忌证,若因咳嗽能力弱而导致分泌物引流不畅,极易增加NPPV失败的风险。2017年一项临床研究纳入了因肺炎导致急性呼吸衰竭的患者(年龄>65岁,349例)[18]。在NPPV前,通过主动咳嗽力量将患者咳嗽强度分为0~5级,结果显示中度/强(3~5级)咳嗽能力的患者无创通气失败率(34.7%比79.8%,P<0.01)和院内病死率(32.1%比71.4%,P<0.01)均低于没有/弱(0~2级)咳嗽能力的患者[18]。没有/弱咳嗽能力会导致分泌物阻塞气道,降低无创通气的有效性,是NPPV的失败和院内死亡的独立危险因素,因此这类患者临床中使用NPPV时需更加谨慎。
拔管后使用无创序贯通气也是临床常用方式之一。2016年有关咳嗽峰流量的试验[19],研究者将所有患者分为拔管后预防性使用NPPV组和传统氧疗组,选取咳嗽峰流量临界值为70 L/min。结果发现大于临界值的人群使用NPPV和传统氧疗无明显差别,但是对于小于临界值的人群,预防性使用NPPV可以减少再插管率(72 h内重新插管率9%比35%,P<0.01;7 d内重新插管率24%比49%,P<0.01)和拔管后90 d病死率(43%比61%,P=0.02)[19]。大量咳嗽能力弱的患者因呼吸肌肉无力导致通气量不足,NPPV可以减少患者呼吸肌肉做功并增加通气量,所以拔管后预防性使用无创通气对咳嗽能力弱患者的预后是有益。
对于咳嗽能力弱的患者,拔管后应积极加强患者主动咳嗽能力的锻炼,常用方法如下:
对于因呼气肌无力而导致咳嗽能力弱的患者,指导咳嗽时取坐姿,肩膀内收,头和脊柱屈曲,前臂放松或给予支持;随后指导患者进行深而慢的经鼻腹式吸气,然后通过强化呼气肌从而达到促进患者咳嗽的目的[23]。
对于正常咳嗽时会产生气道塌陷的患者可以采取用力呼气技术,放松并用腹式呼吸一段时间后,保持声门开放,做1~2次用力呼气,通常会发出"哈、哈"的声音[24]。
嘱患者进行深吸气,吸气末医务人员在患者上腹部或肋弓下缘外侧施加压力。这个压力能增加呼气时的胸腔内压,增大呼气流速从而协助肺内分泌物移向主气道[25]。
在ICU中,通过自主呼吸试验的患者拔管前应常规评价咳嗽能力,估测拔管失败风险,以及提前制定拔管后的气道管理的方案。如若条件允许可测定咳嗽峰流量定量评价患者的咳嗽能力,或者使用主动咳嗽力量半定量评价,也可以通过白卡试验来直观判断,但目前未有研究证实何种评价方式最佳[23],有待临床研究进一步探讨。此外,在评价咳嗽能力的同时,还应结合患者的痰量和指令动作来综合判断拔管风险,提高拔管成功率。


























