版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
贫血在术前患者中较常见,如未有效治疗将会影响患者的手术及其预后,因此术前贫血的及时诊断和治疗非常重要。目前临床上对术前贫血未予足够重视,通常仅以输血纠正贫血或不干预直接手术,这不仅增加围手术期输血风险和手术风险,也会增加术后并发症的发生率和病死率。随着对围手术期患者血液管理的不断深入认识,国内外陆续发布了相关共识和指南。2016年,关节置换术安全性与效果评价项目组发布了《中国髋膝关节置换术加速康复——围手术期贫血诊治专家共识》,为骨科手术的围手术期贫血管理提供了指导。然而术前贫血不仅限于骨科手术患者,在其他手术科室亦常见,因此我们检索了国内外文献,结合已公开发表的相关共识和指南,广泛征询相关专业专家意见,制定了本共识,旨在为术前贫血的规范化诊疗提供依据(本共识不包括儿科手术患者)。
不同疾病的术前贫血情况存在一定的差异。一项系统性回顾研究显示,术前贫血发生率为5%~76%[1]。心脏手术术前贫血发生率为24%~37%[2,3],非心脏手术术前贫血的发生率为30%[4],其中膝髋关节手术为25%~45%[1],肿瘤患者为30%~90%[5],结直肠癌为30%~67%[6],妇科手术为24%~45%[7,8]。术前贫血的发生率随年龄增长而增加,80岁以上男性择期心脏手术患者中40%有术前贫血[9],女性由于月经及生育更容易发生贫血。国内20 308例关节置换术的数据表明,全髋关节置换术、全膝关节置换术和股骨头置换术的术前贫血发生率分别为30%、26%和44%[10]。
以缺铁最为常见,约占术前贫血的1/3。缺铁是结直肠癌患者、妇科肿瘤患者以及围产期孕妇最常见的术前贫血原因,其次为叶酸、维生素B12缺乏。
见于感染、急慢性炎症、恶性肿瘤、自身免疫性疾病等,可引起红细胞寿命缩短、骨髓对贫血的反应障碍、铁的利用和释放障碍[11]。
创伤、胃肠道肿瘤、女性月经过多、妇产科异常出血、应用非甾体消炎药、胃溃疡、痔疮、咯血、反复血液透析、医源性失血等。
伴发于慢性肾脏病、血液系统疾病、肿瘤骨髓浸润、放化疗后骨髓抑制、年老体弱等。
术前贫血是指从确定手术到接受手术前的间隔期,患者单位容积外周血液中血红蛋白(hemoglobin,Hb)浓度、红细胞计数和(或)红细胞比容低于可比人群正常值的下限。
诊断贫血的主要指标为Hb。目前常用的贫血诊断分级标准主要有世界卫生组织(WHO)标准和我国标准(表1,表2)[18,19],前者高于后者。第四版《血液病诊断及疗效判断标准》[19]认为应用WHO标准作为国内贫血的诊断标准是合理的。推荐采用WHO贫血诊断和分级标准,以早期识别和管理术前贫血。

诊断贫血的WHO标准和中国标准
诊断贫血的WHO标准和中国标准
| 人群 | WHO标准Hb(g/L) | 中国标准Hb(g/L) |
|---|---|---|
| 成年男性 | <130 | <120 |
| 成年女性 | <120 | <110 |
| 孕妇 | <110 | <100 |
注:WHO:世界卫生组织;Hb:在海平面水平的血红蛋白浓度
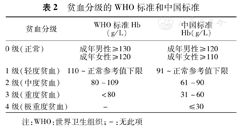
贫血分级的WHO标准和中国标准
贫血分级的WHO标准和中国标准
| 贫血分级 | WHO标准Hb(g/L) | 中国标准Hb(g/L) |
|---|---|---|
| 0级(正常) | 成年男性≥130 | 成年男性≥120 |
| 成年女性≥120 | 成年女性≥110 | |
| 1级(轻度贫血) | 110~正常参考值下限 | 91~正常参考值下限 |
| 2级(中度贫血) | 80~109 | 61~90 |
| 3级(重度贫血) | <80 | 31~60 |
| 4级(极重度贫血) | - | ≤30 |
注:WHO:世界卫生组织;-:无此项
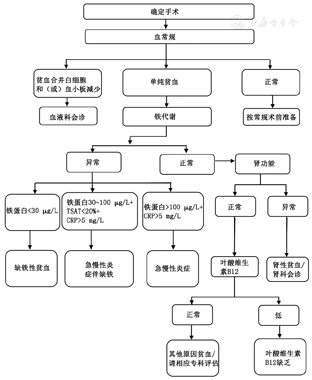
所有接受手术的患者均应进行术前贫血的评估。
从患者确定手术就应该开始进行贫血筛查,对于贫血患者应尽快明确病因并开始治疗。根据疾病、手术类型,权衡贫血与推迟手术的利弊决定贫血的治疗方法和手术时间。急诊手术也应充分利用术前准备时间完成贫血评估。
患者年龄、性别、身高与体重。患者有无贫血的症状(运动耐力下降、心悸、气短、头痛、头晕、晕厥、厌食、恶心等)、某些脏器(胃肠道、呼吸道、泌尿生殖道等)急慢性失血史、慢性疾病史(血液系统疾病、肝肾疾病、炎症性疾病、充血性心衰、肿瘤、感染、自身免疫性疾病、胃肠道吸收异常等)及体内人工瓣膜、既往史(输血史、脾脏切除等)、特殊药物接触史(非甾体消炎药、抗血小板药物、抗凝药物、抗生素、化疗药物、中药等)、药物过敏史、月经史、不良孕产史、家族史(镰状细胞性贫血、地中海贫血、遗传性球形红细胞增多症等)、饮食与营养状况等。
仔细地进行全身体格检查,应该特别注意皮肤及黏膜有无苍白、黄染、出血点;淋巴结、肝、脾是否肿大;心肺查体是否有异常;肛门指检是否有指套染血等。必要时行专科检查。
Hb、红细胞计数、红细胞比容、平均红细胞体积、平均红细胞Hb浓度可初步判断贫血类型;网织红细胞计数及比例可判断骨髓红系增生情况。
主要包括铁蛋白、转铁蛋白饱和度(TSAT)。铁蛋白反应铁储存状态,TSAT则反应循环中可利用铁的水平。铁蛋白<30 μg/L诊断铁缺乏的敏感度和特异度分别为92%和98%。在炎症情况下C反应蛋白(CRP)>5 mg/L,铁蛋白30~100 μg/L、TSAT<20%仍强烈提示铁缺乏,而铁蛋白>100 μg/L则通常提示铁利用障碍或功能性铁缺乏[20,21]。
可判断患者是否有巨幼细胞贫血。
可判断是否合并炎症。
有助于判断是否存在其他原发病引起的贫血。
以下情况需请相应专科会诊。
(1)外周血发现异常细胞;(2)贫血合并有中性粒细胞、淋巴细胞、单核细胞、血小板增加或减少;(3)2~4周药物治疗后贫血无改善。
发现肾功能异常者。
主管医生认为必要的其他情况可请相关科室会诊,如输血科、妇科、消化科等。
根据红细胞形态可将贫血分为大细胞性贫血、正细胞性贫血、小细胞低色素性贫血3种类型(表3)。
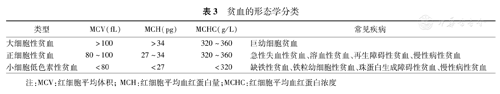
贫血的形态学分类
贫血的形态学分类
| 类型 | MCV(fL) | MCH(pg) | MCHC(g/L) | 常见疾病 |
|---|---|---|---|---|
| 大细胞性贫血 | >100 | >34 | 320~360 | 巨幼细胞贫血 |
| 正细胞性贫血 | 80~100 | 27~34 | 320~360 | 急性失血性贫血、溶血性贫血、再生障碍性贫血、慢性病性贫血 |
| 小细胞低色素性贫血 | <80 | <27 | <320 | 缺铁性贫血、铁粒幼细胞性贫血、珠蛋白生成障碍性贫血、慢性病性贫血 |
注:MCV:红细胞平均体积;MCH:红细胞平均血红蛋白量;MCHC:红细胞平均血红蛋白浓度
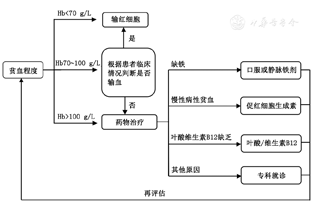
术前贫血的治疗首先应针对引起贫血的原发病进行治疗,其次是贫血的对症治疗。根据疾病、手术类型的不同,术前贫血的治疗目标应该不同。术前贫血(包括因术前自体储血导致的贫血)治疗流程见图2。

由于术前贫血患者需要尽快纠正贫血以进行手术,因此营养补充可以作为辅助治疗,但不建议单以膳食补充缺乏的营养元素。贫血患者注意调整饮食结构,注重食物多样化和合理搭配,缺铁性贫血患者可增加含铁丰富的食物,同时增加富含维生素C的食物摄入可促进铁的吸收。
根据《2014围手术期输血指南》[22]采用限制性输血策略:Hb<70 g/L应考虑输红细胞,Hb>100 g/L的患者不需输注红细胞;Hb在70~100 g/L之间,根据患者心肺代偿功能、有无代谢率增高以及有无活动性出血等因素决定是否输红细胞。针对不同的疾病人群最佳的输血阈值尚不明确,建议贫血患者输血目标应使Hb达到手术麻醉的安全阈值。
术前贫血患者建议监测生命体征,必要时吸氧,维持心功能及正常血压,以保持重要脏器氧供。减少及控制因疼痛、感染、创伤等造成的耗氧量增加。
术前补铁可适用于以下患者:缺铁性贫血、储存铁不足且预计失血量较大的手术、应用促红细胞生成素(EPO)时联合应用铁剂的患者。
铁缺乏或储存铁不足的非贫血患者可从术前补铁中受益[23]。另有研究发现在进行非心脏手术的女性中,Hb 120~129 g/L患者铁缺乏的发生率和Hb<120 g/L的患者相似,TSAT<20%的比例在Hb 120~129 g/L和Hb<120 g/L的患者之间也类似[24]。因此,大部分Hb 120~129 g/L的患者能从铁补充中受益,提高术前Hb水平,促进术后Hb恢复。
对铁剂过敏、铁过载患者。
常用口服铁剂及用法见表4,常用剂量是元素铁150~200 mg/d。有研究表明大剂量铁引起铁调素释放,导致铁的吸收减少;相反小剂量铁剂可使铁吸收最大化,疗效并未下降,反而能减少胃肠道反应、提高耐受性和依从性[25,26]。因此在《围手术期贫血和铁缺乏的管理国际共识》[24]中指出,如果术前有充足时间(至少6~8周)可给予口服小剂量铁40~60 mg/d或80~100 mg/隔天。同时服用维生素C 0.2 g/d以上的剂量可增加铁的吸收约30%。
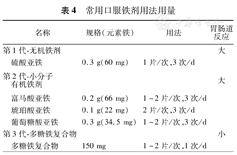
常用口服铁剂用法用量
常用口服铁剂用法用量
| 名称 | 规格(元素铁) | 用法 | 胃肠道反应 | |
|---|---|---|---|---|
| 第1代-无机铁剂 | 大 | |||
| 硫酸亚铁 | 0.3 g(60 mg) | 1片/次,3次/d | ||
| 第2代-小分子有机铁剂 | 大 | |||
| 富马酸亚铁 | 0.2 g(66 mg) | 1~2片/次,3次/d | ||
| 琥珀酸亚铁 | 0.1 g(22 mg) | 2片/次,3次/d | ||
| 葡萄糖酸亚铁 | 0.3 g(34.5 mg) | 1~2片/次,3次/d | ||
| 第3代-多糖铁复合物 | 小 | |||
| 多糖铁复合物 | 150 mg | 1~2片/次,1次/d | ||
口服铁剂的优点是使用方便。缺点:(1)生物利用度低:口服铁剂服用后仅有10%左右被人体吸收;(2)胃肠道不良反应重,如恶心、腹痛、便秘与腹泻等。口服铁剂依从性比较差,有1/3左右患者不能坚持,药物不良反应发生率为52%[27];(3)吸收受食物中的铁螯合物和一些常用药物如质子泵抑制剂等的影响。
口服铁剂有效者,网织红细胞在5~10 d后达高峰,之后网织红细胞逐渐下降、Hb逐渐升高。因此,口服铁剂后网织红细胞是否增高可作为判断治疗是否有效的依据。Hb升高速度与贫血严重程度有关,贫血越严重,上升速率越快,第18天左右Hb可达治疗前和正常Hb水平的中值,一般治疗后8周达正常Hb水平。铁蛋白的升高约在第4周开始。
术前静脉铁剂主要适用于4周内需要手术的患者、不能耐受口服铁剂、胃肠吸收障碍者、口服铁剂无效等患者。1项关于术前口服铁剂和静脉注射蔗糖铁剂的随机对照试验显示,静脉铁剂治疗更可能达到Hb目标值[28],并且在需要快速纠正贫血时,静脉铁剂更有优势。即使术前应用静脉铁剂时间<2周也可减少围手术期红细胞需求[29,30]。
静脉铁剂用法用量:所需补铁量(mg)=体重(kg)×(Hb目标值-Hb实际值)(g/L)×0.24+贮存铁量(500 mg)。大部分外科缺铁性贫血患者可补充1 000~1 500 mg铁。用法:100~200 mg/次,每周2~3次。
国内的静脉铁剂有蔗糖铁和右旋糖酐铁两种,两者改善贫血的疗效相似,但不良反应率有所不同。蔗糖铁相比于右旋糖酐铁,其总体不良反应率、严重不良反应率、病死率均明显降低[31,32]。考虑到安全性和药代动力学特点,推荐使用蔗糖铁。首次使用蔗糖铁时,先给予小剂量进行测试,成人用量20~50 mg,如使用静脉滴注方法,可先在15 min内输完试验剂量(相当于20 mg铁),如果无过敏反应,再输完余下的剂量。
静脉铁剂的优点是能够被人体完全吸收,起效快,无胃肠道刺激症状。主要的缺点是使用不方便和可能发生严重不良反应,其严重不良反应发生率为38/1 000 000,病死率为0.4/100 000[33]。2014《静脉铁高敏反应的风险最小化和管理的指南》指出:只要正确使用静脉铁剂,其受益超过风险[34]。
应用静脉铁剂后约50%患者在第5天Hb开始上升,3周即可达到最大疗效[35]。
用药期间应定期监测血常规、网织红细胞计数、血清铁蛋白水平以观察治疗反应。
叶酸和维生素B12主要用于叶酸或维生素B12缺乏引起的贫血。胃部手术、单纯素食者、孕妇是发生叶酸、维生素B12缺乏的高风险人群。
叶酸缺乏时,给予叶酸5~10 mg/次每天2~3次。一般在治疗3 d后网织红细胞开始上升,7 d可达高峰,Hb恢复正常一般在3~6周后。对胃肠道吸收不良或不能口服的病人,可用胃肠外给药,常用的是甲酰四氢叶酸3 mg肌肉注射每日1次。
维生素B12缺乏时,可服用腺苷钴胺或甲钴胺0.5 mg/次,3次/d,或者甲钴胺500 μg/次肌肉或静脉注射2~3次/周,直至Hb恢复正常。Hb在10 d内开始上升,8周恢复正常。
术前EPO主要用于术前贫血,但需除外造血原料缺乏、溶血、失血等原因引起的贫血。
EPO在术前应用能够显著提高Hb水平、降低输血率和异体血用量[36,37]。虽然EPO能够降低输血风险,但很少有证据支持EPO能改善患者的其他结局,因此英国血液标准委员会发布的《术前贫血识别和管理指南》[14]中仅推荐EPO用于需要避免输血(如拒绝输血或患有复杂自身免疫病的患者)的患者。对术前应用EPO还需进一步进行获益和风险方面的研究。
各种原因引起的血液高凝状态及未控制的严重高血压患者使用EPO时血栓栓塞风险增加,一般不推荐使用;对该药过敏的患者禁用。
一项关于EPO治疗骨科手术围手术期贫血的荟萃分析共纳入了26个研究3 560例骨科患者,EPO剂量、给药间隔、持续时间在各个研究中有所不同。13个研究团队用法为每周600 IU/kg,术前7~35 d开始,以术前21 d开始最多见。另外,不同用法EPO[15 000 IU(每周2次)与30 000 IU(每周1次)]对术前Hb水平、术后异体血输注比例的作用差异无统计学意义[38]。结合大部分文献和国内外相关指南推荐:如果距手术时间在4周以内,可以EPO每次600 IU/kg静脉注射或皮下注射,术前21、14、7 d以及手术当日各用1次;或者每次150 IU/kg,每周3次,在术前3周开始至手术当日。若距手术时间较短,可每次300 IU/kg,每天应用,术前5~7 d至术后3~5 d。
在EPO治疗期间可能发生绝对性或功能性缺铁,其原因可能是因为不能迅速动员和释放体内的储存铁以满足EPO刺激下骨髓造血加快对铁的需求。建议EPO治疗期间应同时联合铁剂以获得最佳疗效,TSAT应≥20%,铁蛋白应≥100 μg/L。文献报道的大部分研究联合应用了EPO和铁剂,通常铁剂和EPO同时开始应用,且多数研究认为EPO联合静脉铁剂疗效是最佳的[37]。
定期监测血常规,Hb目标值不宜超过120 g/L,红细胞比积不宜超过36%,以避免红细胞过高。同时应定期评估铁蛋白水平和TSAT。
(1)肿瘤相关性贫血患者术前应用EPO:肿瘤相关性贫血应用EPO仍然是有争议的。EPO治疗肿瘤化疗和放疗相关的贫血,能够改善患者生活质量和降低输血需求,但各文献对总体生存影响的报道不一[39,40]。而关于肿瘤相关性贫血在术前应用EPO的随机对照研究很少。一篇关于结直肠肿瘤术前应用EPO的系统综述总共纳入4个随机对照研究,结果发现无足够的证据支持在术前应用EPO[41]。《肿瘤相关性贫血临床实践指南》[42]指出,对于非化疗相关肿瘤相关性贫血,仅在进行姑息治疗者和怀疑是由于肿瘤相关性炎症引起的贫血(需排除所有引起贫血的显著原因)考虑应用EPO。因此,建议肿瘤患者如果需在术前应用EPO,应严格掌握适应证,并控制Hb初始值和目标值,Hb初始值≤100 g/L,目标值为Hb 110~120 g/L。(2)血栓高危患者需预防性抗凝:EPO有增加血栓形成的风险。文献报道在对未给予预防性抗凝治疗的脊柱手术患者应用EPO的研究中发现,使用EPO的患者相较于对照组有较高的血栓发生率[43]。但在预防性抗凝基础上应用EPO则不增加血栓栓塞风险[37]。因此,应注意深部血栓的预防。对于有高危血栓形成倾向的人群,在应用EPO同时给予预防性抗凝,并且Hb目标值不宜超过120 g/L。
本共识专家委员会名单(以姓氏笔画为序):于洋(解放军总医院输血科)、马曙轩(首都医科大学附属北京儿童医院输血科)、王秋实(中国医科大学附属盛京医院输血科)、王锡山(中国医学科学院肿瘤医院结直肠外科)、文爱清(陆军军医大学大坪医院野战外科研究所输血科)、石红霞(北京大学人民医院血液病研究所)、田文沁(北京大学人民医院输血科)、白连军(中国医学科学院北京协和医院输血科)、纪宏文(中国医学科学院阜外医院输血科)、米卫东(解放军总医院麻醉科)、李叶(北京医院妇产科)、李雁(首都医科大学附属北京世纪坛医院腹膜肿瘤外科)、李秀丽(解放军总医院妇产科)、李志强(上海交通大学附属第六人民医院输血科)、李翠莹(空军总医院输血科)、汪德清(解放军总医院输血科)、陈继营(解放军总医院骨科)、邵宗鸿(天津医科大学总医院血液科)、欧阳锡林(解放军总医院第一附属医院输血科)、林洁(解放军总医院输血科)、周俊(陆军总医院输血科)、郝一文(中国医科大学附属第一医院输血科)、赵国华(中国医学科学院肿瘤医院输血科)、宫济武(北京医院输血科)、骆群(解放军第三○七医院输血科)、钱宝华(海军军医大学第一附属医院输血科)、翁习生(中国医学科学院北京协和医院骨科)、谈春荣(首都医科大学附属北京世纪坛医院输血科)、唐云(解放军总医院普通外科)、蒋学兵(海军总医院输血科)、戴广海(解放军总医院肿瘤内科)
执笔专家:林洁(解放军总医院输血科)
审校专家:纪宏文(中国医学科学院阜外医院输血科)、李叶(北京医院妇产科)、李雁(首都医科大学附属北京世纪坛医院腹膜肿瘤外科)、李志强(上海交通大学附属第六人民医院输血科)、汪德清(解放军总医院输血科)、邵宗鸿(天津医科大学总医院血液科)、郝一文(中国医科大学附属第一医院输血科)、翁习生(北京协和医院骨科)