
探讨术后CT小肠造影(CTE)对克罗恩病(CD)患者术后复发及复发再手术的评估价值。
回顾性分析72例经手术治疗CD患者的术后CTE和临床资料,根据随访期间临床结局将其分为未复发组(6例)、复发未手术组(45例)和复发手术组(21例)。采用CTE半定量评分系统(0~ 3分)评估疾病活动性,对比3组之间的CTE评分差异;用Kaplan-Meier曲线分析不同CTE评分患者术后累积再手术率的情况。
72例患者中,未复发组均未发现病变,CTE评分均为0分;复发未手术组CTE评分为3(0~ 3)分;复发手术组CTE评分为3(2~ 3)分。未复发组、复发未手术组及复发手术组3组的CTE评分差异有统计学意义(P<0.001)。CTE 3分的患者术后再手术的比例高于CTE 2分者(P<0.001)。
CTE可评估CD患者术后肠道复发的状况,为临床选择个体化的治疗方法提供更多信息。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
克罗恩病(Crohn′s disease,CD)是一种慢性复发性炎症性肠病,病变肠道切除术后的复发率可高达90%[1,2,3],而且术后复发者面临再次手术的概率高于未手术者[4]。准确评估术后患者肠道疾病活动性的变化对制定后续的治疗方案、判定疗效和预后均具有重要意义。目前临床上使用的内镜Rutgeerts评分是评估CD术后复发的参考标准之一。但常规内镜检查具有侵入性,而且无法观察全部小肠及肠外情况,并可能引发肠穿孔等并发症[1]。CT小肠成像(CT enterography,CTE)可无创性清晰显示肠道情况,已广泛应用于临床上CD的诊断[5,6,7],而且CTE征象可准确提示疾病的活动性[8]。文献报道CTE与Rutgeerts评分在评估CD术后复发情况上具有良好的一致性[9]。目前国内少见CTE评估CD术后复发及其再次手术风险的研究。本研究对72例CD术后患者的资料进行回顾性分析,对随访期间再次手术和未手术患者的CTE征象进行评分,旨在探讨CTE对CD患者术后复发及复发再手术的评估作用。
回顾性收集2010年1月至2015年10月期间于中山大学附属第一医院就诊且符合以下纳入标准的患者:(1)年龄≥18岁,经临床、内镜(回结肠镜及胃镜)、影像和病理检查结果确诊为CD的患者[10];(2)行肠道手术治疗(肛瘘挂线术、肛周脓肿引流及其他部位脓肿引流除外);(3)术后3个月内第1次常规复查时的克罗恩病活动指数(Crohn′s disease activity index,CDAI)提示疾病为缓解期(CDAI<150);(4)肠道术后行CTE复查;(5)临床资料(病程记录、治疗方案、实验室检查和内镜检查等)详实完整。排除标准:(1)CTE图像不佳,无法用于诊断和评估者;(2)出现短期(术后1个月内)术后并发症者。本研究已通过中山大学附属第一医院伦理委员会审批(伦理委员会批号:伦审[2015]59号)。
收集并记录患者的一般资料,包括年龄、性别、病程、病变肠段、手术日期和方式、术后第1次常规复查的CDAI、术后第1次CTE检查结果、复发情况、复发时治疗情况、复发时间。术后临床症状、内镜或影像检查中有一项异常,定义为术后复发(包括原有未经手术切除的肠道病灶进一步加重及术前正常肠段的新发病变)[11]。术后复发的时间为手术至临床确诊复发的时间。复发后再手术的时间为第1次手术至第2次手术的时间。
扫描前8 h禁食(不禁饮)并口服泻药复方聚乙二醇电解质散(深圳万和制药有限公司)清洁肠道。右肘正中静脉留置针管。扫描前1 h分4次口服2.5%等渗甘露醇液2000 ml充盈肠道,每次间隔15 min。扫描前10 min用2.5%等渗甘露醇液300~ 500 ml灌肠。训练患者屏气。采用64排螺旋CT(Toshiba Aquillion 64,日本东芝)进行平扫加双期增强扫描,扫描参数:管电压120 kV,管电流200~ 250 mAs,矩阵512 × 512,螺距53,重建层厚0.5 mm,层间隔0.5 mm。患者取仰卧位,扫描范围自膈顶到盆底水平。增强扫描使用的高压注射器型号为MeoraoStellant SDS-CTP-QFT,以3.5~ 4.5 ml/s的速度注射碘普罗胺注射液(370 mgI/ml)1.5 ml/kg,总量不超120 ml,注射对比剂后随即以同样的速度注射0.9%生理盐水40 ml。注射对比剂后28 s行动脉期扫描,60 s行静脉期扫描。
由两位具有10年以上腹部影像诊断经验的医生在工作站(Vitrea2,version 3.9.0.1)上对CD术后的CTE图像进行独立评分,评分结果有争议时以一致意见为最终结果。CTE评分0分为未见病灶;1分为黏膜轻度欠光整或轻度的肠壁增厚及肠壁强化;2分为肠壁明显增厚伴黏膜密度增高,无狭窄或狭窄未导致近端肠管扩张;3分为明显的黏膜异常、管壁增厚,或靶征、肠外征象如肠系膜渗出、梳状征、肠系膜脂肪增生;或伴有近端肠管扩张的狭窄;或出现肠瘘、脓肿等并发症[9]。"靶征"定义为增厚的肠壁呈分层改变;"梳状征"定义为病变肠道肠系膜侧直小血管的增粗、迂曲和扩张;肠系膜脂肪增生,表现为肠系膜脂肪增多而引起肠管间隙增大;肠系膜炎性渗出,表现为病变肠道周围肠系膜脂肪模糊、密度增高,可伴积液;当充盈良好的病变肠道管径≤3 cm,伴或不伴近端肠管扩张和/或远端肠管塌陷者定义为狭窄[12,13,14]。
按照近段空肠、远段空肠、近段回肠、远段回肠(含末段回肠)、盲升结肠、横结肠、降结肠、乙状结肠、直肠对肠管进行分段。将肠壁增厚(>3 mm)或增强后异常高强化的肠管定义为病变肠段。
根据术后随访期内有无复发,把研究对象分为复发组和未复发组。根据针对疾病复发采取的治疗方式,进一步把复发组分为复发未手术组(复发后仅采用药物治疗),复发后需手术治疗者纳入复发手术组(复发后采取手术治疗)。未复发组及复发未手术组随访期截至2015年10月,复发手术组随访期截至第2次手术。比较各组间术后第1次CTE评分情况。再进一步比较复发组中,不同CTE评分患者的复发手术比例和累计手术率情况。
使用SPSS 20.0统计软件进行统计。符合正态分布的计量数值采用 ±s描述,非正态分布的计量资料采用中位数(最小值~最大值)描述,分类变量采用百分比表示。对有序分类资料进行Kruskal-Wail非参数检验。利用Kaplan-Meier法绘制复发再手术-时间曲线,用Log-rank检验进行分析。P<0.05为差异具有统计学意义。
±s描述,非正态分布的计量资料采用中位数(最小值~最大值)描述,分类变量采用百分比表示。对有序分类资料进行Kruskal-Wail非参数检验。利用Kaplan-Meier法绘制复发再手术-时间曲线,用Log-rank检验进行分析。P<0.05为差异具有统计学意义。
本研究排除2例因术后CTE图像质量欠佳的患者,最终纳入72例CD术后患者,其中男53例,女19例,年龄19~ 61(38.7 ± 11.0)岁。行结肠部分切除术16例,回结肠部分切除术10例,小肠部分切除术46例。
72例患者中,未复发组6例,复发未手术组45例,复发手术组21例,年龄分别为(32.5 ± 8.7)岁、(37.9 ± 11.3)岁和(42.1 ± 10.2)岁,病程分别为(6.0 ± 4.2)年、(8.1 ± 6.4)年和(7.1 ± 6.7)年。3组患者的年龄和病程差异无统计学意义。
72例患者术后第1次CTE距离手术的中位时间为12(1~ 216)个月。未复发组、复发未手术组和复发手术组患者术后首次CTE检查发现病变肠段分别为0、83和32个。115个病变肠段中,空肠和近段回肠26段,远段回肠46段,结直肠26段;发生于手术吻合口的病变肠段17段。
72例患者术后随访的中位时间为48(8~ 240)个月。随访期间共66例复发,复发的中位时间为14(2~ 216)个月。66例复发患者中,63例内镜或临床提示复发,64例CTE提示复发。63例术后内镜或临床症状复发患者中,61例CTE亦同时检测到肠道病变,2例CTE未见明确肠道病变。9例临床症状和内镜正常患者中,3例CTE可早期检测到肠道病变的复发(出现肠壁增厚、异常强化或其他征象)。复发手术组的21例患者,复发后再手术的中位时间为43(9~ 165)个月。
两位阅片者的CTE评分具有较好的一致性(Kappa值= 0.82,P<0.001)。未复发组内6例CTE评分均为0分。复发未手术组CTE评分为3(0~ 3)分,其中0分2例,1分7例,2分5例,3分31例。复发手术组CTE评分为3(2~ 3)分,其中0分0例,1分0例,2分2例,3分19例。3组CTE评分的差异有统计学意义(P<0.001),进一步分析,其中复发组(包括复发未手术组及复发手术组)的CTE评分高于未复发组[3(0~ 3)比0,P<0.001)]。
CTE 0、1、2和3分患者的例数分别为8、7、7、50例。CTE 0、1分的病例在随访期内均未行手术治疗。7例CTE 2分的病例中,2例因复发再手术治疗,另5例接受药物治疗;50例CTE 3分的病例中,19例(38%)术后再手术,另31例(62%)接受药物治疗。CTE 2分和3分的术后再手术率差异有统计学意义(P<0.001)。
4组不同的CTE评分组在术后的累计再手术率的差异无统计学意义(P= 0.089),见图1。以CTE= 3为预测界值,预测术后复发再手术的灵敏度达90.5%,特异性为31.1%。
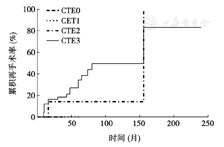

本研究利用CTE评分系统对CD患者术后情况进行分级评价。研究结果显示CTE可有效监测CD患者术后复发的情况,并对CD患者术后复发再手术的风险有一定程度的预测作用。
CD术后复发可导致患者承受更多的药物治疗甚至接受再次手术,严重影响患者生活质量[3,15,16]。CTE可为CD患者提供详细的术后肠道内外解剖情况改变及病情评估[17]。
CTE能有效监测CD术后复发。本研究采用多因素指标构建而成的CTE评分系统对所纳入的病变肠段进行较为全面的评估,未复发组、复发未手术组和复发手术组之间的CTE评分差异有统计学意义,并且评分呈逐渐增高的趋势。可见,CTE在监测CD术后肠道病变复发上具有较高的应用价值,与文献报道相符[18]。
CTE判断术后复发,与内镜或临床症状复发具有较好的一致性。本研究中63例术后内镜或临床症状复发患者中,61例CTE同时检测到肠道病变。文献报道CTE在CD患者术后复发的检出中与内镜具有好的相关性,尤其在空肠和近端回肠病变中具有更明显的优势,此结果与本研究相仿[1,9,18]。
与内镜或临床症状相比较,CTE预测CD术后复发更敏感。本研究中9例临床症状和内镜正常患者中,3例CTE可早期检测到肠道病变的复发。CTE可在临床症状或内镜检查异常之前就发现肠道内外病变,并进行病灶的精准定位和疾病严重程度的判断。Mao等[1]也认为CTE是除内镜外监测CD术后复发的一个重要手段和补充。
此外,术后CTE评分越高,提示患者需要接受药物甚至手术治疗的可能性越大。术后定期复查CTE有利于早期发现病变复发,为临床选择个体化治疗方案提供依据,避免病情进一步加重。
目前对CD患者术后复发是否再手术的评估尚无有效办法。文献报道通过C反应蛋白(CRP)水平提示术后并发症的存在以评估是否再手术,但CRP特异性低,并不能直观反映患者肠道情况[19]。CTE不仅可用于监测CD术后是否复发,而且通过半定量评分系统还具有一定的潜能以预测CD术后再手术的可能性。Mao等[1]的研究显示CTE比内镜检查更易于发现肠腔外病变(特别是瘘、脓肿等),从而及时转换临床治疗方案且术后CTE评分为2~ 3者再手术的概率上升。本研究结果显示,CTE 3分病例的术后再手术发生率高于CTE 2分者,而且CTE 3分预测术后再次手术风险的灵敏度较高。此外,根据术后复发再手术-时间趋势图,我们推测CTE 3分的病例相比其他评分者可能具有更高的手术发生率及更短的再手术时间间隔。因此CTE 3分对术后再手术的可能性具有一定的预测价值。结合本组研究结果,建议克罗恩病患者术后CTE 1分时可随访观察;CTE 2分时采用药物治疗并定期监测;当CTE 3分时需密切监测病情,观察有无手术指征并考虑再次进行手术治疗。
首先,本研究属于回顾性分析,无法规范控制各病例的随访时间、术后CTE时间以及随访期间的治疗方案等影响因素,可在未来的前瞻性研究中严格控制各影响因素以探索出更准确的预测结果。其次,CTE具有放射辐射的缺点,反复多次复查可增加患者的接受辐射量。目前国内外逐渐推广的MR小肠成像为CD影像检查的另一种方法,但CTE具有良好的密度分辨率且检查速度快,仍是国内CD检查的主要手段。
综上所述,CTE可帮助评估CD患者术后肠壁及肠外病变状况,明确是否复发及判断其严重程度,为临床选择个体化的治疗方法提供更多信息。



























