
探讨Castleman病的临床病理特点和预后相关因素。
对安徽省池州市人民医院10例Castleman病进行回顾性临床病理特征分析,包括临床资料、组织形态学,并复习相关文献。
10例患者中,8例男性,2例女性,年龄范围6~74岁。8例单中心型Castleman病(UCD)均为透明血管型,临床症状为淋巴结无痛性肿大,颈部4例,纵隔、肠系膜、颌下、腹膜后各1例,单纯手术切除;2例多中心型Castleman病(MCD)均为浆细胞型,患者全身多处淋巴结肿大伴呼吸系统症状,CHOP方案化疗6个疗程后症状缓解。10例Castleman病随访8~115个月,无复发。
Castleman病少见,多为UCD透明血管型,单纯手术可治愈;极少数为MCD浆细胞型,其临床综合治疗方案尚须进一步探讨。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Castleman病是一种具有不同临床表现及病理特征的反应性淋巴组织增生性疾病,绝大多数为单中心型Castleman病(UCD),累及单个或局部淋巴结,无临床症状,通常为透明血管型;少数为多中心型Castleman病(MCD),临床症状多样,常伴随其他疾病,通常为浆细胞型。现就安徽省池州市人民医院诊治的10例Castleman病结合文献复习报道如下。
10例Castleman病标本来自安徽省池州市人民医院2007年3月至2017年6月手术切除标本,均由经验丰富病理医师及外院会诊明确诊断。10例Castleman病中男性8例,女性2例,年龄范围6~74岁。肿瘤大小1.5 cm×1.0 cm×1.0 cm至11.0 cm×7.0 cm×4.0 cm。8例UCD,临床症状为淋巴结无痛性肿大,肿物位于颈部4例,纵隔、肠系膜、颌下、腹膜后各1例;2例MCD,患者全身多处淋巴结肿大,包括双侧颈部、耳后、腋窝、腹股沟以及纵隔和腹膜后,伴呼吸系统症状,如咳嗽、呼吸困难,CT检查示双肺弥漫病变,实验室检查示免疫球蛋白水平升高。
组织经4%中性甲醛溶液固定,石蜡包埋,HE染色制片。免疫组织化学采用EnVision二步法,所用抗体CD21、CD23、CD34、CD138及试剂盒均购自福州迈新生物技术开发有限公司,操作严格按说明书进行。
所有肿物切面灰白,质地均匀,未见出血坏死。8例UCD均为透明细胞型,滤泡间区小血管伸入生发中心,其周围淋巴细胞增生呈同心圆状排列;2例MCD为浆细胞型,光学显微镜下见淋巴滤泡增生,滤泡中心可见无定形嗜酸性物质沉积,外周小淋巴细胞同心圆样排列,滤泡间区大量成熟浆细胞增生(图1)。
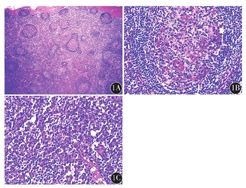

CD21、CD23滤泡树突阳性,CD34血管阳性,CD138浆细胞阳性。
8例UCD行单纯手术切除;2例MCD行CHOP方案(环磷酰胺、多柔比星、长春新碱、泼尼松)化疗共6个疗程,症状缓解。10例患者随访8~115个月,无复发。
Castleman病于1954年由Castleman等首次描述为一个良性的局部的增生性淋巴结肿大。Castleman病有不同的命名,包括巨大淋巴结增生、血管瘤性淋巴结错构瘤、血管滤泡性淋巴结增生、滤泡淋巴网状内皮细胞瘤、良性巨大淋巴瘤[1]。不同术语反映了Castleman病的病因和发病机制尚未完全阐明,有一种理论认为Castleman病是慢性抗原刺激的结果,其他一些理论侧重于淋巴结发育生长紊乱[2]。可能的机制包括:病毒感染,如人类疱疹病毒8(HHV-8)、人类免疫缺陷病毒(HIV)、EB病毒(EBV)等;细胞因子异常,如白细胞介素6(IL-6)异常等[3];滤泡树突细胞调节异常或发育异常[4]。目前认为高水平IL-6是Castleman病的主要致病机制,IL-6与其受体形成复合物后结合gp130,从而激活JKA-STAT信号途径,参与细胞增殖、分化、凋亡以及免疫调节等重要生理学过程[5]。IL-6在多种自身免疫性疾病及免疫缺陷性疾病中均有重要作用,提示Castleman病可能也是一种自身免疫性疾病,确切机制还有待进一步研究[5]。MCD在免疫抑制患者中更为常见,经证实50%患者HHV-8感染[6]。HHV-8感染者,复制中的HHV-8可编码病毒源IL-6,具有刺激B细胞增长和抗凋亡作用[7]。
Castleman病是一种罕见的淋巴组织增生性疾病,发病率为21/100万,UCD为15.9/100万,MCD为5.1/100万[2]。75%位于纵隔,15%发生在腹腔、腹膜后或盆腔,10%发生在头颈部,还有一些结外Castleman病报道,发生部位包括肺、喉、腮腺、胰腺等[2]。Castleman病通常发生于年轻人,无性别差异[1]。国内学者报道185例HIV阴性Castleman病患者,中位年龄37岁,UCD占65.4%,MCD占34.6%[8]。MCD通常发生在40~60岁,可累及多个淋巴结区域以及肝、肺、肾等重要脏器,几乎都有伴随症状,包括发热、盗汗、虚弱疲乏、食欲减退、体质量减轻和其他全身症状[4,9]。实验室检查异常包括血红蛋白减少、血小板减少、红细胞沉降率增高、肝功能异常、多克隆球蛋白增多[4]、高球蛋白血症、炎性标志物升高,致炎因子如IL-6、IL-10升高[10]。血清IL-6水平升高与疾病活动性呈正相关,Castleman病肿物切除可导致IL-6水平突然下降和症状消失[4]。本组10例患者中男性多于女性,8例UCD中4例位于颈部,表现为淋巴结无痛性肿大。2例MCD以咳嗽、发热入院,肺部弥漫性病变,全身多处淋巴结肿大,免疫球蛋白升高。
现已认识Castleman病的两种组织学类型,透明血管型显示生发中心退变或萎缩,淋巴细胞减少;浆细胞型显示原始生发中心增生[10]。国内大宗Castleman病研究报道透明血管型占71.4%,27%为浆细胞型,混合型1.6%[8]。Castleman病免疫组织化学缺乏特征性,CD21、CD23可显示滤泡树突网,CD34可显示血管增生和穿入生发中心,CD138可显示浆细胞,对诊断和分型有一定参考价值。鉴别诊断包括:(1)反应性滤泡增生。淋巴结滤泡增大并数量增加,超过正常皮质区,可达副皮质区,甚至髓质区,形态大小各异;(2)滤泡性淋巴瘤。淋巴结结构破坏,肿瘤性滤泡排列紧密,界限不清,缺乏套区。本组10例Castleman病中8例UCD均为透明血管型,2例MCD均为浆细胞型,淋巴滤泡增生,滤泡间区大量成熟浆细胞增生,经苏州医科大学会诊,诊断明确。
UCD单纯手术切除,预后良好,5年总生存率91%[2]。由于MCD罕见,缺乏足够的资料,目前尚无标准化治疗方案。一般认为手术治疗无效,治疗包括HHV-8抗病毒药物、免疫调节剂、皮质类固醇、COP方案(环磷酰胺、长春新碱、泼尼松)及CHOP方案化疗,大部分只能获得部分缓解。IL-6的异常表达有助于指导Castleman病的靶向治疗。抗IL-6R抗体的主要作用包括减轻炎症症状、缩小淋巴结、降低免疫球蛋白、改善贫血等[5]。最近对于HIV患者伴HHV-8相关MCD,推荐抗疱疹病毒药物更昔洛韦或抗CD20+ B细胞单克隆抗体利妥昔单抗[6]。
由于并发感染、多器官衰竭,偶有恶性肿瘤进展,伴发肿瘤包括卡波西肉瘤、淋巴瘤以及浆细胞恶病质[4],MCD预后差,5年总生存率65%[2]。70% MCD患者死于感染性并发症,30%死于癌症,中位生存期为诊断后14~30个月[11]。另有研究报道,HHV-8阳性MCD患者5年总生存率42%,而HHV-8阴性患者为75%[12]。因此有学者建议HHV-8需强制进行感染测试。Zhang等[8]认为年龄>40岁、脾大、低蛋白血症是MCD预后危险因素。本组10例Castleman病中8例UCD肿块单纯手术切除,2例MCD经CHOP方案化疗6个疗程后症状缓解,体表淋巴结未触及。10例Castleman病患者随访8~115个月无复发。
无



























