
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
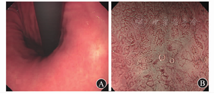
患者女,46岁,2017年3月就诊于南京大学医学院附属鼓楼医院肿瘤科,既往有高血压病、2型糖尿病史,无肿瘤家族史。服用"北京降压零号"控制血压,控制尚可;服用二甲双胍控制血糖,控制情况不详。2015年12月因卵巢占位于当地医院行右侧卵巢切除术,术后病理提示Krukenberg瘤,病理经外院会诊亦考虑Krukenberg瘤。行胃肠镜检查、全腹部CT检查、正电子发射计算机断层扫描(positron emission tomography-computed tomography,PET-CT)均未见明显异常,始终未能找见原发灶。在行首次化学治疗过程中胃肠道反应严重不能耐受,遂放弃化学治疗。就诊于南京大学医学院附属鼓楼医院后,在消化内科行胃镜检查发现胃体下部小弯侧有一直径<1 cm的白色浅凹陷性病灶(图1A),活组织病理学检查提示印戒细胞癌,实验室检查显示肿瘤标志物癌胚抗原、甲胎蛋白、CA125、糖类抗原72-4、糖类抗原242、CA19-9均在正常范围内,血常规、肝功能和肾功能检查基本正常。窄带成像放大内镜(narrow band imaging-magnifying endoscopy,NBI-ME)检查可见病灶边界线存在,微腺体结构消失,可见异常微血管(图1B)。行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)完整切除病变,术后病理提示胃印戒细胞癌,癌组织浸润黏膜固有层浅层(T1a期),病变范围约0.9 cm×0.4 cm(图2A)。肉眼分型为Ⅱc型,脉管未见癌组织侵犯,标本侧切缘和基底切缘未见肿瘤组织残留,周围胃黏膜呈轻度慢性非萎缩性胃炎。胃内病灶免疫组织化学染色示细胞角蛋白7(-)、细胞角蛋白20(+++)、绒毛蛋白(-)、黏蛋白2(-)、黏蛋白5AC(+,图2B)、黏蛋白6(-)、尾型同源框转录因子2(-)、细胞角蛋白(+)、增殖细胞核抗原67(约8%,+),卵巢肿瘤免疫组织化学染色示黏蛋白2(-)、黏蛋白5AC(+,图2C)、黏蛋白6(-),考虑胃内病灶与卵巢肿瘤同源。本例患者在卵巢手术后至入我院就诊近2年的时间里未进行任何治疗,其原发灶无进展且无明显其他部位转移证据。



转移性卵巢肿瘤约占所有卵巢肿瘤的7%~21%[1,2,3],而其中组织学特点为印戒状黏液细胞的Krukenberg瘤至少占10%[4]。Krukenberg瘤是来源于生殖道以外的卵巢转移癌的一种,其组织学标准为肿瘤生长在卵巢内、光学显微镜下可见印戒状黏液细胞、卵巢间质伴有肉瘤样浸润[5]。由于患者的后续治疗和预后情况与原发灶明确相关,找寻原发病灶尤为重要。
Krukenberg瘤常见的原发部位是消化道,以胃癌最为多见,约占70%,其他原发病灶部位包括结肠、乳腺、胆囊、阑尾等[6,7]。Krukenberg瘤发病率及原发灶部位存在地区性差异。在欧洲,报道显示Krukenberg瘤占卵巢肿瘤的15%,原发灶位于消化道者占39%[7]。而在日本,据报道Krukeberg瘤占所有卵巢肿瘤的29%,原发灶约69.6%~72.0%来源为胃[3,8]。本例患者因卵巢肿瘤就诊,行外科手术治疗后,术后病理提示Krukenberg瘤,在外院多次行胃肠镜、全腹部CT、PET-CT检查均无阳性发现。此次在南京大学医学院附属鼓楼医院行胃镜检查过程中发现原发灶,该病灶较隐匿。对于部分隐匿性病灶,即使反复行胃肠镜检查仍可能漏诊。有报道3 mm的黏膜内癌出现卵巢转移[6],原发灶小较难寻找,甚至有患者在死亡后尸体解剖过程中才发现胃部原发灶[9]。Lee等[10]通过随机多部位活组织检查的方法找到原发灶,该方法在找寻原发灶困难时可尝试。随着内镜功能的发展,使用放大内镜或染色内镜可以对可疑病变进行详细观察,并可以进行精准的活组织检查以提高原发灶的检出率。
Krukenberg瘤转移机制有种植转移和淋巴转移学说等,目前比较认同的是经淋巴结转移,有研究表明淋巴结转移的数量越多,胃癌出现卵巢转移的风险越高[11]。如果胃癌浸润深度不超过黏膜下层500 μm,其淋巴结转移率为0~3.1%,而超过黏膜下层500 μm后淋巴结转移率可高达20%[12]。黏膜内癌的转移率较低,其中低分化型黏膜内癌较分化型转移率高。一般认为Krukenberg瘤的出现是晚期事件。腹水是Krukenberg瘤常见的特征,Krukenberg瘤患者同时发现腹水的比例接近50%[13,14],但无法判断Krukenberg瘤与腹水出现的先后,因此Krukenbrerg瘤的出现系晚期事件这一观点仍存疑。Kakushima等[13]通过总结一些黏膜内癌合并Krukenberg瘤的病例特点发现,患者发病年龄相对年轻,多数卵巢肿瘤与原发病灶同时被发现或先于原发灶被发现,内镜下形态均是Ⅱc型病变,大小为3~4 cm不等,组织学类型为低分化型腺癌或印戒细胞癌。本例患者特点与上述病例类似,患者除组织学分化差外并不符合其他淋巴结转移的高危因素,背景黏膜无萎缩表现,因此其转移是如何发生的目前尚不明确。
Krukenberg瘤好发于生育期妇女,平均诊断年龄为40~50岁,其预后差,中位生存期为7~14个月[15,16]。目前尚未确立最佳治疗策略,是否行减瘤手术仍存在争议。有部分研究表明,对原发灶在肠道以及乳腺的Krukenberg瘤行外科手术治疗可延长总体生存时间,但原发灶为胃的Krukenberg瘤似乎并不能通过减瘤手术使患者获益[17,18]。对于本例患者来说,胃内病灶是否为15个月前卵巢转移灶的原发病灶不能明确,下一步如何处理较为棘手。在患者及家属不考虑外科手术治疗的情况下,对其进行了ESD。根据免疫组织化学结果,考虑胃内病灶与卵巢转移灶同源。虽然黏膜内癌出现转移的概率小,但仍有部分比例,因此在临床上对于<1 cm的未分化型癌行ESD前应进行充分的评估,术前尽可能排除远处转移可能。
通过本例患者的诊治经验并结合相关文献,认为对于高度怀疑Krukenberg瘤但原发灶隐匿的病例可通过反复的胃镜检查或多部位随机活组织检查提高原发灶的发现率,可尝试使用放大内镜和染色内镜检查。检查过程中重点观察是否存在Ⅱc型病变。对于黏膜内癌,虽然其转移率低,但是在行ESD前仍需注意加强术前评估,特别是对于扩大适应证的患者。


























