
近年维生素D研究在非骨骼健康方面取得了重要进展,维生素D缺乏或不足可导致儿童呼吸道感染(RTI)易感性增高。血清25羟基维生素D[25(OH)D]水平<38 μg/L(95 nmol/L)容易发生RTI。每日或每周补充维生素D对RTI有预防作用。维生素D对免疫系统有重要影响,通过活性1,25二羟基D[1,25(OH)2D]结合维生素D受体(VDR)直接或间接调节200多种不同的基因。对先天性免疫的调节引起下游反应产生抗微生物肽、β-防御素导致对各类病原菌的杀灭。另外对适应性免疫的调节[辅助性T淋巴细胞(Th)1、Th2、调节性T淋巴(Treg)细胞和Th17]及通过调节核因子-κB(NF-κB)途径调节炎症级联反应,这些均有益于防治儿童RTI。本文还介绍了美国医学研究所以骨骼健康为主推荐的每日补充维生素D的量及上限,以及其他非骨骼系统疾病患者体最佳25(OH)D水平、预防和治疗补充维生素D的推荐剂量,旨在进一步认识维生素D,并介绍其在防治儿童RTI中的作用研究进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
呼吸道感染(RTI)是儿童发病和死亡最常见的疾病,对儿童健康危害很大。多年来,人们一直在寻求一种既简便有效且价格低亷的方法来减少RTI对儿童的危害。近10多年来对维生素D的研究发现,其与儿童RTI的关系愈来愈明确。维生素D除了对骨骼和肌肉健康有重要作用外,还是一种对骨外代谢有重要影响的类固醇激素[1]。研究表明,维生素D调节人类基因高达5%,并诱导≥36种不同类型细胞的生理反应,调节白细胞中291个基因表达,参与160个以上不同生物学代谢途径。在这些基因中,与人体免疫反应相关的基因最受关注,研究支持维生素D作为一种重要的人体免疫调节剂[1]。维生素D还与自身免疫性疾病、心血管疾病、糖尿病、感染性疾病、肥胖症、神经精神疾病甚至恶性肿瘤有关[2]。
研究表明,维生素D缺乏可导致儿童RTI的易感性,以血清25羟维生素D[25(OH)D]水平<38 μg/L(95 nmol/L;1 nmol/L=2.5 μg/L,下同)为界,其水平愈低则发生急性呼吸道感染(ARTI)的风险愈高[3]。维生素D的新功能(多效性)引起了医学界的广泛兴趣,鼓励人们尝试用补充维生素D来防治儿童RTI。现就维生素D在防治儿童RTI中的作用研究进展进行综述。
维生素D的作用是由胞质受体即维生素D受体(VDR)介导的。VDR通过维生素D作用各种不同的机制调控。维生素D代谢的活性产物1,25(OH)2D结合VDR后进入细胞核作为配体转录因子并用于调控基因转录。VDR是类固醇,激素核受体家族的成员,其位于巨噬细胞、树突状细胞(DC)、活化的T淋巴细胞和约30余种不同组织包括肠和胎儿组织中其他类型的细胞中[4]。VDR的结构包含α-螺旋配体结合结构域和高度保守的DNA结合结构域,其通过与类视黄醇-X受体(RXR)的异源二聚化,然后与目标基因调控区域中的维生素D应答元件(VDRE)结合[5]。VDRE通常位于基因启动子附近,有超过1 000个具有VDRE结合位点的基因,包括AMP[抗微生物肽,如cathelicidin(导管素)]、β-防御素、25(OH)D24-羟化酶(CYP24)基因等。事实上,5%的人类基因组被VDR直接或间接调节,这就解释了维生素D在预防各种疾病包括儿童RTI中的作用机制。
VDR基因位于染色体12q13.1,有几个多态区域,这与某些疾病的易感性有关。这意味着不仅维生素D缺乏与某些疾病的风险有关,而且也与VDR的功能状态和多态性有关[6]。最近由单粒子低温电磁场电子显微镜获取并经三维重建的VDR/RXR/DNA复合物立体结构已经建立,使用最新小角度X射线散射和氢氘交换技术也证实了这种结构[7]。
先天免疫系统的多种细胞类型,包括呼吸道上皮细胞、巨噬细胞、单核细胞和DC,均有将循环中无活性的25(OH)D转化为有活性的1,25(OH)2D所需的酶(CYP27B1)。VDR的免疫调节途径已被揭示,如维生素D介导宿主对结核(TB)感染反应的可能机制是,在巨噬细胞中Toll样受体2(TLR2)通过结核分枝杆菌(M.Tb)被活化,上调CYP27B1和VDR。这些事件导致下游反应产生抗微生物肽导管素(cathelicidin)和β-防御素(DEFB4),使之产生较强杀灭M.Tb的能力。随后的实验也证实维生素D诱导使维生素D依赖性导管素和β-防御素上调[8]。
除了对TB的作用外,导管素对革兰阳性和阴性菌均具有广泛的抗菌活性,亦具有抗病毒作用。在病毒感染的情况下,肺上皮细胞能够将无活性维生素D转化为有活性1,25(OH)2D使导管素产生增加。研究证明,在感染甲型流感的小鼠中,用导管素治疗可降低疾病严重程度和病毒复制[9]。
维生素D引起先天抗菌效应的机制还包括对活性氧中间体的诱导和抗菌自噬的激活[10]。
在抗原刺激下,T淋巴细胞分化成产生细胞因子的辅助性T淋巴(Th)1细胞或Th2细胞亚组。Th1细胞本质上具有更多的促炎作用,产生包括白细胞介素(IL)-2,γ干扰素(IFN-γ)和肿瘤坏死因子(TNF)-α等物质,而Th2细胞本质上更具有抗炎和抗过敏作用,产生包括IL-3、IL-4、IL-5和IL-10细胞因子。重要的是通过激活T淋巴细胞VDR,维生素D抑制Th1增殖和细胞因子产生,同时促进Th2细胞增殖和细胞因子及调节性T淋巴细胞(Treg细胞)的生成[11]。鉴于TNF-α、IFN-γ和Th1细胞的促炎特征引起的强烈炎症作用,补充维生素D有助于调节感染个体的炎性反应。维生素D缺乏可能导致感染个体免疫反应"失调"和引发更多的促炎反应,这也是补充维生素D防治RTI的重要机制之一。
1,25(OH)2D还诱导调节Treg细胞(抑制炎症的重要细胞),如介导Foxp3(转录因子,参与Treg细胞的发育和功能)诱导[12]。1,25(OH)2D还抑制涉及多种自身免疫性疾病发病机制的IL-17,阻断活化T细胞核因子(NFAT)和Runt相关转录因子1(Runx1)与IL-17启动子的结合[13]。DC是最有效的抗原呈递细胞,研究表明1,25(OH)2D通过依赖性VDR来抑制DC的分化、成熟、免疫刺激能力,导致其发生免疫耐受,其结果在于诱导Treg细胞抑制炎性效应性T淋巴细胞。1,25(OH)2D与VDR也可直接作用于T淋巴细胞抑制其增殖[14]。
维生素D还通过调节核因子κB(NF-κB)途径来调节炎症级联反应。病原体相关分子模式(PAMPs)来源于细菌、病毒、真菌和原生动物的脂多糖(LPS)、脂蛋白、鞭毛蛋白、细菌DNA和病毒RNA。这些PAMP激活存在于各类免疫细胞中的特异性Toll样受体(TLR)中,各种TLR信号通路诱导NF-κB途径,其上调促炎细胞因子表达。NF-κB通过与称之为核因子κB抑制蛋白(IκB)的物质相互作用来调节。在病毒感染的呼吸道上皮细胞中,维生素D上调NF-κB抑制因子α(IκBα),并通过结合NF-κB亚基来降低NF-κB信号传导,使多种促炎细胞因子减少[15]。维生素D对IκBα的上调已在用假单胞菌LPS处理的囊性纤维化呼吸道上皮细胞的实验中得到证实。
急性上呼吸道感染(AURTI)病原体涉及200多种病毒。下呼吸道感染(LRTI)涉及病毒和细菌。防治ARTI对保障小儿健康及减少医疗费用支出均具有重要意义。
流行病学研究表明,季节性流感、AURTI和社区获得性肺炎(CAP)均与缺少阳光照射导致体内维生素D不足有关。临床研究表明,血清25(OH)D水平与ARTI的发生风险呈负相关。Ginde等[16]对美国第3次健康、营养调查数据进行二次分析,发现血清25(OH)D水平(<30 μg/L)与患ARTI风险之间存在显著的负相关,在哮喘和慢性肺阻塞性疾病时更为显著。另一项不同时期的美国健康、营养调查研究也揭示,人体25(OH)D水平与RTI风险呈线性负相关,直至达到30 μg/L时ARTI的发生才明显减少[17]。为什么血清25(OH)D水平<30 μg/L患ARTI的风险增加?补充维生素D可恢复导管素信使RNA的诱导。对于导管素信使RNA的最佳诱导,25(OH)D水平≥30 μg/L可能是必需的。另外,在低维生素D状态下巨噬细胞功能失调很明显,从而影响巨噬细胞免疫功能的正常表达[16]。
Berry等[18]研究发现维生素D水平与季节性流感和肺功能降低呈线性关系,血清25(OH)D水平每增加10 nmol/L(4 μg/L),呼吸道感染的危险性降低7%,肺功能第1秒用力呼气量增加8%,用力肺活量则增加13 mL。还有研究发现,脐血中25(OH)D<30 μg/L,2岁儿童患急性下呼吸道感染(ALRTI)的危险性增加,提示从出生开始即有必要对新生儿进行维生素D补充[19]。
最近一份高质量有10 933名参与者的25项随机对照试验荟萃分析结论,每日或每周补充维生素D对RTI总体有保护作用。基线维生素D水平较低者保护作用最强。每1~3个月单剂单次或多次补充则无保护作用。认为单剂较大剂量维生素D推注后,25(OH)D血药浓度大幅波动的不利影响,会影响长期负责调节1,25(OH)2D合成和降解酶的活性变化,导致该代谢物在肾外组织中水平降低,这可以减弱维生素D对RTI保护性免疫应答的能力[20]。
急性咽、扁桃体炎是儿童就诊的主要原因之一,一些儿童有复发性咽炎,似乎与扁桃体组织中的细菌生物膜形成有关,抗生素治疗效果较差。补充维生素D治疗通过抑制细菌生物膜形成,可预防复发性咽炎发作。
新西兰研究了33例正在接受扁桃体切除术治疗呼吸困难/睡眠呼吸暂停和/或复发性咽炎的儿童。测量了儿童的25(OH)D、铁和锌的水平。33例中78.8%的患儿血清25(OH)D水平<25 μg/L,15.6%的水平<20 μg/L。低25(OH)D水平与容易发生急性咽、扁桃体炎有关。
Yildiz等[21]研究表明,低血清维生素D水平可能是复发性咽喉炎的危险因素,因为患有复发性扁桃体炎的儿童血清25(OH)D水平低于健康儿童。
最近的证据表明,维生素D具有促进人类鼻窦上皮细胞的抗炎作用[22]。一项研究评估了伴或不伴鼻息肉的过敏性鼻窦炎患儿血清25(OH)D水平,发现健康对照组和无息肉鼻窦炎组间平均维生素D水平差异无统计学意义,而有息肉鼻窦炎组和过敏性真菌性鼻炎、鼻窦炎平均水平均远低于30 μg/L的最低推荐水平,且显著低于对照组和无息肉鼻窦炎组水平。变应性鼻窦炎伴息肉者其血清25(OH)D低于推荐正常水平,且与RS的发生风险增加相关[23]。
ALRI是全球儿童死亡最重要的原因。随机对照研究的荟萃分析显示,儿科患者预防性补充维生素D显著降低了RTI的可能性。最近对子宫内维生素D暴露与儿童RTI间相关性综述发现,子宫内较高维生素D暴露降低了幼儿LRTI(肺炎、细支气管炎、喘息性支气管炎或其他肺部感染)的发生风险[24]。
细支气管炎主要由呼吸道合胞病毒(RSV)引起。补充维生素D可防止发生严重细支气管炎,体外试验显示,维生素D可以降低呼吸道上皮细胞对RSV感染的炎性反应。此外,VDR多态性与婴儿期住院的急性细支气管炎相关。现有文献荟萃分析支持VDR多态性的Fokl位VDR和RSV严重性之间有关联。VDR多态性状态测定有助于预测高危婴儿并采取预防措施。
关于CAP在儿童中的发病率和病死率,有学者进行病例对照研究以确定营养性佝偻病在肺炎中的作用,通过逻辑回归校正家庭大小、出生顺序、居住拥挤程度和纯母乳喂养月数等混杂因素得出结论,维生素D或钙缺乏可能是发展中国家<5岁儿童肺炎的重要诱因,补充维生素D或补钙可能会使这些儿童肺炎的发病率和病死率明显降低。最近在103例CAP患儿研究中,Ren等[25]发现严重CAP组平均维生素D水平明显低于轻度CAP组和对照组(P<0.01)。早产和维生素D<20 μg/L是严重CAP的危险因素,维生素D缺乏与儿童CAP的严重程度有关。
VDR多态性与CAP风险相关,中国儿童研究表明,VDR基因rs2239185的TT基因型可能是CAP的遗传风险因子,rs2239185的T等位基因可能与CAP易感性和严重程度相关[26]。
日本一项随机双盲研究介绍,将430例6~15岁学龄儿童分为补充维生素D组和安慰剂组,2组在性别、年龄、身高、体质量、家庭结构、既往病史方面基本相似。维生素D组补充1 200 IU/d,观察时间为冬季4个月,失联102例。结果补充维生素D组167例中18例发生甲型流感(10.08%),而安慰剂组171例中则有31例发生甲型流感(18.60%),2组比较差异有统计学意义(P=0.04)。作者认为,补充维生素D可能通过上调抗微生物肽而增强先天免疫力,保护儿童免受甲型流感感染。此外,维生素D还可通过减少细胞因子分泌来减轻流感的临床症状和体征[27]。
最近的一项多中心随机对照试验中,146例患者在开始标准治疗时分别接受维生素D或安慰剂,在开始治疗后的14 d、28 d和42 d进行评估,发现维生素D组对痰培养转阴时间无明显影响,但是具有TaqI VDR多态性的TT基因型的参与者显著加速了痰培养物的转阴,FokⅠ VDR多态性则降低了抗菌的活性[28]。此外,血清25(OH)D水平低与发生多重耐药性结核病(MDR TB)的风险相关。一项印度研究观察了266例胸内结核病(肺、胸膜TB)患儿,186例(69.9%)儿童维生素D缺乏[血清25(OH)D <12 μg/L],55例(20.7%)维生素D不足(12~<20 μg/L)和25例(9.4%)维生素D足够(≥20 μg/L)。经2个月抗结核病强化治疗后,25(OH)D足够者100%痰涂片/培养阴性,而维生素D缺乏的儿童痰涂片/培养阴性者则分别为66%和80% [28]。
还有研究表明,维生素D诱导产生反应性一氧化氮(NO),通过抑制与发生肺空洞有关的非活性基质金属蛋白酶(MMP)降低组织损伤。维生素D还诱导抗菌肽导管素刺激M.Tb自噬[29]。
血清25(OH)D值多少为正常?维生素D缺乏、不足、充足等理想的基线水平是多少?至今尚无统一的标准,尚存在许多争议。旧的维生素D缺乏标准25(OH)D<11 μg/L只能保证不出现佝偻病典型影像学表现。25(OH)D≥30 μg/L能使骨骼代谢指标,如骨密度、钙吸收率、甲状旁腺素(PTH)保持正常。维生素D是一种类固醇激素,除与矿物质的平衡有关外,还有其他重要的生理功能,包括调节细胞分化、增生及免疫功能等。因此,基于钙稳态和骨转化确定维生素D是否足量不能反映维生素D所有的潜在作用。对人群维生素D理想状态的确定不仅要考虑血清25(OH)D水平与PTH及肠道钙吸收的关系,也要考虑其与疾病的关系。
最近有研究指出,最优人体25(OH)D水平为30~50 μg/L,最小有效水平可能依组织不同而有差异。有研究总结了部分与骨疾病和非骨系统疾病风险有关的25(OH)D最低有效水平,骨疾病:佝偻病10 μg/L;骨质疏松症20 μg/L;骨折20 μg/L;非骨骼疾病:过早死亡30 μg/L;抑郁症30 μg/L;糖尿病32 μg/L;心血管疾病32 μg/L;RTI 38 μg/L;跌倒38 μg/L;癌症40 g/L[30]。亦有研究认为提供免疫调节效应至少需要20~50 μg/L;使机体处在最佳健康状态至少需要30~40 μg/L[31]。欧洲指南推荐的25(OH)D水平最佳范围为30~50 μg/L。
我国专家认为:维生素D缺乏性佝偻病:血清25(OH)D水平11 μg/L或10 μg/L;维生素D缺乏:<20 μg/L;维生素D不足:20~30 μg/L;维生素D充足:30~100 μg/L;维生素D过量:100~150 μg/L;维生素D中毒:>150 μg/L。我国儿童(0~14岁)血清25(OH)D水平正常参考值为15~100 μg/L较为合适[32],也可作为参考。
人类食物中维生素D含量很少,只能靠阳光照射皮肤合成或补充剂而获得。当上午10点到下午3点间太阳较垂直于地球表面时,如有人体表面积30%的皮肤暴露在阳光紫外线B射线下15~30 min,激活表皮中7-脱氢胆固醇便能合成10 000~20 000 IU的维生素D[33]。婴儿如果每日摄入500 mL配方奶,可摄取维生素D约200 IU/d。
美国医学研究所(IOM)推荐了以骨骼健康为主的每日维生素D摄入量及其上限[34],见表1。
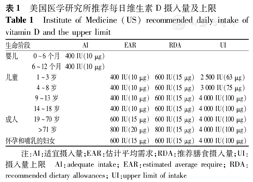
美国医学研究所推荐每日维生素D摄入量及上限
Institute of Medicine (US) recommended daily intake of vitamin D and the upper limit
美国医学研究所推荐每日维生素D摄入量及上限
Institute of Medicine (US) recommended daily intake of vitamin D and the upper limit
| 生命阶段 | AI | EAR | RDA | UI | |
|---|---|---|---|---|---|
| 婴儿 | 0~6个月 | 400 IU(10 μg) | |||
| 6~12个月 | 400 IU(10 μg) | ||||
| 儿童 | 1~3岁 | 400 IU(10 μg) | 600 IU(15 μg) | 2 500 IU(63 μg) | |
| 4~8岁 | 400 IU(10 μg) | 600 IU(15 μg) | 3 000 IU(75 μg) | ||
| 9~13岁 | 400 IU(10 μg) | 600 IU(15 μg) | 4 000 IU(100 μg) | ||
| 14~18岁 | 400 IU(10 μg) | 600 IU(15 μg) | 4 000 IU(100 μg) | ||
| 成人 | 19~70岁 | 600 IU(15 μg) | 600 IU(15 μg) | 4 000 IU(100 μg) | |
| >71岁 | 800 IU(20 μg) | 800 IU(15 μg) | 4 000 IU(100 μg) | ||
| 怀孕和哺乳的妇女 | 600 IU(15 μg) | 600 IU(15 μg) | 4 000 IU(100 μg) | ||
注:AI:适宜摄入量;EAR:估计平均需求;RDA:推荐膳食摄入量;UI:摄入量上限 AI:adequate intake; EAR:estimated average require; RDA:recommended dietary allowances; UI:upper limit of intake
大多数研究认为,人类健康的最低25(OH)D水平为30~50 μg/L或40~60 μg/L,而不是IOM推荐的20 μg/L,即使对于适当的骨骼矿化亦是如此。美国内分泌学会提出预防和治疗维生素D缺乏的建议血清25(OH)D水平应>30 μg/L,优选范围40~60 μg/L。建议婴儿服用维生素D 400~1 000 IU/d,时间长达1年;>1岁儿童服用维生素D 600~1 000 IU/d;所有成年人1 000~2 000 IU/d[35]。
对患有疾病者补充维生素D,明智的选择要因病而异。最近发布的"预防和治疗营养性佝偻病全球共识"就是典型的例子[36]。综合其他一些国际组织的建议,一般来说,对大多数特定疾病一致认为建议最低25(OH)D水平应为30 μg/L,上限高达50 μg/L或60 μg/L,获得和维持上述25(OH)D水平需补充维生素D 3 000~5 000 IU/d[35]。
有研究将140例免疫缺陷且频繁发生RTI的患者各70例分成维生素D干预组和对照组。维生素D干预组补充4 000 IU/d 1年。3个月后2组25(OH)D水平分别为133.4 nmol/L和66.6 nmol/L(P<0.001),这一水平差别一直维持到研究终结。采用"感染评分法"进行评估,干预组得分202分,对照组得分249分。研究终点时无论是总评分还是在接收抗生素治疗概率上(干预组减小抗生素使用63.5%)2组差异均有统计学意义(P<0.05)。此外,干预组细菌培养和微生物发现数量明显减少。这些结果支持维生素D补充具有阻止RTI发生,并减少抗生素使用的重要作用[37]。研究还观察到时间依赖性,时间>6个月的维生素D补充治疗可能是影响这类患者免疫功能所必需的。
对实验室确认有维生素D缺乏,即25(OH)D水平<20 μg/L者应实施治疗。依年龄、体质量及居住地域因素治疗1~3个月。剂量如下:新生儿1 000 IU/d;婴幼儿2 000~3 000 IU/d:1~18岁儿童和青少年3 000~5 000 IU/d;成人和老年人7 000~10 000 IU/d,或口服50 000 IU/每周[34]。对肥胖、吸收不良综合征和服用影响维生素D代谢药物(如苯巴比妥,丙戊酸和酮康唑等)者采用大剂量维生素D(2~3倍剂量,至少6 000~10 000 IU/d)治疗维生素D缺乏,使25(OH)D水平达到30 μg/L以上,之后用3 000~6 000 IU/d预防。上述维生素D的治疗剂量是安全的,但用大剂量时最好是在医师的监管下应用。
近年研究表明,儿童RTI者其血凊25(OH)D水平一般均较低,低血清25(OH)D水平与儿童RTI的发生风险相关。通过补充维生素D来防治儿童RTI的努力似乎看到了希望。近年研究虽然取得了许多进展,但也有研究提出了一些相矛盾的结论[38]。因此,还需进一步研究界定人体血清25(OH)D理想的基线水平,确定补充维生素D的最优剂量,VDR的多态性使治疗措施可能要因人、因病而异。总之,应该寻找出一个既有循证医学依据又可操作的临床方案,还需不断努力。



























