
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
直接抗病毒药物(direct-acting antiviral agents,DAA)治疗慢性丙型肝炎具有持续病毒学应答率高、疗程短、不良反应发生率低等优点,已广泛用于慢性丙型肝炎抗病毒治疗[1,2,3]。但是,大部分DAA经过多种药物代谢酶代谢和不同的药物转运蛋白进行转运,容易与其他药物产生药物相互作用(drug-drug interactions,DDI)[4]。
DDI是指两种或两种以上药物同时或在一定时间内先后使用时,在机体因素(药物代谢酶、药物转运蛋白、药物结合蛋白、药物基因多态性等)的参与下,药物因彼此之间交互作用而发生的药动学或(和)药效学的变化,临床表现为药效学增加和(或)不良反应加重,也可表现为药效减弱和(或)不良反应减轻。发生相互作用的两种或多种药物可以不同时共存于机体内,若一种药物对代谢酶或转运蛋白的抑制作用较持久,即使停用此种药物后,机体恢复该酶活性仍需要一定时间。如果在恢复期内使用此酶的底物,也可以产生DDI[5]。
丙型肝炎患者接受DAA治疗方案治疗时,即使存在合并症或潜在的DDI,只要进行合理的监测和处理,仍然能获得较高的持续病毒学应答(sustained virologic response,SVR)率,且不影响安全性。因此,本共识归纳总结中国目前已上市和即将上市的DAA治疗方案可能出现的DDI相关问题和解决方案,为广大临床医师诊疗决策提供参考意见。
药物经口服后在体内需经过吸收、分布、代谢和排泄四个过程。多种药物同时服用时,若二者具有相同或相似的代谢途径,势必会相互影响,而这些相互作用主要受两方面因素的影响。①药物代谢酶:Ⅰ相代谢酶细胞色素(cytochrome,CYP),Ⅱ相代谢酶UDP-葡萄糖苷酸基转移酶(UDP-glucuronosyltransferases,UGT)和谷胱甘肽S-转移酶(glutathione S-transferase,GST);②药物转运蛋白:有机阴离子转运多肽(organic anion transporter polypeptide,OATP)、P-糖蛋白(P-glycoprotein,P-gp)、有机阳离子转运体(organic cation transporter,OCT)和乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)等。
阿舒瑞韦(100 mg,每日2次)/达拉他韦(60 mg,每日1次)用于治疗基因1b型慢性丙型肝炎患者。阿舒瑞韦是第2代NS3/4A蛋白酶抑制剂,通过OATP转运进入肝脏并经过CYP450亚组CYP3A4介导氧化代谢,由于其与强效或中效CYP3A抑制剂合并使用时可能增加肝脏相关不良事件的可能性和严重程度,与强效或中效CYP3A诱导剂合并使用时可能会加快阿舒瑞韦代谢,导致其暴露量降低和疗效缺失,与强效OATP1B1抑制剂合用可能导致肝脏内浓度降低和疗效缺失。因此服用此药品应禁用克拉霉素等CYP3A抑制剂,卡马西平、利福平和地塞米松等CYP3A诱导剂以及环孢霉素和吉非贝齐等强效OATP1B1抑制剂。阿舒瑞韦也是中效CYP2D6抑制剂,禁止与依赖CYP2D6代谢的药物合并使用,如合用硫利达嗪时,其血浆浓度升高可能导致严重室性心律失常和猝死。
达拉他韦是一种NS5A抑制剂,常与其他类型DAA联合使用。在肝内经过CYP3A4代谢并经过转运体P-gp和OCT1转运。当达拉他韦与中效CYP3A诱导剂(如地塞米松、利福喷汀等)合用时需调整剂量至90 mg/d,与强效CYP3A抑制剂(如克拉霉素和酮康唑等)或抗HIV药物(如阿扎那韦和印地那韦等蛋白酶抑制剂)合用时需减量至30 mg/d,禁止与强效CYP3A诱导剂(如卡马西平等)合用。而OCT抑制剂和中/低效P-gp抑制剂对达拉他韦的影响较小。
奥比帕利(2片,每日1次)联合达塞布韦(250 mg,每日2次)用于治疗基因1b型慢性丙型肝炎患者。需随餐服用。奥比帕利是NS3/4A抑制剂帕立瑞韦(75 mg),NS5A抑制剂奥比他韦(12.5 mg)和CYP3A抑制剂利托那韦(50 mg)组成的固定复合制剂。帕立瑞韦和利托那韦主要在肝脏中进行代谢,均是CYP3A4底物,而奥比他韦主要经过酰胺水解代谢。体外实验证明三者均是P-gp转运体的抑制剂,但和地高辛合用时其药物浓度并无明显升高。此外,帕立瑞韦还是OATP1B1、BCRP底物和OATP1B1、OATP1B3、OATP2B1、BCRP、P-gp抑制剂,奥比他韦是CYP3A4、BCRP、P-gp抑制剂,利托那韦是CYP3A4强效抑制剂、BCRP和OATP2B1抑制剂。
达塞布韦主要由CYP2C8代谢,少量经过CYP3A4代谢,可抑制UGT 1A1和BCRP。在体外达塞布韦是P-gp的抑制剂,但与P-gp底物地高辛合用时并不能改变地高辛浓度。同时,达塞布韦也是P-gp和BCPR的底物,但抑制这两个转运体对达塞布韦药物浓度并无影响。
因此,中-强效CYP3A诱导剂和强效CYP2C8诱导剂会降低奥比帕利/达塞布韦作用效能而强效CYP2C8抑制剂可能会提高达塞布韦药物浓度,并存在QT间期延长的风险。
索磷布韦(400 mg)联用达拉他韦(60 mg)用于治疗基因1~6型慢性丙型肝炎患者。索磷布韦是一种NS5B抑制剂,其代谢不依赖于CYP450酶,而是经P-gp和BCRP转运,对药物转运体P-gp、BCRP、OATP1B1、OATP1B3和OCT1既无抑制作用也不具有诱导作用。因此肠道P-gp诱导剂(如利福平、利福布汀、卡马西平等)可能会降低索磷布韦的血浆药物浓度而降低疗效。可与达拉他韦联用治疗基因1~6型慢性丙型肝炎患者,与达拉他韦联用时也需考虑达拉他韦的药物相互作用。
达诺瑞韦(100 mg,每日2次)联合聚乙二醇干扰素α和利巴韦林用于治疗基因1型初治非肝硬化慢性丙型肝炎患者。达诺瑞韦经CYP3A亚型代谢。CYP3A抑制剂(如酮康唑)或诱导剂(如利福平、利福布汀、苯巴比妥、苯妥英、卡马西平)会改变其血药浓度。当利托那韦片与达诺瑞韦合用时,其他CYP3A抑制剂对达诺瑞韦血药浓度的增加作用则减弱。但是CYP3A诱导剂有可能降低达诺瑞韦和利托那韦片的血药浓度。达诺瑞韦也是OATP底物,若与OATP抑制剂(如环孢菌素,利福平)和底物(如瑞舒伐他汀)可能增加达诺瑞韦的血药浓度。
艾尔巴韦/格拉瑞韦是第2代NS3/4A抑制剂格拉瑞韦(100 mg)和第2代NS5A抑制剂艾尔巴韦(50 mg)组成的固定复合制剂,用于治疗基因1型和4型慢性丙型肝炎患者。二者均主要经过CPY3A代谢和粪便排泄,是CYP3A4和P-gp的底物以及小肠BCRP的抑制剂。体外实验中,艾尔巴韦能抑制P-gp,但并不能提高地高辛(P-gp底物)的药物浓度。格拉瑞韦还是OATP1B1/3的底物和CYP3A4的轻度抑制剂。
因此,艾尔巴韦/格佐普韦使用时应禁用OATP1B1/3抑制剂(如环孢霉素等)、强效CYP3A诱导剂(如卡马西平、利福平和依法韦仑等)。与华法林合用时需监测凝血指标。
索磷布韦/雷迪帕韦是NS5A抑制剂雷迪帕韦(90 mg)和NS5B抑制剂索磷布韦(400 mg)组成的固定复合制剂,用于治疗基因1、4、5、6型慢性丙型肝炎患者。雷迪帕韦的代谢机制尚不明确,但其代谢不依赖于CYP450酶,超过98%通过粪便以原型排出,其余少量通过肾脏排出。雷迪帕韦不是CYP450和UGT的抑制剂或诱导剂,是P-gp转运蛋白和BCRP的底物和抑制剂,与P-gp或BCRP诱导剂联用可降低雷迪帕韦的浓度。雷迪帕韦的吸收需要酸性pH的环境,其溶解度随着pH值的升高而降低,因此H2受体拮抗剂、质子泵抑制剂等抑制胃酸药物可降低其药物浓度,若需同服应至少间隔4 h。
索磷布韦/维帕他韦是NS5A抑制剂维帕他韦(100 mg)和NS5B抑制剂索磷布韦(400 mg)组成的固定复合制剂,为泛基因型DAA,可用于治疗基因1~6型慢性丙型肝炎患者。维帕他韦和索磷布韦均是转运体P-gp和BCRP的底物,体外实验证实维帕他韦还经过肝药酶CYP2B6、CYP2C8、CYP3A4代谢,故服用索磷布韦和维帕他韦时应避免使用肝药酶CYP2B6、CYP2C8和CYP3A4,以及转运体P-gp的诱导剂。同时,维帕他韦还是P-gp、BCRP、OATP1B1/3和OATP2B1的抑制剂,与这些转运体底物合用可能会引起药物浓度升高。
此外,维帕他韦的溶解度随氢离子浓度指数(pH)升高而降低,因此H2受体拮抗剂、质子泵抑制剂等抑制胃酸药物可降低其药物浓度,若必须使用,同服抗酸药需间隔4 h;同服H2受体阻滞剂需间隔12 h且每天剂量不超过40 mg;同服奥美拉唑时,需提前4h随餐服用索磷布韦和维帕他韦。与胺碘酮合用会发生严重心动过缓,因此严禁胺碘酮与索磷布韦/维帕他韦合用。
格卡瑞韦/哌仑他韦是NS3/4A抑制剂格卡瑞韦(100 mg)和NS5A抑制剂哌仑他韦(40 mg)组成的固定复合制剂,为泛基因型DAA,可用于治疗基因1~6型慢性丙型肝炎患者。需随餐服用。二者均90%以上经过胆汁-粪便排泄,格卡瑞韦经过CYP3A4代谢,与卡马西平、利福平等CYP3A诱导剂合用将降低格卡瑞韦和哌仑他韦的药物浓度,而与洛伐他汀、辛伐他汀和阿托伐他汀CYP3A抑制剂合用时可能会引起格卡瑞韦/哌仑他韦药物浓度过高。格卡瑞韦也是OATP1B1/3的底物,与环孢素等OATP1B1/3抑制剂合用时会增加格卡瑞韦/哌仑他韦药物浓度,因此,不建议环孢素用量>100 mg/d。
药物代谢所需的酶类和转运体见表1[6,7,8,9,10,11,12,13,14],临床常见DAA禁止合用药物见表2。
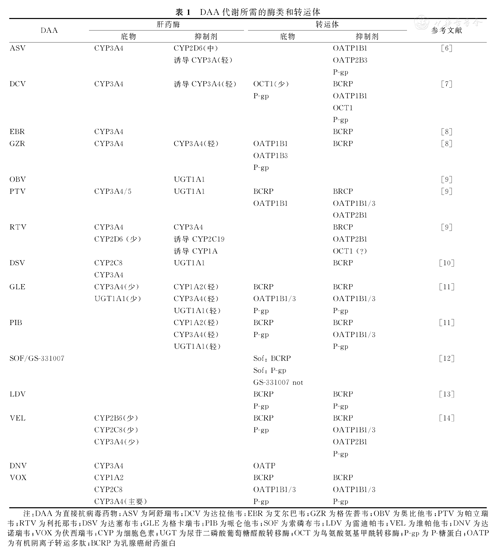
DAA代谢所需的酶类和转运体
DAA代谢所需的酶类和转运体
| DAA | 肝药酶 | 转运体 | 参考文献 | ||
|---|---|---|---|---|---|
| 底物 | 抑制剂 | 底物 | 抑制剂 | ||
| ASV | CYP3A4 | CYP2D6(中) | OATP1B1 | [6] | |
| 诱导CYP3A(轻) | OATP2B3 | ||||
| P-gp | |||||
| DCV | CYP3A4 | 诱导CYP3A4(轻) | OCT1(少) | BCRP | [7] |
| P-gp | OATP1B1 | ||||
| OCT1 | |||||
| P-gp | |||||
| EBR | CYP3A4 | BCRP | [8] | ||
| GZR | CYP3A4 | CYP3A4(轻) | OATP1B1 | BCRP | [8] |
| OATP1B3 | |||||
| P-gp | |||||
| OBV | UGT1A1 | [9] | |||
| PTV | CYP3A4/5 | UGT1A1 | BCRP | BRCP | [9] |
| OATP1B1 | OATP1B1/3 | ||||
| OATP2B1 | |||||
| RTV | CYP3A4 | CYP3A4 | BRCP | [9] | |
| CYP2D6 (少) | 诱导CYP2C19 | OATP2B1 | |||
| 诱导CYP1A | OCT1 (?) | ||||
| DSV | CYP2C8 | UGT1A1 | BCRP | [10] | |
| CYP3A4 | |||||
| GLE | CYP3A4(少) | CYP1A2(轻) | BCRP | BCRP | [11] |
| UGT1A1(少) | CYP3A4(轻) | OATP1B1/3 | OATP1B1/3 | ||
| UGT1A1(轻) | P-gp | P-gp | |||
| PIB | CYP1A2(轻) | BCRP | BCRP | [11] | |
| CYP3A4(轻) | P-gp | OATP1B1/3 | |||
| UGT1A1(轻) | P-gp | ||||
| SOF/GS-331007 | Sof: BCRP | [12] | |||
| Sof: P-gp | |||||
| GS-331007 not | |||||
| LDV | BCRP | BCRP | [13] | ||
| P-gp | P-gp | ||||
| VEL | CYP2B6(少) | BCRP | BCRP | [14] | |
| CYP2C8(少) | P-gp | OATP1B1/3 | |||
| CYP3A4(少) | OATP2B1 | ||||
| P-gp | |||||
| DNV | CYP3A4 | OATP | |||
| VOX | CYP1A2 | BCRP | BCRP | ||
| CYP2C8 | OATP1B1/3 | OATP1B1/3 | |||
| CYP3A4(主要) | P-gp | P-gp | |||
注:DAA为直接抗病毒药物;ASV为阿舒瑞韦;DCV为达拉他韦;EBR为艾尔巴韦;GZR为格佐普韦;OBV为奥比他韦;PTV为帕立瑞韦;RTV为利托那韦;DSV为达塞布韦;GLE为格卡瑞韦;PIB为哌仑他韦;SOF为索磷布韦;LDV为雷迪帕韦;VEL为维帕他韦;DNV为达诺瑞韦;VOX为伏西瑞韦;CYP为细胞色素;UGT为尿苷二磷酸葡萄糖醛酸转移酶;OCT为鸟氨酸氨基甲酰转移酶;P-gp为P-糖蛋白;OATP为有机阴离子转运多肽;BCRP为乳腺癌耐药蛋白

DAA常见禁止合用药物
DAA常见禁止合用药物
| DAA | CYP3A底物 | CYP3A诱导剂 | CYP3A抑制剂 | CYP2D6底物 | OATP1B1底物 | OATP1B1抑制剂 | P-gp诱导剂 |
|---|---|---|---|---|---|---|---|
| 阿舒瑞韦 | 苯妥英钠 | 氟康唑 | 硫利达嗪 | 利福平 | |||
| 卡马西平 | 克拉霉素 | 环孢霉素 | |||||
| 利福平 | 地尔硫卓 | 吉非贝齐 | |||||
| 依法韦仑 | 维拉帕米 | ||||||
| 阿扎那韦 | |||||||
| 达拉他韦 | 苯妥英钠 | ||||||
| 卡马西平 | |||||||
| 利福平 | |||||||
| 依法韦仑 | |||||||
| 奥比帕利 | 阿夫唑嗪 | 米托坦 | 洛伐他汀 | ||||
| 胺碘酮 | 卡马西平 | 辛伐他汀 | |||||
| 决奈达隆 | 苯巴比妥 | 阿托伐他汀 | |||||
| 奎尼丁 | 利福平 | 克拉霉素 | |||||
| 咪达唑仑 | 伊曲康唑 | ||||||
| 阿斯咪唑 | |||||||
| 索磷布韦 | 利福平 | ||||||
| 利福布汀 | |||||||
| 卡马西平 | |||||||
| 莫达非尼 | |||||||
| 达诺瑞韦 | 瑞舒伐他汀 | ||||||
| 环孢霉素 | |||||||
| 艾尔巴韦/格佐普韦 | 卡马西平 | 环孢霉素 | |||||
| 利福平 | |||||||
| 索磷布韦/雷迪帕韦 | 利福平 | ||||||
| 利福布汀 | |||||||
| 卡马西平 | |||||||
| 苯巴比妥 | |||||||
| 格卡瑞韦/哌仑他韦 | 卡马西平 | 洛伐他汀 | |||||
| 利福平 | 辛伐他汀 | ||||||
| 阿托伐他汀 |
注:本表不是所有禁用药物完整列表。DAA为直接抗病毒药物;CYP为细胞色素;OATP为有机阴离子转运多肽;P-gp为P-糖蛋白
有研究报道,慢性丙型肝炎肝炎患者常见合并疾病为糖尿病、高血压、冠状动脉性心脏病、胃十二指肠炎和(或)溃疡、CHB、高脂血症、心律失常和精神疾病[15]。合并常用药物主要为降糖药物、降压药物、降脂药物、胃肠用药、精神疾病用药、核苷(酸)类似物、心律失常药物和免疫抑制剂。艾滋病患者是发生HCV感染的高危人群[16],因此,DAA和抗HIV药物的DDI管理也尤为重要。潜在DDI内容见王琴等[17]的报道。
DAA的DDI管理是指,对于已经伴有其他疾病正在服用其他疾病治疗药物的人群,或者必须尽快使用其他疾病治疗药物的人群而言。
对于未使用其他疾病治疗药物的人群,不存在DDI。
如果已经在应用治疗其他疾病的药物,且该药物与将要应用的DAA之间有明确的DDI,可在专科医师指导下,考虑在应用DAA期间暂停与之有相互作用的药物,以避免发生DDI。
对于未使用其他疾病治疗药物的人群,需要提醒患者。在使用DAA抗HCV期间,如果需要服用其他药物,应该咨询肝病科医师、相关科室医师或临床药师。了解是否有潜在的DDI。
绝大多数中草药、中成药,尚缺乏与DAA的DDI研究数据。除非极其特殊情况,请在服用DAA前开始停用,在完成DAA治疗14 d后可以考虑恢复。
营养品和保健品也可能发生和DAA的相互作用,影响DAA的代谢。均应该在服用DAA前开始停用。
DAA之间也可能存在相互作用。除了同一个制药企业的同一个复方组成DAA以外,其他跨企业DAA之间的相互作用大多还没有充分研究,不能随便组合。如果必须组合,请充分了解每一个DAA的代谢途径,并在用药期间监测心脏、血液、肝脏、肾脏等相关的症状、体征(特别是生命体征)、心电图和实验室检查。
慢性丙型肝炎DDA的药物相互作用管理流程见图1。
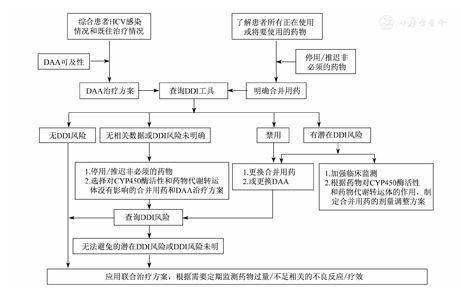

注:HCV为丙型肝炎病毒;DAA为直接抗病毒药物;DDI为药物相互作用
慢性丙型肝炎患者在使用DAA前,临床医师应详细询问患者是否合并其他疾病及是否使用其他疾病药物,以及可能存在的肝外表现。除此之外,还应考虑患者丙型肝炎基因分型、肝功能状态(是否有肝硬化、是否失代偿)、肾功能状态,是否应用过α干扰素联合利巴韦林治疗及其疗效、是否应用过DAA及其疗效和不良反应。根据临床经验和临床情况,结合《丙型肝炎防治指南(2015年更新版)》[3]、欧洲肝病研究协会《丙型肝炎治疗指南(2018年更新版)》,以及当地的药物可及性、初步确定可以应用的治疗方案和DAA药物。
既往有HBV感染的人群,均可能在DAA治疗期间或治疗后出现HBV再激活,因此,在使用DAA前,需筛查HBsAg。若HBsAg呈阳性,使用DAA前需检测HBV DNA,如果存在HBV复制,需根据CHB相关指南处理并监测HBV DNA载量和ALT变化情况;如果服药前未检测出HBV DNA,在使用DAA过程中也应监测HBV DNA载量和ALT的变化,按照相关指南进行抗HBV治疗。
仔细询问患者的合并疾病史、饮酒史和过敏史,获得患者所有应用药物(包括非处方药物、中草药、保健品、补品等)的信息;评估这些药物应用的必要性,停用非必须应用的药物。
中文可以采用丙型肝炎药物相互作用APP(APP store或应用商店搜索HCV DDI免费下载),或者英文版的www.hep-druginteractions.org,确定患者合并用药与DAA方案间可能发生的DDI风险。
如果无DDI风险,直接使用该DAA方案。
如果存在潜在的DDI风险,请参照丙型肝炎药物相互作用APP,或者英文版的www.hep-druginteractions.org,并请相关专业会诊。①遵照相关疾病的诊疗指南、停用合并用药或换用同类其他药物(选择对CYP450酶活性和药物代谢转运体没有影响的合并用药);②或者换用其他DAA方案,并再次应用查询工具,确定无DDI风险;③或者根据药物对CYP450酶活性和药物代谢转运体的作用,制定合并用药的剂量调整方案,并遵照相关疾病的诊疗指南和专科意见、建立监测方案;④或者遵照相关疾病的诊疗指南和专科意见、建立密切监测方案,关注心脏、血液、肝脏、肾脏等相关的症状和体征(特别是生命体征),同时完善心电图和实验室检查等。
如果存在禁用情况,请相关专业会诊并遵照相关疾病的诊疗指南、停用合并用药或更换同类其他药物治疗,或者换用其他DAA方案,并再次应用查询工具,确定无DDI风险。
如果DDI风险未明或查询工具中无相关数据,请相关专业会诊并遵照相关疾病的诊疗指南、停用或推迟合并用药;如因病情所需必须合并应用,可选择对CYP450酶活性和药物代谢转运体没有影响的合并用药和DAA方案,并遵照相关疾病的诊疗指南和专科意见、建立监测方案。
应用DAA期间需监测合并用药的疗效和安全性及潜在的药物相互作用。如果发生药物相互作用,应该按照国家药品监督管理局药物不良反应监测的相关要求报告。
对于可以监测血药浓度的药物(如地高辛、环孢素等),可定期监测药物浓度。
DDI的发生与药物转运体或者CYP450酶活性改变相关,主要表现为DAA或者合并应用药物的血药(或者活性代谢产物)浓度改变、出现合并症治疗药物和(或)DAA的疗效降低/过量相关的不良反应,并影响疗效。因此,为降低DDI发生,在应用有"潜在相互作用"或者"潜在作用不明"的治疗方案时,应按照所用药物对药物转运体或者CYP450酶活性的作用特点、遵照相关疾病的诊疗指南和专科意见、制定相应的监测计划,以便及时发现药物相关不良反应、并准确评估药物疗效。
如果DAA治疗完成,请在DAA药物7个半衰期后使用具有相互作用的其他药物。
如果DAA治疗期间发生了DDI,应该追踪随访至该DDI完全缓解,或者转诊至相关的临床科室。
总体来讲,全口服DAA所致药物间相互作用,发生率少且程度轻微。随着DDA逐步被广泛应用,在老年、存在心脏基础病变、晚期肝病、肾损伤、合并HIV感染、肝移植等HCV感染人群,常合并多种用药,DDI发生率增加,甚至引起严重临床后果,应及时识别和处理[18,19,20,21]。这里仅仅列出可能危及生命和器官的DDI相关严重不良反应。其他的DDI不良反应请按照相应的规范进行处理。
2015年3月24日美国食品药品监督管理局发布警告,抗心律失常药物胺碘酮与雷迪帕韦/索磷布韦合并使用,或与索磷布韦加另一种DAA(达拉他韦或西美瑞韦)合用时,可能会出现严重的心动过缓,甚至死亡[22]。相应机制尚未阐明,可能与P-gp活性受到抑制、胺碘酮从血浆蛋白结合中释放增多、索磷布韦或其他DAA对心肌细胞或离子通道的直接作用、窦房结功能障碍等多种因素相关[2,23,24]。目前已上市或即将上市的DAA与胺碘酮都存在DDI的风险,除索磷布韦以及其固定组合(如雷迪帕韦/索磷布韦等)药物说明书已加注警告标示外,奥比帕利+达塞布韦、达拉他韦则分别禁止或不推荐和胺碘酮合用。
处理:避免上述药物间合用。若胺碘酮不能停药或无其他药物可替换,可选用DDI相对风险较小的格卡瑞韦/哌仑他韦、格拉瑞韦/艾尔巴韦,治疗中监测胺碘酮血药浓度或心电图变化;当必需使用含索磷布韦的DAA抗病毒方案时,建议合并用药后48 h内住院持续监测心率,随后至少2周应每天到门诊或自行监测心率[22]。
胺碘酮清除半衰期为58 d,建议停药3个月后方可使用包含索磷布韦的DAA或奥比他韦(ombitasvir,OBV)/帕利瑞韦(paritaprevir,PTV)/利托那韦ritonavir,r)+达塞布韦(dasabuvir,DSV)抗病毒治疗,并按上述方式进行心率监测。
患者服药后若出现下列症状:头晕目眩、倦怠、虚弱、极度疲劳、呼吸急促、胸痛、晕厥、意识模糊或记忆障碍时,应警惕心动过缓或心脏停博,需立即就医进行心电图等检查。确诊后停用DDA,并给予心电监护。心动过缓可应用阿托品、山莨菪碱、肾上腺素等药物,必要时安置心脏起搏器;心脏停博需立即启动心肺复苏[25]。视情况启动由肝病、心血管、药学、ICU等方面专家组成的多学科协作诊治(multidisciplinary diagonosis and treatment pattern,MDT)。
钙离子通道阻滞剂(calcium channel blockers,CCB)多数经CYP3A4代谢,部分经P-gp转运,抑制CYP3A4、P-gp活性可导致CCB药物浓度升高。目前已上市或即将上市的DAA中,仅索磷布韦单药与CCB间尚未发现DDI。奥比帕利+达塞布韦与尼索地平合并使用,曾报道1例肝硬化患者出现了急性低血压和继发晕厥,考虑利托那韦抑制了CYP3A4[26]。此外,达拉他韦、西美瑞韦因抑制CYP3A4,与氨氯地平、硝苯地平、地尔硫卓等CCB存在潜在的DDI[27]。
处理:DAA与CCB存在潜在DDI时,通过调整CCB药物剂量、或调换为其他降血压药物,多数不影响DAA治疗。奥比帕利+达塞布韦应避免合用非洛地平、尼索地平[28]。
合并使用中,应监测患者是否存在心率增快、下肢水肿或低血压的症状或体征。发生低血压后,建议立即停用CCB等药物,给予心电监护和血压监测,视情况给予补液、多巴胺等血管活性药物。血压稳定后首先换用其他降压药物,其次可在严密监测下恢复使用减少剂量的CCB。
新一代DAA与免疫抑制剂间DDI较少,严重不良反应罕见。蛋白酶抑制剂、利托那韦等与免疫抑制剂均经CYP3A4代谢,尽可能避免合并使用;如使用应严密监测药物浓度、调整剂量并观察可能的不良反应。例如奥比帕利联合达塞布韦可上调他克莫司、环孢霉素血药浓度,合并使用时他克莫司起始剂量应选择每7天0.5 mg,环孢霉素需减量至日常用剂量的1/5[28]。因环孢霉素可抑制OATP1B1/3而升高格拉瑞韦血药浓度,增加ALT升高风险,故格拉瑞韦/艾尔巴韦和环孢霉素禁止联用[8]。由于DDI相对少见,索磷布韦/雷迪帕韦、索磷布韦/维帕他韦,或索磷布韦联合达拉他韦等方案,可以和硫唑嘌呤、环孢霉素、他克莫司等常用免疫抑制剂一起使用[2]。
DDA与抗反转录病毒药物、降脂药物间也存在较多、复杂的DDI。DDI的管理是治疗的关键,必要时可请HIV或心血管专家共同制定治疗方案,治疗过程中需持续关注可能的不良反应。
总之,DDI是临床上使用DAA治疗时重要的常见问题。当怀疑DDI导致不良反应时,适当调整合并用药剂量或者选择其他药物,视情况监测心电图、血压、肝功能以及血药浓度,适时启动MDT,则可避免或减轻严重不良反应。
编写成员(排名不分先后,按姓氏拼音首字母排序):段钟平、康家琦、饶慧瑛、魏来、王贵强、王琴、赵鸿、郑素军
工作组专家(排名不分先后,按姓氏拼音首字母排序):李太生、刘梅林、梁雁、王向群、杨希忠、左立、张俊清、张澍田
感谢以下各位教授审阅提出修改建议(排名不分先后,按姓氏拼音首字母排序):安纪红、陈红、陈良、陈煜、陈智、陈佰义、陈红松、陈新月、陈志海、邓存良、窦晓光、范建高、傅青春、甘建和、高海女、郭武华、韩涛、韩英、何艳、侯金林、胡鹏、黄燕、贾继东、贾战生、江建宁、江应安、李杰、李军、李武、李成忠、李家斌、李兰娟、李树臣、李太生、李玉芳、蔺淑梅、罗新华、李兴旺、李用国、李智伟、林锋、林炳亮、林明华、刘景丰、刘晓清、刘正印、陆伦根、路青华、吕晓菊、马雄、毛青、茅益民、孟庆华、宓余强、南月敏、倪武、宁琴、聂玉强、牛俊奇、彭劼、祁伟、任红、任万华、尚佳、盛吉芳、石荔、孙剑、唐红、唐小平、王峰、王磊、王煜、王福生、王贵强、王明贵、王者令、韦嘉、邬小萍、谢青、谢雯、邢卉春、辛绍杰、肖永红、徐小元、熊勇、阎明、尤红、杨东亮、杨积明、于岩岩、俞云松、余祖江、曾玫、张权、张岭漪、张文宏、张文元、张欣欣、张跃新、张专才、赵敏、赵彩彦、赵景民、赵龙凤、赵守松、赵英仁、赵中夫、郑波、左维泽

























