
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
营养治疗是糖尿病综合治疗中的重要组成之一,实施有营养治疗的糖尿病管理可以有效优化血糖控制。通过营养治疗可以使成人1型糖尿病和2型糖尿病患者的糖化血红蛋白(HbA1c)分别下降1.0%~1.9%[1,2]和0.3%~2.0%[3,4],对于儿童糖尿病也有助于血糖达标[5,6]。儿童青少年糖尿病的营养治疗既要保证不同生长阶段的生理需要,同时也要考虑到儿童心理因素、食欲和口味的需求。自2000年国际儿童青少年糖尿病协会(International Society for Pediatric and Adolescent Diabetes,ISPAD)首次发布了儿童青少年糖尿病临床实践指南,该指南涵盖了营养管理的内容以指导糖尿病儿童的营养治疗,强调了儿童青少年糖尿病营养治疗的重要性。目前我国各地区在儿童糖尿病的营养管理观念和方法上不尽相同,尚无针对儿童青少年糖尿病的营养治疗指南或共识,亟需能够指导临床实践的、科学的、可操作性强的营养治疗共识。本文以ISPAD、美国糖尿病学会(ADA)及中华医学会糖尿病学分会(CDS)的相关指南及共识为基础,会同国内相关领域专家学者,并参考国内外最新研究成果及循证医学证据,形成2018年儿童青少年糖尿病营养治疗专家共识,旨在指导临床医师对糖尿病儿童进行规范性营养治疗,以协助其提高血糖管理水平及生活质量,推动儿童青少年糖尿病营养的研究,为将来进一步制定国内儿童青少年糖尿病的医学营养治疗指南奠定基础。
1.提供适合糖尿病儿童的平衡膳食,维持或达到理想体重,保证儿童正常生长发育。
2.使糖尿病儿童的血糖及其他代谢指标达到或接近正常水平,减少各种急、慢性并发症的发生。
3.构建良好的膳食模式,配合合理的学习和运动习惯,提高生活质量。
糖尿病儿童明确诊断后,糖尿病专业医师和营养师应及早与患儿及其父母建立联系,采集患儿的营养史,包括发病以前的家庭饮食习惯、食欲情况、能量摄取和碳水化合物分配比例、进食时间表等,然后根据饮食生活习惯和药物治疗方案制定详细的饮食及营养教育计划,并动态调整。营养教育的对象应包括糖尿病儿童本身、父母及其他对糖尿病儿童提供照顾的人员,内容需要考虑到受教育对象的年龄、接受程度和文化习俗,以帮助受教育者积极地参与营养知识学习。
糖尿病儿童能量摄入应遵循"总量控制"原则,全日摄入能量可参照计算公式拟订:总能量(kcal)=1 000+年龄×系数(公式系数:70~100)(1 kcal=4.18 kJ)。公式中系数可结合年龄选择:<3岁按100,3~6岁按90,7~10岁按80,大于10岁按70,再根据糖尿病儿童的营养情况、体力活动量及应激状况等因素调整为个体化的能量推荐值(不同年龄段推荐每日营养素摄入量见表1)。0~12个月婴儿能量摄入推荐80~90 kcal·kg-1·d-1。糖尿病儿童在诊断时需要补充发病前分解代谢的体重丢失,若食欲好可以摄入较高能量,但当体重恢复后应该减少摄入。对于超重和肥胖的2型糖尿病儿童,推荐在维持健康饮食结构的前提下减少能量摄入以帮助减重(但不应低于800 kcal/d)。当实际能量摄入与推荐能量摄入之间的数值存在较大差距时,应采取逐步调整的方式,使实际摄入量接近推荐摄入量。糖尿病儿童的体重变化应作为判断阶段性能量出入是否平衡的实用参考指标。控制总能量的同时应注意保持平衡膳食,每日总能量摄入宜按如下分配[7,8,9]:碳水化合物占50%~55%,脂肪占25%~35%,蛋白占15%~20%。
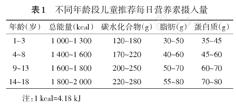
不同年龄段儿童推荐每日营养素摄入量
不同年龄段儿童推荐每日营养素摄入量
| 年龄(岁) | 总能量(kcal) | 碳水化合物(g) | 脂肪(g) | 蛋白质(g) |
|---|---|---|---|---|
| 1~3 | 1 000~1 300 | 120~180 | 30~50 | 35~45 |
| 4~8 | 1 400~1 600 | 170~220 | 40~60 | 45~60 |
| 9~13 | 1 600~1 800 | 200~250 | 50~70 | 60~70 |
| 14~18 | 1 800~2 000 | 220~280 | 55~80 | 70~80 |
注:1 kcal=4.18 kJ
计算每日总能量(kcal)=1 000+年龄×系数(公式系数:70~100)(1 kcal=4.18 kJ),根据糖尿病儿童的具体情况再进行个体化调整
控制总能量的同时应平衡膳食,每日总能量摄入宜按如下分配:碳水化合物占50%~55%,脂肪占25%~35%,蛋白占15%~20%
蔗糖摄入量最多为总能量的10%,可以选择添加非营养性甜味剂的低糖或无糖食品以改善甜度和口感
推荐每日膳食纤维摄入量为14 g/1 000 kcal,推荐富含可溶性纤维的食物
推荐单不饱和脂肪酸取代部分饱和脂肪酸供能,宜占总能量的10%~20%,多不饱和脂肪酸的摄入量不超过摄入总能量的10%
限制饱和脂肪酸及反式脂肪酸的摄入,摄入量不应超过供能比的10%
推荐每周1~2次80~120 g鱼的摄入以提供n-3多不饱和脂肪酸
优质蛋白供给应占总蛋白的1/3~1/2。当糖尿病儿童出现持续微量白蛋白尿时,在保证正常生长发育的前提下蛋白质摄入可低于推荐量
碳水化合物的种类和数量是影响血糖的决定性因素,需要严格控制,但不应低于每日必需摄入量,否则可能严重影响糖尿病儿童的生长发育。碳水化合物按其基本结构可分为单糖(主要为葡萄糖和果糖)、双糖(如蔗糖、麦芽糖、乳糖)和多糖(如淀粉、糖原、膳食纤维等)。多糖相对单糖及双糖消化时间长,血糖上升缓慢,应作为碳水化合物的主要组成部分,食物来源有谷类、薯类、根茎类蔬菜和豆类等。蔗糖吸收迅速,多用于预防和治疗低血糖,但摄入过多则会导致高血糖并转化为脂肪储存,因此摄入量不超过总能量的10%[8]。膳食纤维可以延缓碳水化合物的消化和吸收,改善糖脂类代谢,并且高膳食纤维食物可以增加饱腹感,因此鼓励摄入各种富含纤维的食物,特别是富含可溶性纤维的蔬菜、水果、豆类、薯类、全谷类食物。推荐糖尿病儿童的膳食纤维摄入量应达到并超过健康儿童的推荐摄入量,具体推荐量为14 g/1 000 kcal(≥1岁)[7],每日最低摄入量为(年龄+5)g[10]。食物加工会造成纤维流失,因此推荐非精制的高纤维食物。
摄入脂肪的种类及数量对糖尿病儿童的脂代谢情况影响显著。糖尿病脂肪摄入的首要问题是限制饱和脂肪酸和胆固醇的摄入量,以控制低密度脂蛋白胆固醇(LDL-C)和总胆固醇的水平。单不饱和脂肪酸是优质的膳食脂肪来源,可以有效改善糖脂代谢。n-3多不饱和脂肪酸通过减少极低密度脂蛋白胆固醇和LDL-C的分泌而降低甘油三酯水平,并且能促进甘油三酯的清除和胆固醇代谢。此外,反式脂肪酸多是植物油精炼过程中部分氢化产生的,会显著增加LDL-C和降低高密度脂蛋白胆固醇的水平[11]。因此推荐的膳食脂肪组成:单不饱和脂肪酸在总能量摄入的占比宜达到10%~20%[12],多不饱和脂肪酸的摄入量不超过10%[13],推荐糖尿病儿童每周1~2次80~120 g鱼的摄入(油炸鱼除外),以提供n-3多不饱和脂肪酸[14,15]。饱和脂肪酸和反式脂肪酸的摄入量应少于总能量的10%,尽量减少反式脂肪酸的摄入[16],每日胆固醇摄入量不超过300 mg[17]。若出现高脂血症,则需限制饱和脂肪酸摄入占全天总能量的7%以下,胆固醇摄入量小于200 mg/d,同时增加n-3多不饱和脂肪酸和膳食纤维的摄入[18]。植物固醇(植物油类、豆类、坚果类)可抑制肠道胆固醇的吸收,从而降低血浆总胆固醇及LDL-C水平,因此推荐5岁以上血脂异常的糖尿病儿童食用[19,20]。
蛋白质是儿童期生长发育必不可少的营养成分,每千克体重摄入量随年龄增长逐渐下降。对于1型糖尿病儿童蛋白质含量分配不应超过总能量的25%。建议优质蛋白供给占总蛋白的1/3~1/2,包括鱼肉、瘦肉和奶制品在内的动物蛋白和植物蛋白如大豆、豆荚和扁豆等[21]。当糖尿病儿童出现持续性微量白蛋白尿时可低于推荐蛋白摄入量,但必须保证正常生长发育,推荐蛋白摄入量0.8 g·kg-1·d-1。当肾小球滤过率<60 ml·min-1·(1.73 m2)-1时,则可实施低蛋白饮食治疗,限制蛋白摄入0.6 g·kg-1·d-1[22]。若由于低蛋白饮食而出现营养不良时,可考虑补充复方α酮酸制剂。复方α酮酸制剂配合低蛋白饮食治疗主要有改善蛋白质代谢紊乱、减轻氮质血症的作用,成人应用剂量为0.12 g·kg-1·d-1,尚无儿童明确应用剂量[23,24]。
除三大营养素外,维生素、矿物质也是食物的重要组成成分。糖尿病儿童每日食盐推荐量:1~3岁:2.5 g/d,4~8岁:3 g/d;≥9岁:3.8 g/d[7],摄入高限为6 g/d。
维生素A和维生素D是人体重要的脂溶性维生素,目前认为可以通过抗氧化、免疫调节及刺激胰岛素基因表达等作用降低糖尿病的发病风险[25,26,27,28,29]。但补充维生素A或维生素D预防糖尿病的结论仅基于临床观察性研究或基于维生素缺乏人群的研究,尚无足够证据确定补充剂量和时间,因此除非营养评价显示明显缺乏某种维生素,否则并不主张额外补充,应从均衡膳食中获取每日必须的维生素和矿物质。
市售的无糖食品指的是将食物中的蔗糖以甜味剂替代,而甜味剂分为营养性甜味剂(可产生能量)及非营养性甜味剂(无能量)两大类。营养性甜味剂主要有山梨醇(能量3 kcal/g)、甘露醇(能量2 kcal/g)、木糖醇(能量1 kcal/g)。非营养性甜味剂有甜菊糖、糖精、阿斯巴甜、甜蜜素等,甜菊糖是一种可替代蔗糖的非营养性天然甜味剂,可以给糖尿病儿童在控制总摄入能量方面提供更多灵活选择,但每日摄入量不应超过4 mg/kg[30]。因此糖尿病儿童可以选择添加甜味剂的低糖或无糖食品以改善甜度和口感,但需要注意辨别甜味剂的种类和含量。
食物交换份法简单、易操作,应用广泛
碳水化合物计数法灵活性高、依从性好
进阶碳水化合物计数法有助于预测基础-餐时胰岛素治疗和胰岛素泵治疗的餐后血糖值,并调整胰岛素剂量
推荐应用数量化模型、手机软件、营养标签等方式协助计算食物碳水化合物的含量
进行富含碳水化合物的食物选择时,参考血糖生成指数(GI)和血糖负荷(GL)可能更有助于血糖控制
食物交换份法是我国目前应用比较广泛的糖尿病饮食管理方法,该法是指将食物按照来源、性质分成四大类(八小类),同类食物所含的碳水化合物、蛋白质、脂肪相近,每个食物交换份的能量约为90 kcal,因此可以通过同类食物互换丰富食物种类。四大类食物的划分及营养成分含量见表2,使用食物交换份法的一般步骤见附录1。
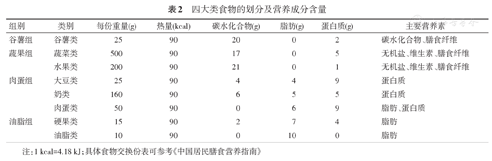
四大类食物的划分及营养成分含量
四大类食物的划分及营养成分含量
| 组别 | 类别 | 每份重量(g) | 热量(kcal) | 碳水化合物(g) | 脂肪(g) | 蛋白质(g) | 主要营养素 |
|---|---|---|---|---|---|---|---|
| 谷薯组 | 谷薯类 | 25 | 90 | 20 | 0 | 2 | 碳水化合物、膳食纤维 |
| 蔬果组 | 蔬菜类 | 500 | 90 | 17 | 0 | 5 | 无机盐、维生素、膳食纤维 |
| 水果类 | 200 | 90 | 21 | 0 | 1 | 无机盐、维生素、膳食纤维 | |
| 肉蛋组 | 大豆类 | 25 | 90 | 4 | 4 | 9 | 蛋白质 |
| 奶类 | 160 | 90 | 6 | 5 | 5 | 蛋白质 | |
| 肉蛋类 | 50 | 90 | 0 | 6 | 9 | 脂肪、蛋白质 | |
| 油脂组 | 硬果类 | 15 | 90 | 2 | 7 | 4 | 脂肪 |
| 油脂类 | 10 | 90 | 0 | 10 | 0 | 脂肪 |
注:1 kcal=4.18 kJ;具体食物交换份表可参考《中国居民膳食营养指南》
碳水化合物的含量、种类和分配是影响餐后血糖的决定性因素之一[31],由此衍生出糖尿病营养治疗的碳水化合物计数法。该方法较食物交换份法步骤简单,只需要管理好含有碳水化合物的食物,化繁为简,尤其利于餐后血糖的稳定[32]。碳水化合物计数法广泛应用于使用基础-餐时胰岛素治疗和胰岛素泵治疗的患者,运用该方法将食物摄入量与血糖水平、胰岛素剂量建立关联,有助于预测餐后血糖值,并调整胰岛素剂量,从而有助于改善糖尿病患者的HbA1c、增加饮食灵活性、减少血糖波动(特别是低血糖发生率)、减少胰岛素用量、减低体质指数(BMI)和腰围[33]。碳水化合物计数法的具体计算及应用方法见附录2。
碳水化合物计数基本法相对简单易行,但实践中也发现一些缺陷。如只关注碳水化合物,忽略了蛋白质和脂肪的含量对血糖水平的影响,甚至为控制血糖而选择不含碳水化合物的食物,导致摄入脂肪、能量过多,引起体重增加[34,35]。有研究发现35 g脂肪或40 g蛋白质对餐后3 h内的血糖的影响等同于20 g碳水化合物的作用[36]。然而目前对于高脂、高蛋白饮食需要追加调整的胰岛素剂量尚未达成共识。因此,饮食灵活不意味着完全的饮食自由,仍需坚持严格控制总能量摄入、基本饮食要素的构成等糖尿病饮食原则。
食物GI是衡量食物引起餐后血糖反应的一项有效指标,它是指含50 g碳水化合物的食物与相当量的葡萄糖在餐后2 h的血糖反应水平百分比值,通常把葡萄糖的GI定为100[37]。GI反映了食物与葡萄糖相比升高血糖的速度,食物GI>70为高GI食物,GI<55为低GI食物。低GI饮食可以改善糖尿病患者的餐后高血糖[38]及HbA1c[6,39]。参考GI选择食物可进一步优化血糖控制,常见食物的GI值分组见表3。

常见食物的GI值分组(葡萄糖的GI为100)
常见食物的GI值分组(葡萄糖的GI为100)
| GI值分组 | 常见食物 |
|---|---|
| GI<30 | 菠菜、圆白菜、菜花、茄子、苦瓜、黄瓜、芦笋、海带、白萝卜、四季豆、番茄、洋葱、柳橙、木瓜、草莓 |
| 30≤GI<40 | 鲜奶、鸡蛋、豌豆、豆腐、樱桃、苹果、梨、奇异果 |
| 40≤GI<55 | 全麦面包、瘦猪肉、牛肉、鸡肉、羊肉、香肠、火腿、虾、牡蛎、桃、芒果、哈密瓜 |
| 55≤GI≤70 | 糙米饭、荞麦面、玉米、燕麦、芒果、香蕉、葡萄、菠萝、南瓜、芋头 |
| GI>70 | 白米、馒头、吐司、土豆、红薯、山药、红萝卜、肥肠、猪肚、牛肚、西瓜、荔枝 |
注:GI:血糖生成指数,指含50 g碳水化合物的食物与相当量的葡萄糖在餐后2 h的血糖反应水平百分比值
但GI仅反映碳水化合物的"质",并未反映出实际摄入碳水化合物的"量"。因此估计食物的种类和摄入量对餐后血糖的影响需要参考食物的GL。GL=GI×碳水化合物的重量(g)/100,GL>20为高GL食物,GL在10~20之间为中GL食物,GL<10为低GL食物,GL值越高提示使用相应重量的食物升高血糖越明显。虽然已有临床证据显示低GI和(或)低GL饮食治疗的糖尿病患者的餐后血糖、HbA1c、血脂、BMI均明显优于仅用传统的营养治疗方法管理饮食的患者[40,41,42,43],但由于GI还受到食物的物理状况和加工方式等因素的影响,尚无界定食物GI值的国际标准方法,以及食物口感、饮食习惯等原因,导致将低GI/GL膳食推广并实践于糖尿病儿童中的情况并不理想[44]。影响餐后血糖最重要的因素还是碳水化合物摄入量,因此必须在严格控制碳水化合物摄入的基础上应用GI/GL指导食物的选择。
当糖尿病儿童开始按照制定的营养方案进行治疗后,应当每天记录血糖、各餐的食物种类及数量、进餐及加餐的时间,同时要记录与之匹配的胰岛素的种类、剂量、用药时间,以及运动的时间、强度等其他影响血糖水平的因素,用以调整营养治疗并评价糖尿病儿童的依从性。
在营养治疗后的一个月,最初拟定的饮食计划应该被重新评价及调整。随后每3个月审核调整一次饮食营养治疗的方案,当糖尿病儿童的营养治疗步入正轨之后应根据需要继续规律评价。在建立合理的个体化营养方案后仍需每年至少一次营养评估及调整[45]。评价营养治疗效果的内容除了糖脂代谢指标外,还需要重点评价糖尿病儿童的身高、体重、BMI及腰围,绘制曲线图监测生长情况。若评价为营养过剩,则需以降低能量摄入、增加热量消耗为原则,逐步调整营养方案使体重下降。体重减轻目标为每年大于5%[46],或以体重不变而身高沿着正常曲线持续增长为达标。对于体重偏低,存在营养不良的糖尿病儿童,则应增加能量及蛋白质的摄入,促进正氮平衡,纠正营养不良。当药物治疗、生活方式、生长发育阶段发生改变时,营养治疗方案也必须随之快速调整,以防过度限制造成的医源性生长发育障碍。
此外,还要警惕饮食习惯改变对糖尿病儿童心理健康造成的影响,故必要时建议联合心理医师给予心理沟通和解释疏导。
调节肠道菌群预防和控制糖尿病可能是未来营养治疗发展的前景之一。近年来的大量研究发现,肠道菌群参与了糖尿病的自身免疫反应并介导了胰岛素抵抗的发生[47,48],因此能否通过修饰调节肠道菌群预防和治疗糖尿病成为研究的热点。饮食可以影响肠道菌群的构成和功能[49],也可通过微生态制剂、粪菌移植等方式调节和改变肠道菌群。目前已有多项关于微生态制剂通过调节肠道菌群影响2型糖尿病的血糖控制的研究,但尚未达成一致性结论[50,51,52,53]。在儿童糖尿病中缺乏此类研究,因此现阶段不建议在无确切结论的情况下对糖尿病儿童长期应用肠道微生态制剂。
糖尿病儿童青少年在长期的治疗中有着特殊的需求并随着年龄而不断变化,故营养治疗方案应有别于成人糖尿病的营养治疗指南及经验。儿童青少年糖尿病营养治疗首先要保证糖尿病儿童充足和恰当的能量摄入和营养成分,从而获得良好的生长、发育和健康。营养治疗应在营养师的指导下对糖尿病儿童进行营养评估,制定相应的个体化营养治疗方案并监测和调整。通过调整能量摄入、改善营养素结构以满足生长发育需要并帮助糖尿病儿童的血糖控制达标,进而延缓糖尿病急性和慢性并发症的发生发展。建立健康积极的饮食生活习惯,制定适应儿童期生长发育不同阶段的个体化饮食治疗方案,从而保持糖尿病儿童身体和心理的双重健康。目前在糖尿病营养治疗方面,我国需要更多相关的临床实践和研究以合理规范并推行适应我国糖尿病儿童青少年饮食生活习惯的营养治疗,提高我国儿童青少年糖尿病的血糖管理及生活质量。
参与本共识制定讨论的专家名单(按姓氏拼音排序):曹冰燕(首都医科大学附属儿童医院),陈临琪(苏州医学院附属儿童医院),陈瑞敏(福建省福州儿童医院),陈伟(北京协和医院),陈晓波(首都儿科研究所附属儿童医院),杜红伟(吉林大学第一医院),傅君芬(浙江大学医学院附属儿童医院),巩纯秀(首都医科大学附属北京儿童医院),郭立新(卫生部北京医院),李嫔(上海市儿童医院),刘戈力(天津医科大学总医院),刘霞(深圳市儿童医院),罗飞宏(复旦大学附属儿童医院),罗小平(华中科技大学附属同济医院),吕拥芬(上海市儿童医院),孟曦(首都医科大学附属北京儿童医院),王林(首都儿科研究所附属儿童医院),王新利(北京大学第三医院),卫海燕(河南省儿童医院),肖建中(北京清华长庚医院),肖新华(北京协和医院),熊丰(重庆医科大学附属儿童医院),杨金奎(首都医科大学附属北京同仁医院),杨勤兵(北京清华长庚医院),杨涛(南京医科大学第一附属医院),杨颖(中华糖尿病杂志),张梅(南京医科大学第一附属医院)
1.首先根据糖尿病儿童每天所需的饮食能量计算每日所需的食物交换份;
2.合理分配三大营养素的份数;
3.确定四大类(八小类)食物的交换份数;
4.确定食物份数的三餐分配,一般按照早、中、晚分别为食物量的1/5、2/5、2/5或均为1/3分配,可从每餐留取部分食物交换份作为加餐。每餐营养均衡,尽量做到每餐均含有碳水化合物、蛋白质、脂肪、纤维素等营养物质;
5.最后将食物份数换算为具体食物重量,制定饮食计划。
一名11岁糖尿病儿童的饮食计划:
1.确定每日所需能量1 800 kcal,计算所需的食物总交换份数:1 800/90=20份;
2.三大营养素的份数:碳水化合物份数=20×(50%~55%)≈11份,脂肪份数=20×(25%~35%)≈5份,蛋白质份数=20×(15%~20%)≈4份;
3.各类食物交换份数:
11份碳水化合物分配:谷薯类:9份,蔬菜类:1份,水果类:1份;
5份脂肪分配:油脂类:2份,肉蛋类:3份;
4份蛋白质分配:大豆类:2份,奶类:1份,肉蛋类:1份;
4.三餐食物分配见附表1。
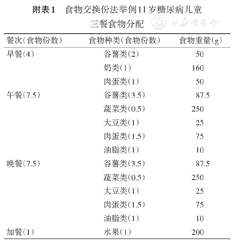
食物交换份法举例11岁糖尿病儿童三餐食物分配
食物交换份法举例11岁糖尿病儿童三餐食物分配
| 餐次(食物份数) | 食物种类(食物份数) | 食物重量(g) |
|---|---|---|
| 早餐(4) | 谷薯类(2) | 50 |
| 奶类(1) | 160 | |
| 肉蛋类(1) | 50 | |
| 午餐(7.5) | 谷薯类(3.5) | 87.5 |
| 蔬菜类(0.5) | 250 | |
| 大豆类(1) | 25 | |
| 肉蛋类(1.5) | 75 | |
| 油脂类(1) | 10 | |
| 晚餐(7.5) | 谷薯类(3.5) | 87.5 |
| 蔬菜类(0.5) | 250 | |
| 大豆类(1) | 25 | |
| 肉蛋类(1.5) | 75 | |
| 油脂类(1) | 10 | |
| 加餐(1) | 水果(1) | 200 |
使用碳水化合物计数法,首先需了解和熟悉食物中碳水化合物的含量。主要有两种计算碳水化合物的基本方法[54],包括以克为单位或以交换份为单位计算。碳水化合物交换份指的是将含有15 g碳水化合物的食物数量(奶类为12 g)作为1份"碳水化合物交换份",根据糖尿病儿童每日需要的"碳水化合物交换份"的量制定饮食计划。常见食物1份碳水化合物交换份的食物数量见附表2。可应用模型工具或使用成熟的软件协助患者计算食物碳水化合物的数量。此外,包装食品上的营养标签也是计算碳水化合物数量的重要工具,还有营养书籍可以帮助快速地了解食物的碳水化合物含量。例如:北京儿童医院糖尿病中心于2017年上线了以协助糖尿病儿童营养管理为主要目的APP——"甜蜜公社",除了有常见的管理糖尿病APP的功能外,还涵盖了低GI食谱推荐等更全面的内容,主要帮助糖尿病儿童家庭解决中餐食物营养计算和指导选用低GI食材。

常见食物1份碳水化合物交换份的食物数量
常见食物1份碳水化合物交换份的食物数量
| 食物名称 | 可食量 | 能量(kcal) | 蛋白质(g) | 脂肪(g) |
|---|---|---|---|---|
| 馒头、切片面包 | 35 g | 70 | 2 | 微量 |
| 面粉、大/小米、玉米 | 20 g | 70 | 2 | 微量 |
| 马铃薯 | 100 g | 70 | 2 | 微量 |
| 全脂奶 | 240 ml(奶粉35 g) | 150 | 8 | 8 |
| 低脂奶 | 240 ml(奶粉25 g) | 120 | 8 | 4 |
| 脱脂奶 | 240 ml(奶粉25 g) | 80 | 8 | 微量 |
| 叶类蔬菜 | 300 g | 75 | 微量 | 微量 |
| 草莓 | 250 g | 60 | 微量 | 微量 |
| 芒果、哈密瓜、西瓜 | 180~200 g | 60 | 微量 | 微量 |
| 柚子、菠萝、鸭梨、苹果、葡萄、樱桃 | 150~160 g | 60 | 微量 | 微量 |
| 桃子、桔子、猕猴桃 | 120~140 g | 60 | 微量 | 微量 |
| 荔枝、香蕉 | 70~90 g | 60 | 微量 | 微量 |
注:1 kcal=4.18 kJ;除奶类食品外,1份含15 g碳水化合物,奶类食品1份含12 g碳水化合物
碳水化合物计数法分为基本法和进阶法。基本碳水化合物计数法适用于所有药物治疗方案的糖尿病儿童,特别是胰岛素常规治疗(每日两次短效+中效胰岛素注射方案)的糖尿病儿童或药物和生活方式控制血糖的2型糖尿病儿童。前提是每日在相同的餐次(每日3次主餐和主餐间加餐)进食基本等量和同类的碳水化合物[55]。
进阶碳水化合物计数法在基本法的基础上,要求餐时胰岛素剂量与碳水化合物摄入量相匹配。应用进阶法首先要确定胰岛素-碳水化合物比值(I/Carb)和胰岛素敏感系数(insulin sensitivity factor,ISF),目的是计算校正胰岛素和餐时胰岛素剂量。进阶法增加了饮食的灵活性,对于食量及胃口不固定的小年龄糖尿病儿童非常实用,并可以降低低血糖的发生率。
1.确定每日能量需要量;
2.计算每日碳水化合物需要量,碳水化合物的需要量根据年龄、体力活动情况和总能量水平而定,通常为每日总能量的50%~55%,每克碳水化合物约可产生4 kcal的能量;
3.确定每日碳水化合物分配,运用碳水化合物交换份选择食物,制定食谱。
一名11岁糖尿病儿童的饮食计划:
1.确定每日所需能量1 800 kcal;
2.计算所需的碳水化合物交换份数=1 800×(50%~55%)/4/15≈15份;
3.三餐食物分配见附表3。
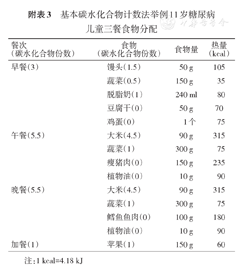
基本碳水化合物计数法举例11岁糖尿病儿童三餐食物分配
基本碳水化合物计数法举例11岁糖尿病儿童三餐食物分配
| 餐次(碳水化合物份数) | 食物(碳水化合物份数) | 食物量 | 热量(kcal) |
|---|---|---|---|
| 早餐(3) | 馒头(1.5) | 50 g | 105 |
| 蔬菜(0.5) | 150 g | 35 | |
| 脱脂奶(1) | 240 ml | 80 | |
| 豆腐干(0) | 50 g | 70 | |
| 鸡蛋(0) | 1个 | 75 | |
| 午餐(5.5) | 大米(4.5) | 90 g | 315 |
| 蔬菜(1) | 300 g | 75 | |
| 瘦猪肉(0) | 150 g | 235 | |
| 植物油(0) | 10 g | 90 | |
| 晚餐(5.5) | 大米(4.5) | 90 g | 315 |
| 蔬菜(1) | 300 g | 75 | |
| 鳕鱼鱼肉(0) | 100 g | 180 | |
| 植物油(0) | 10 g | 90 | |
| 加餐(1) | 苹果(1) | 150 g | 60 |
注:1 kcal=4.18 kJ
I/Carb是指每个单位的胰岛素对应多少克碳水化合物,比值大小与胰岛素敏感性有关,通常用"450法则"(短效胰岛素)或者"500法则"(速效胰岛素)来计算,I/Carb=450或500/每日胰岛素总剂量。一般将I/Carb起始值设为成人1∶15,儿童1∶(20~25)。I/Carb用于计算摄入的碳水化合物所对应的胰岛素剂量=摄入碳水化合物量(g)×(I/Carb)。
ISF是指1单位速效或短效胰岛素中和血糖的数量,通常用"1 500法则"(短效胰岛素或胰岛素抵抗的患者)或者"1 800法则"(速效胰岛素或胰岛素敏感的患者)来计算,ISF=1 800或1 500/每日胰岛素总剂量/18,一般ISF范围为2~5。通过ISF可以计算将餐前血糖降至目标血糖范围所需的胰岛素剂量。
根据餐前血糖水平高出或低于目标水平的数值,计算胰岛素的校正剂量,计算方法为:校正剂量=(实测血糖-目标血糖)/ISF(血糖单位为mg/dl)。若餐前低血糖则应先纠正低血糖,纠正低血糖时增加的碳水化合物数量不计入每日总量中。如果餐前血糖在目标范围内,则不需要矫正胰岛素剂量。
将要摄入的碳水化合物所对应的胰岛素剂量加上校正胰岛素剂量,即为本餐需要注射的胰岛素剂量。
一名11岁糖尿病儿童的每日胰岛素总量25 U(速效+长效),午餐为大米90 g、蔬菜300 g、瘦猪肉150 g、油10 g(碳水化合物总量82.5 g),餐前血糖11 mmol/L(目标血糖7 mmol/L)。
1.胰岛素-碳水化合物比值=500/25=20;
2.胰岛素敏感系数=1 800/25/18=4;
3.校正胰岛素剂量=(11-7)/4=1 U;
4.午餐前速效胰岛素剂量=82.5/20+1≈5 U。


























