
探讨负压封闭引流(VSD)技术对儿童急性创面新生肉芽组织内血管内皮生长因子(VEGF)表达及对巨噬细胞迁移的影响。
选取2013年3月至2015年3月因外伤所致四肢皮肤软组织撕脱及软组织缺损患儿40例,创面约为体表面积1%~3%,受伤后6~8 h内入院并急诊行清创治疗,在Ⅰ期行彻底清创治疗后按照随机数字表法均分为2组,每组各20例,研究组采用VSD处理,对照组采用传统的换药治疗。分别于治疗后第7天和第14天取创缘新生肉芽组织用免疫组织化学染色法(S-P法),高倍镜下观察VEGF表达及巨噬细胞数量的变化。
研究组在VSD治疗后VEGF在肉芽组织内血管内皮细胞表达明显较对照组多,VEGF标记指数在7 d、14 d时均高于对照组,差异有统计学意义(P<0.01);研究组及对照组的VEGF标记指数2个时间点相比较,14 d时VEGF标记指数均高于7 d,差异均有统计学意义(P<0.01)。VSD治疗后研究组巨噬细胞数在7 d时均高于对照组,差异有统计学意义(P<0.01);VSD治疗后14 d时研究组巨噬细胞数与对照组比较差异无统计学意义(P>0.05)。研究组2个时间点相比较,14 d与7 d巨噬细胞数差异无统计学意义(P>0.05);对照组2个时间点相比较,14 d时巨噬细胞数高于7 d,差异均有统计学意义(P<0.01)。
VSD治疗与常规换药相比,能够更好地提高VEGF的表达,加速创面愈合。VSD能增强创面巨噬细胞的迁移及活化,诱导组织细胞增生,使创面肉芽组织更好、更快的生长。相对于传统的常规换药,VSD技术能够对儿童大面积皮肤软组织损伤创面起到更加积极的疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
车祸碾压伤等高能量外伤所导致的患者皮肤软组织坏死或缺损,不仅合并骨、肌腱等深部组织外露,同时因创面被严重污染,极易发生创面感染[1]。因此,如何在早期合理的处治撕脱皮肤及大面积皮肤软组织缺损,是严重儿童创伤急救处理的难题之一。封闭负压引流(vacuum sealing drainage,VSD)技术于1992年由德国Fleischmann等[2]首创以来,其应用效果很快得到肯定并被推荐到各种软组织缺损和感染的临床治疗。我们以本科2012年1月至2014年6月收治的40例新鲜大面积软组织撕脱及缺损的患儿为研究对象,分别采用VSD技术及常规换药处理患儿创面,用免疫组织化学染色S-P法对比研究两种方法对肉芽组织内VEGF表达及对巨噬细胞增殖、迁移的影响。
武汉维斯第医用科技有限公司生产,包括:①医用泡沫敷料:白色,由高分子聚合材料聚乙烯醇合成,无免疫活性,耐腐蚀,溶于酒精,有良好的吸附性和透水性,质地柔软,其内置2根多侧孔硬质硅胶引流管,管径约为0.5 cm。②生物半透性粘贴薄膜:具有单方向透气功能,能防水,对皮肤无刺激性。③负压引流源:病区床头的可调控中心负压,维持压力在-80~-100 mmHg(-10.66~-13.33 kPa)[3]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)(多克隆)购于北京中杉金桥生物技术有限公司,CD68(克隆号:KP1)购于上海基因科技有限公司。
年龄小于14岁,性别不限,外伤后6~8 h内急诊行清创术后,因Ⅰ期术后难以闭合创面,创面大小至少在5 cm×5 cm以上。本研究在开始前经医院伦理委员会批准(JXSETYY-YXLW-2018006),患儿家属同意并签署自愿接受医学试验知情同意书后使用封闭负压吸引治疗。
在治疗期间出现对创面敷料出现过敏反应或创面严重感染者则剔除出实验。
以本科2012年1月至2014年6月收治的大面积软组织撕脱或缺损患儿为研究对象,共40例。其中,男25例,女15例;年龄3~13岁;均为车祸伤。其中合并骨折31例,创面均伴有不同程度的污染。皮肤缺损范围约为体表面积的1%~3%(按烧伤九分法估算)。
对所有新入院患儿均急诊行清创处理,清创后40例患儿按照随机数字表法分为研究组和对照组各20例。研究组:彻底清创后,用外敷料完整封闭整个创面,行持续负压吸引,维持压力在-80~-100 mmHg(-10.66~-13.33 kPa),并予抗感染治疗。对照组:对已行Ⅰ期清创的创面使用凡士林无菌纱布覆盖,并予每日换药,尽可能地选用相同抗生素抗感染治疗及其他临床对症支持用药。
在不影响患儿创面愈合的情况下,所有患儿分别于治疗后第7天及第14天更换敷料时于创缘取大小3 mm×3 mm×2 mm的新生肉芽组织。所取标本置于4%中性甲醛固定,石蜡包埋,4 μm厚连续切片、免疫组织化学染色、光学显微镜观察。
常规脱蜡至水后用PBS缓冲液冲洗。用柠檬酸缓冲液(pH=6.0)进行热修复,高压喷气后持续约2~3 min,自然冷却,PBS缓冲液冲洗。在每张切片加50 μl 3%过氧化氢,以阻断内源性过氧化物酶的活性,室温下孵育10 min。PBS缓冲液冲洗。甩去PBS液,每张切片加50 μl非免疫性动物血清,室温下孵育10 min。甩去血清,不洗,每张切片加50 μl一抗,4 ℃冰箱过夜。PBS缓冲液冲洗。甩去PBS液,每张切片加50 μl生物素标记的第二抗体,室温下孵育10 min。PBS缓冲液冲洗。甩去PBS液,每张切片加50 μl链霉菌抗生物素-过氧化物酶溶液,室温下孵育20 min。PBS缓冲液冲洗。甩去PBS液,每张切片加100 μl新鲜配制的DAB显色液,光学显微镜下观察,出现定位准确清晰的棕黄色颗粒为阳性。自来水冲洗,苏木素复染,0.1%HCl分化,温水返蓝,梯度酒精脱水,二甲苯透明,中性树胶封固。
每组每时相点各取3张切片,行免疫组织化学染色,并于显微镜下观察,胞浆呈褐色者为VEGF表达阳性细胞,以PBS替代一抗作为阴性对照,在每张切片中取5个非重叠高倍视野,随机记录9个方格内VEGF染色阳性和阴性细胞数,计算切片中的标记指数(LI)[4]。计算公式:LI=阳性细胞/(阳性细胞+阴性细胞)。
每组每时相点各取3张切片,进行免疫组织化学染色,并于显微镜下观察,细胞质和(或)细胞核内含棕黄色颗粒者为CD68表达阳性细胞,用PBS代替一抗作阴性对照,用已知阳性切片作阳性对照。每张切片参照Molin等[5]的方法随机选择5个高倍视野(×200,目镜×10,物镜×20)计数巨噬细胞数,取其平均数。
采用SPSS 13.0统计软件建立数据库,对两组均数的比较采用t检验,对多组均数的标记采用方差分析,检验水准为α=0.05。
在第7天时,研究组创面可见肉芽组织生长,周围组织无明显水肿,创缘周围有少许坏死组织,而对照组肉芽组织生长较少,且肉芽组织呈较粗大颗粒状的肉芽组织水肿改变,周围组织水肿仍有较多坏死。在第14天时研究组创面肉芽组织已完整覆盖创面,呈鲜红色细颗粒状,对照组亦可见肉芽组织生长,但周围仍少量坏死组织及渗出物。在高倍镜下亦可见血管管腔发育更成熟,呈多位类圆形,血管内皮细胞及支持细胞形态更完整,其内可见红细胞,周围可见淋巴细胞浸润。胶原纤维增多,成纤维细胞较常规换药组增生明显,无明显组织水肿。

研究组与对照组VSD治疗前后VEGF标记指数及巨噬细胞数比较( ±s)
±s)
研究组与对照组VSD治疗前后VEGF标记指数及巨噬细胞数比较( ±s)
±s)
| 组别 | 例数 | 治疗时间(d) | VEGF标记指数 | 巨噬细胞数(个) |
|---|---|---|---|---|
| 研究组 | 20 | 7 | 0.63±0.15ab | 102±15a |
| 14 | 0.93±0.11a | 111±26 | ||
| 对照组 | 20 | 7 | 0.32±0.11b | 78±11b |
| 14 | 0.75±0.08 | 118±13 |
注:相同治疗时间不同组间比较,aP<0.01;同组不同治疗时间比较,bP<0.01
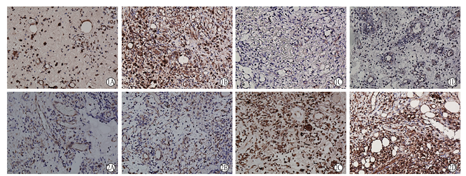
t检验及方差分析结果显示,VSD治疗后研究组VEGF标记指数在治疗第7天及第14天时均高于对照组(图1),且差异均有统计学意义(P均<0.01);研究组及对照组的VEGF标记指数2个时间点相比较,治疗第14天时VEGF标记指数均高于第7天,差异均有统计学意义(P均<0.01)。

儿童多活泼、好动,在0~14岁儿童中意外伤害是第一位死因[6]。儿童的多发伤常发生在学龄前期及青少年期,其中道路交通伤是最常见的致伤原因,其不仅存在着骨损伤及其他脏器损伤,往往也伴随着大面积软组织严重挫伤或皮肤撕脱性损伤[7]。传统的换药方法在处置创面过程中患儿因疼痛往往极度恐惧,使得后期依从性大大降低。我们常规应用的敷料一般是无菌纱布、棉垫等,其主要不足是肉芽组织易贴附于外敷料生长,因此在更换外敷料时也会损伤新生的肉芽组织使创面持续渗血。同时因外敷料材料的原因其脱落的微小纤维碎屑可散落在创面内,反复刺激创面产生炎症反应,易使创面迁延不愈[8]。由于换药治疗时间长,肉芽组织生长缓慢,在住院期间引起交叉感染的概率也大大增加。而VSD技术使外敷料紧贴创面并通过外界负压持续吸引,使皮肤软组织缺损的创面由开放变为封闭,使创面与外环境间相对隔离,更好的避免细菌在创面增殖,也避免因频繁更换外敷料而引起的二次感染及损伤[9]。同时本实验使用的外敷料无免疫活性,在所有参与本次实验研究的患儿中均未出现过敏反应及严重创面感染。
VEGF是一类具有高度生物活性的功能性糖蛋白,VEGF表达的调控受多种因素影响,如:缺血和创伤、相关生长因子和激素的诱导、细胞分化和转化等等,是一个复杂、多因素调节的过程[10]。而VEGF作为体内能促进血管内皮细胞增殖分化的重要因子,其多种生物学作用使它在促进损伤组织愈合的过程中起到重要作用[11]。本实验通过对比研究发现,在治疗第7天及14天时,研究组VEGF表达阳性细胞数均较对照组多,且在治疗第7天时,VEGF标记指数是对照组的2倍。而相关研究亦发现在缺氧环境下培养细胞,细胞内VEGF表达mRNA水平明显增高,提示缺氧可导致VEGF表达及释放[12]。说明VSD装置在治疗过程中使创面处于微氧状态,而在该状态下能加速启动VEGF表达基因的转录及翻译,使其在对比常规换药治疗时,能在创伤早期就使VEGF的表达迅速增加,从而加强肉芽组织内血管内皮细胞释放VEGF,促进肉芽组织内血管再生及成纤维细胞的增殖分化,从而加速肉芽组织生长。
在肉芽组织中炎性细胞常以巨噬细胞为主[13]。作为体内吞噬作用最强的细胞,巨噬细胞可由静息状态变为游走的活化巨噬细胞,活化后的巨噬细胞能分泌多种细胞因子参与创面修复。首先其释放的bFGF、EGF、TGF-β等多种细胞因子都能促进肉芽内血管的新生。同时,其分泌的胶原是细胞外基质的主要成分,而胶原的代谢结果会直接影响创面修复的质量[14]。其次在应激状态下的巨噬细胞能快速游走至损伤处,并有效吞噬已损伤的组织细胞、残留的异物及细菌,同时其表达释放的一些酶类及活性基团亦能抑制细菌定植,避免创面发生感染,为创面愈合提供一个稳定的外环境,从而使创面由炎症期迅速进入增生期。Gouttefangeas等[15]的研究证明,创面应用VSD治疗1周后,浸润于泡沫上的主要细胞是单核巨噬细胞和粒细胞,少量的T、B细胞群及自然杀伤细胞。本实验以CD68标记巨噬细胞,在治疗第7天时,研究组巨噬细胞计数明显高于对照组,差异有统计学意义(P<0.01);然而到第14天时,两组巨噬细胞数仍有所增加,但研究组与对照组比较差异无统计学意义(P>0.05)。表明在创伤初期,使用VSD能够较快地促进巨噬细胞向创面迁移,使创面更快地进入增生期,肉芽组织更早的开始增生,而常规换药处理则需较长的时间才会出现大量巨噬细胞活化迁移。这可能与VSD能促进血管增生,增加血流量,使巨噬细胞能更快向创面积聚,启动创面修复过程。同时VSD的持续引流作用使细菌的产生毒素不能在创面聚积,从而使避免其对巨噬细胞功能的抑制,使巨噬细胞能有效分泌多种细胞因子促进创面愈合。研究组在治疗第7天及14天时巨噬细胞计数差异无统计学意义,说明创面的愈合在治疗第7天时已进入增生期,巨噬细胞的增殖及迁移逐渐达到高峰并保持稳定,其在创面愈合的作用亦逐步稳定。而常规换药组则在治疗第14天时巨噬细胞数才达到稳定期,表明其创面愈合进度明显落后于研究组。
本研究提示,在创伤早期应用VSD技术处理创面能更好地促进VEGF的表达与释放,刺激肉芽组织内微血管的出芽生长,加速创面巨噬细胞的迁移及活化,相对传统的常规换药能明显加快患儿创面的愈合和避免创面感染。
无



























