
慢性肾脏病严重影响着人类寿命和生活质量,其中终末期肾病(ESRD)患者接受透析治疗日益增多。由于方法的限制,传统透析极大地限制了患者的活动性,因此可携带人工肾的研发成为满足患者多元化需求的新方向。目前的可携带人工肾是分别基于血液透析和腹膜透析发展而来,包括可穿戴人工肾(WAK)和生物可植入式人工肾(BAK)。可携带人工肾在临床前实验已初步获得了成功,可基本满足治疗需求。其有望实现可移动的持续透析治疗模式,显著降低ESRD患者的住院率和死亡率,节省医疗资源,同时显著提高患者的生活质量,满足患者回归正常生活的需求。综述了WAK和BAK的研究现状,并对其未来发展作了展望。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
我国社区人群中慢性肾脏病(chronic kidney disease,CKD)的发病率超过10%,据此估算我国成年CKD患者人数超过1.20亿[1],其中CKD 3期以上患者超过1 900万。糖尿病和高血压是CKD的主要病因,2017年全球有4.51亿糖尿病患者,预计到2045年将增至6.93亿[2],而2017年我国高血压患者已超过2.90亿[3],这意味着在未来数年甚至数十年内,我国的CKD患者人数将快速增长,接受血液净化(又名透析)治疗的患者将越来越多。终末期肾病(end-stage renal disease,ESRD)患者的最佳解决方案是肾移植,然而肾移植捐献者数量相对有限,不能满足当前的需求[4],因此绝大多数患者必须长时间甚至终身接受透析治疗。截至2016年,我国接受透析治疗的ESRD患者人数已超过52万。
目前,透析治疗方式分为两种:血液透析和腹膜透析[5]。血液透析是将患者血液引出体外,流经由中空纤维组成的透析器,通过对流和弥散方式与透析液进行交换,清除体内的代谢废物、维持电解质和酸碱平衡,并进行体内多余水分的清除,再将经过净化的血液回输至体内。血液透析技术作为目前最成熟的技术,可使患者初步回归正常生活[6],患者的血液透析生存时间普遍达20年以上甚至30年。腹膜透析是利用腹膜生物半透膜的特性,通过向腹腔内注入腹膜透析液并进行腹膜透析液的间断交换以清除毒素和水分的治疗方法。腹膜透析的治疗效果个体差异较大,但其对设备和场所的要求相对简易,已初步实现了移动透析和家庭透析。基于以上透析模式,可携带人工肾主要有以下两种:可穿戴人工肾(wearable artificial kidney,WAK)和生物可植入式人工肾(bio-implantable artificial kidney,BAK)。本文主要就国内外可携带人工肾的研究和应用进展作一综述。
血液透析的设备包括血液透析机、水处理器和透析器等。目前的血液透析设备是固定不可移动的,其中血液透析机和水处理器等占用了极大的空间,血液透析患者需前往医院接受每周3次、每次4 h的治疗;而定期血液透析对于血液中水分、毒素和电解质的清除为间歇性,患者在透析间期容易血压高、血钾高、血磷高,透析后患者会出现严重的疲劳感,活动能力亦受到影响。便携式血液透析的概念多年前即已被提出,其为更贴近生理条件的透析治疗模式,能提供持续性的溶质清除和超滤,更好地满足患者的多元化需求。
WAK的研发历史已超过30年,近年来,其研发进展大大加快,为其临床应用提供了更大的可能性。Bazaev等[7]开发了一种WAK,体外实验结果表明,该WAK可有效清除透析液中的代谢物,其工作模式足以维持患者血液稳定以及生理正常代谢物的浓度。Lee和Choi[8]设计了一种能有效分离废物尿素与血液的装置,提出了仅用微通道无膜和透析液即能进行透析的可能性,为开发可携带式人工肾提供了新的可能性。Ostadfar等[9]研究了人工肾过滤膜滤孔的最优几何设计结构以及减少孔堵塞的条件,结果表明,对于具有扩散器形状的孔来说,发散角(θ)为13.46°和入口直径(d)为1.5 μm时的压降最小。就血细胞的材料强度和尺寸而言,0.25~0.50 μm的入口直径和氮化硅材料制成的厚度为5 μm的膜是优异的选择。Moon等[10]研发了一种基于固定化酶丝素过滤器的过滤膜系统。上述研究成果均有望在未来应用于WAK系统中。
图1所示为美国食品药品监督管理局(FDA)已批准的可用于临床试验的第一款WAK设备,该设备使用可再生透析液技术,治疗所需透析液的量可低于400 ml,这为WAK的便携性提供了可能。同时,该设备体积小、质量轻,可实现24 h安全治疗,但对电池的续航能力提出了新要求[11]。在2016年的一项临床试验中,7例尿毒症血液透析患者接受了WAK治疗。结果显示,滤器的孔径能超滤清除部分中分子物质,对水、电解质平衡和小分子毒素的超滤清除完全能达到治疗要求;该设备24 h的治疗效果与目前血液透析模式4 h的治疗效果相当。WAK最为突出的优势是患者的满意度,使患者接受治疗不再局限于透析中心,无需固定于透析机上,而是更以患者为中心,患者在接受治疗的同时可进行多种活动,且所有患者均未报告透析后疲劳感。由于WAK治疗是24 h不间断进行,水、电解质和血磷的清除是缓慢持续进行,从而避免了脉冲式短时间大量清除带来的心血管风险。患者无需对水以及饮食中的钾和磷进行严格控制,血压波动明显减轻,这样既减少了降压药的服用剂量,也避免了透析时发生低血压和肌肉痉挛的风险。此外,所有患者在接受透析治疗的同时可停止服用磷结合剂,而血磷均可通过治疗有效滤过清除。WAK的初步实验结果基本满足了治疗要求,若其能成功应用于临床,除可用于CKD和ESRD治疗外,还完全可用于心功能衰竭和肝功能衰竭的治疗,以及多脏器衰竭危重患者的床旁移动治疗。
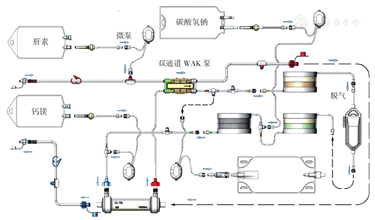

WAK—可穿戴人工肾
总之,便携式血液透析设备用于治疗需具备以下条件:设备要足够轻,足够便携,方便走动,且符合人体力学;操作界面简明友好,操作简单。
便携式持续治疗与医院大型透析机透析相比,单位时间清除水和溶质的能力有限,效率相对低下,为达到足够的治疗效果,所需的治疗时间较长,因此便携式血液透析设备需具备以下特点:①电池的续航时间需足够长,质量足够轻,且随时可在线充电。②透析液能再生、循环使用,才能在有效清除的同时避免携带大量透析液。③由于血液循环速度慢、管路细,透析器的面积和容量也有限,故透析管和透析器膜的材料生物相容性应足够好,最好同时具备抗凝和抗菌特性,才能在避免抗凝药过度使用的同时保障治疗安全。
目前,WAK需改进的方面:增加患者自行操作的可行性和安全性;电池应具有高容量和稳定的输出功率;材料的抗凝和抗菌性需加强[11]。另外,WAK技术也面临着一些迫切需要解决的问题,Kooman等[12]提出将WAK直接接入血液循环存在较大风险,如患者在使用过程中设备意外断开连接的情况下会出现大量失血和气体栓塞。
腹膜透析本身即为移动透析的第一步[13]。腹膜透析应用于临床之初,即有相当多的年轻患者选择接受腹膜透析,最大原因就是希望工作和家庭生活能尽量不受治疗的影响。基于腹膜透析技术的WAK模型(图2)由Ronco和Fecondini[14]提出,该模型显示了可穿戴的腹膜透析系统可能成为自动化腹膜透析或持续非卧床腹膜透析的一种替代方案,从而改善腹膜透析质量,实现真正意义上的移动腹膜透析概念。然而该模型的不足之处在于,腹膜透析本身对于溶质清除和超滤的个体差异性导致治疗效果不稳定,此外,透析设备与腹腔相连通,同样存在感染以及体外连接突然断开等较大的安全问题。


如前所述,基于血液透析和腹膜透析基础上发展而来的WAK虽然初步实现了移动透析的目的,但需持续的血液循环或腹膜透析液循环,存在一定的血液或腹腔感染、空气栓塞甚至腹腔脏器损伤的风险。因此,若能把透析设备植入体内,无需频繁操作连接血流或连通腹腔将是更为理想的设计。
BAK是在血液透析与腹膜透析原理基础上发展起来的,即将过滤器与含有肾脏上皮细胞的生物反应器单元串联后植入腹腔,过滤血液或腹水,以提供超滤、运输、清除、代谢、内分泌以及免疫调节的功能,是利用微机械技术来制造能模拟肾脏形态和功能的生物混合系统。BAK需要实现的关键目标包括毒素清除、细胞外液量的稳态、装置寿命以及功率需求。此外,BAK的使用期限必须足够长[11]。
对于患者来说,BAK真正实现了移动透析,可避免由于肾移植供应受到限制或连续性透析治疗对患者病情造成的影响。与体外血液循坏必须反复打开和关闭系统相比,BAK可直接与髂血管永久连接,从而减少血液循环的复杂性,降低与血液循环相关的感染和意外断开的风险。
朱文等[15]将微流道加工技术与细胞工程的方法相结合,制备出同属具有肾小球过滤和肾小管生理功能的人工肾芯片装置,研究结果表明,具有6层生物芯片的微透析装置具有很好的清除功能,为发展可携带式或可植入式多功能复合的人工肾透析系统奠定了基础。
Ota等[16]开发了一种由微流体通道和透析膜组成的可植入多层透析装置(图3),并得出电解蚀刻是形成无生物污染通道壁的最佳技术的结论。该装置可选择性地允许低相对分子质量物质如钠、钾、尿素以及肌酐等从血液中过滤出来,同时保持血液中高相对分子质量分子如白蛋白、红细胞等的浓度。该装置是在生理血液循环推动下工作,不使用透析液,故无需具有泵的透析液储罐。
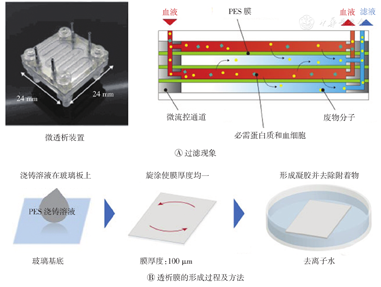

PES—聚醚砜超滤膜
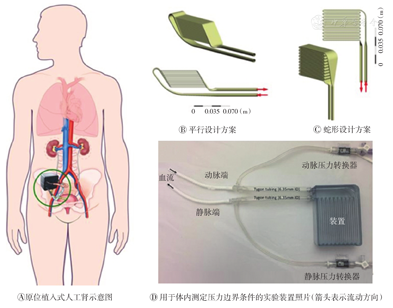
有文献报道,聚乙二醇涂敷的硅膜具有良好的生物相容性[17],可作为BAK的辅助装置支架。硅纳米孔膜允许的过滤速率为30 ml/min,而硅纳米孔平台上连接的带有肾小管细胞的生物反应器可选择性重吸收水和电解质[18]。使用硅膜阵列构建的血滤器来提供超滤功能的BAK需要合适的血流路径以确保体内稳定操作,Buck等[19]评估了将血液分配至膜阵列的两种流动路径(平行流动和蛇形流动)下血栓形成的可能性,结果表明,平行排列的流动路径降低了血栓形成的可能性,更适用于BAK(图4)。

肾上皮细胞芯片人工肾,是将肾上皮细胞铺在多孔碳平板上组装成多个透气透水的聚碳酸酯小室,可使液体流经人工肾,带来氧与养料,带走细胞代谢物(图5)。肾上皮细胞芯片人工肾总质量约60 g,携带监测装置,可实时监测温度和氧浓度;还携带泵,可使液体流动,保持细胞活性。肾上皮细胞芯片人工肾植入患者或实验动物的腹腔后,由泵推动腹膜透析液(约1 000 ml)不停地通过细胞芯片小室,每天更换1次,清除人工肾代谢产物。肾上皮细胞芯片人工肾已初步在大型动物实验以及小型临床前实验取得了成功,治疗持续7~14 d后肾上皮细胞仍能保持良好的活性。肾上皮细胞芯片人工肾与传统透析相比优势在于具有便携性、免疫功能、代谢功能和内分泌功能,体积小、重量轻,可植入体内,且在外观上具有优势。但肾上皮细胞芯片人工肾对于清除的液体量控制相对不够准确[20]。
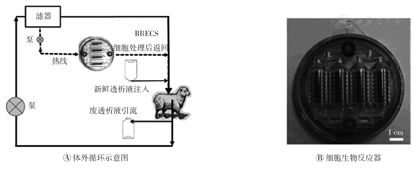

BRECS—生物人工肾上皮细胞系统
目前已开发出WAK,人体试验也已成功进行,但在实际应用中,仍有许多问题需要解决,如可穿戴设备的安全性、如何避免感染以及血液循环的突然断开等。便携、连续和无需透析液的BAK的制造与应用仍是治疗肾病的方向,以最终实现血液的连续净化与超滤,防止机体内部环境的波动,同时高效率去除尿毒症毒素。此外,具有肾类似结构与功能,并允许过滤、分泌和吸收水、溶质等的肾脏生物工程移植替代物的研究也是未来研究的重点。
无



























