
比较IPI、美国国家综合癌症网络IPI(NCCN-IPI)及年龄调整的IPI(aa-IPI)三种预后分层模型在弥漫大B细胞淋巴瘤(DLBCL)患者中的预后分层能力。
回顾性分析2003年1月至2012年12月311例初治DLBCL患者资料,根据治疗方案将患者分为CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)方案及利妥昔单抗(R)-CHOP方案组,分别采用IPI、NCCN-IPI及aa-IPI对DLBCL患者进行危险度分层。采用Harrell’s C统计评价不同模型的预后分层能力。
①311例患者中接受CHOP方案治疗者128例,接受R-CHOP方案治疗者183例。②CHOP方案组患者的5年总生存(OS)率结果显示,aa-IPI(71.0%对25.0%,P<0.001)、NCCN-IPI(59.7%对26.8%,P<0.001)和IPI(47.6%对36.6%,P=0.003)均能区分中低危和中高危组患者,但前两者区分效果似乎更佳;而R-CHOP方案组,NCCN-IPI拥有更好的预后分层能力,其低危、中低危、中高危患者的5年OS率分别为96.0%、83.0%、66.5%(P=0.009)。③Harrell’s C分析结果显示,IPI、NCCN-IPI及aa-IPI预测接受CHOP方案者OS的一致性指数(C-index)分别为0.546、0.667、0.698;预测接受R-CHOP方案者OS的C-index分别为0.611、0.654、0.695。④在≤60岁患者中,IPI、NCCN-IPI、aa-IPI预测接受CHOP方案者OS的C-index分别为0.534、0.675、0.698;预测接受R-CHOP方案者OS的C-index分别为0.584、0.648、0.695。
NCCN-IPI对于接受利妥昔单抗联合化疗的DLBCL患者有较好的预后分层能力,而aa-IPI对于较年轻的DLBCL患者预后分层能力可能更佳。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)中最常见的亚型[1]。我国DLBCL的发病率较国外更高,约占NHL的45.8%,占所有淋巴瘤的40.1%[2]。利妥昔单抗联合化疗的广泛应用在显著改善DLBCL预后的同时,也影响了DLBCL的预后分层指标[3,4,5,6]。IPI作为DLBCL最常用的预后分层指标,在利妥昔单抗时代,其甄别危险分层的能力明显受限[7]。为此在IPI的基础上,逐渐发展出年龄调整的IPI(Age adjusted IPI,aa-IPI)和美国国家综合癌症网络IPI(National comprehensive cancer network-IPI,NCCN-IPI)用于DLBCL的预后分层。然而对于IPI、aa-IPI和NCCN-IPI三种预后分层模型哪种更适合于我国DLBCL患者尚无报道。在本研究中我们回顾性分析了本院收治的311例初治DLBCL患者的临床资料,评价IPI、aa-IPI及NCCN-IPI的预后分层能力。
本研究纳入2003年1月至2012年12月本院诊治的311例初发DLBCL患者,所有患者均经淋巴结或淋巴结外侵犯部位病理组织活检确诊为DLBCL,并依据WHO 2008年淋巴造血系统肿瘤分类标准进行诊断[8],排除HIV感染、特殊类型的DLBCL(包括原发纵隔、中枢神经系统、血管内或睾丸淋巴瘤)、转化的NHL及移植后淋巴细胞增殖性疾病等。
收集患者的年龄、性别、生化指标、病理组织学特征、免疫组化、影像学及骨髓检查等资料。根据患者接受的治疗方案分为CHOP和R-CHOP方案组。所有患者均接受6~8个疗程化疗。CHOP方案具体为:环磷酰胺750 mg/m2,第1天;多柔比星40~50 mg/m2或吡柔比星40~50 mg/m2或脂质体多柔比星25~30 mg/m2,第1天;长春新碱1.4 mg/m2(最大剂量2 mg)或长春地辛2.8 mg/m2,第1天;泼尼松100 mg/m2,第1~5天。R-CHOP方案是在CHOP方案基础上联合利妥昔单抗(375 mg/m2,第0天)。
临床分期参照Ann Arbor分期标准[9]。所有患者分别采用IPI、NCCN-IPI、aa-IPI对预后进行判断[10,11],其评分下的危险分层详见表1。
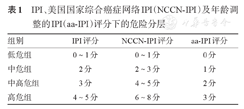
IPI、美国国家综合癌症网络IPI(NCCN-IPI)及年龄调整的IPI(aa-IPI)评分下的危险分层
IPI、美国国家综合癌症网络IPI(NCCN-IPI)及年龄调整的IPI(aa-IPI)评分下的危险分层
| 组别 | IPI评分 | NCCN-IPI评分 | aa-IPI评分 |
|---|---|---|---|
| 低危组 | 0~1分 | 0~1分 | 0分 |
| 中危组 | 2分 | 2~3分 | 1分 |
| 中高危组 | 3分 | 4~5分 | 2分 |
| 高危组 | 4~5分 | 6~8分 | 3分 |
应用SPSS17.0软件进行统计学分析。非正态分布计量资料用中位数表示,组间比较采用Mann-Whitney U检验。生存分析采用Kaplan-Meier曲线法,生存率的比较采用Log-rank检验;总生存(OS)期定义为确诊日至患者死亡或末次随访的间隔时间。无事件生存(EFS)期定义为确诊日至疾病进展、复发、死亡或末次随访的间隔时间。采用Harrell’s C统计评价模型的预后分层能力。以P<0.05(双侧)为差异有统计学意义。
311例患者中,男199例,女112例,男女比例1.77∶1,中位年龄49(13~81)岁。≤60岁者241例(77.5%);Ann Arbor分期Ⅲ~Ⅳ期者191例(61.4%);LDH升高者161例(51.8%);ECOG评分≥2分者94例(30.2%);结外累及>1处者151例(48.6%)。性别、年龄、Ann Arbor分期、ECOG评分、LDH水平及结外累及数在CHOP组及R-CHOP组差异均无统计学意义(P值均>0.05)(表2)。
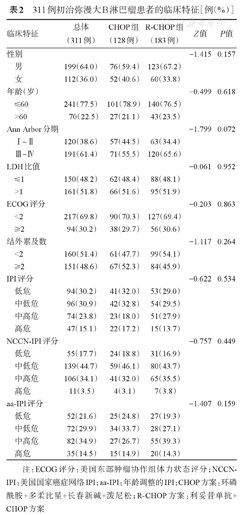
311例初治弥漫大B淋巴瘤患者的临床特征[例(%)]
311例初治弥漫大B淋巴瘤患者的临床特征[例(%)]
| 临床特征 | 总体(311例) | CHOP组(128例) | R-CHOP组(183例) | Z值 | P值 | |
|---|---|---|---|---|---|---|
| 性别 | -1.415 | 0.157 | ||||
| 男 | 199(64.0) | 76(59.4) | 123(67.2) | |||
| 女 | 112(36.0) | 52(40.6) | 60(33.8) | |||
| 年龄(岁) | -0.499 | 0.618 | ||||
| ≤60 | 241(77.5) | 101(78.9) | 140(76.5) | |||
| >60 | 70(22.5) | 27(21.1) | 43(23.5) | |||
| Ann Arbor分期 | -1.799 | 0.072 | ||||
| Ⅰ~Ⅱ | 120(38.6) | 57(44.5) | 63(34.4) | |||
| Ⅲ~Ⅳ | 191(61.4) | 71(55.5) | 120(65.6) | |||
| LDH比值 | -0.061 | 0.952 | ||||
| ≤1 | 150(48.2) | 62(48.4) | 88(48.1) | |||
| >1 | 161(51.8) | 66(51.6) | 95(51.9) | |||
| ECOG评分 | -0.203 | 0.863 | ||||
| <2 | 217(69.8) | 90(70.3) | 127(69.4) | |||
| ≥2 | 94(30.2) | 38(29.7) | 56(30.6) | |||
| 结外累及数 | -1.117 | 0.264 | ||||
| <2 | 160(51.4) | 61(47.7) | 99(54.1) | |||
| ≥2 | 151(48.6) | 67(52.3) | 84(45.9) | |||
| IPI评分 | -0.622 | 0.534 | ||||
| 低危 | 94(30.2) | 41(32.0) | 53(29.0) | |||
| 中低危 | 96(30.9) | 42(32.8) | 54(29.5) | |||
| 中高危 | 74(23.8) | 23(18.0) | 51(27.9) | |||
| 高危 | 47(15.1) | 22(17.2) | 15(13.7) | |||
| NCCN-IPI评分 | -0.757 | 0.449 | ||||
| 低危 | 55(17.7) | 24(18.8) | 31(16.9) | |||
| 中低危 | 139(44.7) | 59(46.1) | 80(43.7) | |||
| 中高危 | 106(34.1) | 41(32.0) | 65(35.5) | |||
| 高危 | 11(3.5) | 4(3.1) | 7(3.8) | |||
| aa-IPI评分 | -1.407 | 0.159 | ||||
| 低危 | 52(21.6) | 25(24.8) | 27(19.3) | |||
| 中低危 | 72(29.9) | 34(33.7) | 28(27.1) | |||
| 中高危 | 82(34.9) | 27(26.7) | 55(39.3) | |||
| 高危 | 35(14.5) | 15(14.9) | 20(14.3) | |||
注:ECOG评分:美国东部肿瘤协作组体力状态评分;NCCN-IPI:美国国家癌症网络IPI;aa-IPI:年龄调整的IPI;CHOP方案:环磷酰胺+多柔比星+长春新碱+泼尼松;R-CHOP方案:利妥昔单抗+CHOP方案
在311例患者中,128例接受CHOP治疗、183例接受R-CHOP治疗。R-CHOP组中13例患者接受了造血干细胞移植一线巩固治疗。CHOP组和R-CHOP组患者的5年OS率(54.3%对79.3%,χ2=21.604,P<0.001)及EFS率(44.7%对66.9%,χ2=15.105,P<0.001)差异有统计学意义。
在CHOP、R-CHOP组患者中,根据IPI、NCCN-IPI、aa-IPI评分各危险组患者的分布差异均未见统计学意义(P值均>0.05)(表2)。
CHOP方案组患者的5年OS率统计结果显示,aa-IPI(71.0%对25.0%,P<0.001)、NCCN-IPI(59.7%对26.8%,P<0.001)和IPI(0.47.6%对36.6%,P=0.003)均能较好地区分中低危和中高危组患者,但前两者区分效果似乎更佳(图1)。在R-CHOP方案组中,NCCN-IPI较IPI、aa-IPI拥有更好的预后分层能力,其低危组、中低危组、中高危组患者的5年OS率分别为96.0%、83.0%、66.5%(P=0.009)(图2)。
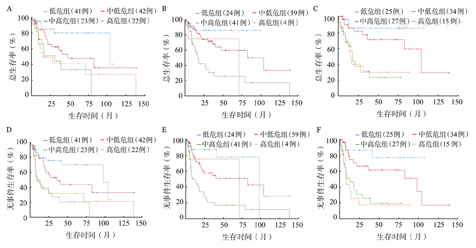

IPI评分(A、D);美国国家癌症网络IPI评分(B、E);年龄调整的IPI评分(C、F)
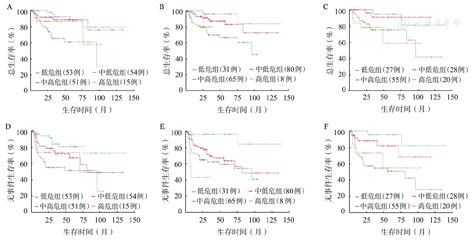

IPI评分(A、D);美国国家癌症网络IPI评分(B、E);年龄调整的IPI评分(C、F)
Harrell’s C分析结果显示,在所有患者中,无论是接受CHOP方案还是接受R-CHOP方案,NCCN-IPI预测OS、EFS的一致性指数(C-index)均高于IPI(表3)。在≤60岁患者中,针对接受CHOP方案者,IPI、NCCN-IPI、aa-IPI预测OS的C-index分别为0.534、0.675、0.698,预测EFS的C-index分别为0.678、0.557、0.704;针对接受R-CHOP方案者,预测OS的C-index分别为0.584、0.648、0.695,预测EFS的C-index分别为0.570、667、0.664;aa-IPI的危险评估能力可能较IPI、NCCN-IPI更佳。
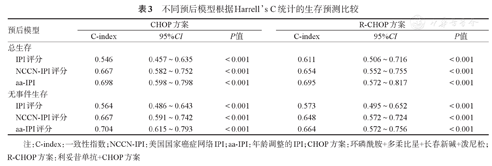
不同预后模型根据Harrell’s C统计的生存预测比较
不同预后模型根据Harrell’s C统计的生存预测比较
| 预后模型 | CHOP方案 | R-CHOP方案 | |||||
|---|---|---|---|---|---|---|---|
| C-index | 95%CI | P值 | C-index | 95%CI | P值 | ||
| 总生存 | |||||||
| IPI评分 | 0.546 | 0.457~0.635 | <0.001 | 0.611 | 0.506~0.716 | <0.001 | |
| NCCN-IPI评分 | 0.667 | 0.582~0.752 | <0.001 | 0.654 | 0.552~0.755 | <0.001 | |
| aa-IPI | 0.698 | 0.598~0.798 | <0.001 | 0.695 | 0.572~0.817 | <0.001 | |
| 无事件生存 | |||||||
| IPI评分 | 0.564 | 0.486~0.643 | <0.001 | 0.573 | 0.495~0.652 | <0.001 | |
| NCCN-IPI评分 | 0.667 | 0.591~0.742 | <0.001 | 0.648 | 0.572~0.724 | <0.001 | |
| aa-IPI评分 | 0.704 | 0.615~0.793 | <0.001 | 0.664 | 0.572~0.756 | <0.001 | |
注:C-index:一致性指数;NCCN-IPI:美国国家癌症网络IPI;aa-IPI:年龄调整的IPI;CHOP方案:环磷酰胺+多柔比星+长春新碱+泼尼松;R-CHOP方案:利妥昔单抗+CHOP方案
利妥昔单抗联合化疗的广泛应用对IPI在DLBCL中的预后分层能力提出了极大的挑战,为此先后发展出aa-IPI及NCCN-IPI。但是目前国内尚无关于三者在DLBCL中预后分析能力的评价。
自1993年正式提出以来,IPI广泛应用于评价DLBCL的危险分层已有20余年。其通过年龄、LDH、ECOG评分、Ann Arbor分期、结外累及数目5个指标将患者分为低危、中低危、中高危及高危4个危险组,5年OS率分别为84.5%、70.1%、53.1%和64.2%[10]。在本研究中我们采用IPI分层方法对R-CHOP方案组患者的预后情况进行分析,低危组与中低危组、中高危组与高危组的5年OS率差异无统计学意义,与Ngo等[12]的研究结果一致。提示利妥昔单抗时代,IPI并不足以将预后不同的DLBCL区分开来。
针对≤60岁的年轻患者,欧美工作组同时还提出了aa-IPI评分系统[10],仅纳入LDH、ECOG评分、Ann Arbor分期三个因素进行危险分层。我们根据aa-IPI评分系统对接受CHOP方案治疗的患者进行危险分层,低危、中低危、中高危及高危患者的5年OS率分别为85.3%、71.0%、25.0%和30.0%,与上述结果大致相同。国内目前尚无aa-IPI评分用于DLBCL预后分层的报道。我们的研究结果显示,对于接受CHOP方案治疗的DLBCL患者,aa-IPI能够很好地区分低危、中低危及中高危患者,结果与Ngo等[12]的报道相似。Harrell’s C统计显示,针对接受CHOP方案者,aa-IPI预后分层能力优于IPI及NCCN-IPI,与生存分析结果一致。GELA和MInT试验均证实利妥昔单抗可明显改善老年和年轻低危患者的预后。对于接受R-CHOP方案者,尽管Harrell’s C统计显示aa-IPI的危险评估能力可能较IPI、NCCN-IPI更佳,但根据aa-IPI评分的低危、中低危、中高危及高危患者的5年OS率分别为94.1%、88.2%、76.7%和58.5%,提示利妥昔单抗的应用使aa-IPI对危险分层的甄别能力受限。
Zhou等[11]于2014年在原有IPI的基础上,进一步改进提出NCCN-IPI模型,其特点为:①年龄细化。研究显示随着年龄的增长,DLBCL基因变异(例如:MYC、Bcl-2、Bcl-6等)也随之累积。Zhou等[11]的研究数据显示年龄与生存呈一定的线性关系,且以年龄≤40岁为基线,15~20岁为增幅拟合的模型最佳。②LDH标准化。仅将LDH分为正常及升高,无法精确反映患者的肿瘤负荷。有研究结果显示LDH升高倍数与生存明显相关[13]。③结外部位具体化,主要包括骨髓、中枢神经系统、胃肠道及肺等重要器官对生存影响较大。在本研究中我们采用NCCN-IPI评分,各危险组患者的分布比例为17.7%、44.7%、34.1%、3.5%。R-CHOP方案治疗组中,基于NCCN-IPI划分的低危、中低危及中高危组患者5年OS率分别为92.0%、85.0%、67.0%(高危组因例数过少难以得出结果),与Zhou等[11]报道的研究结果相似。
Harrell’s C统计由Harrell等[14]于1982年提出,用于有删失情况下比例风险回归模型的风险预测能力评价。该值范围由0到1,其值越大说明模型的预测能力越强。该方法自提出以来,在肿瘤预后、基因等领域被广泛应用[15,16]。Harrell’s C统计中C-index 0.50~0.70为较低准确度,0.71~0.90为中等准确度,高于0.9为高准确度。本研究中我们使用Harrell’s C统计进一步评价IPI、NCCN-IPI、aa-IPI在DLBCL中预后分层能力,尽管在CHOP及R-CHOP方案组NCCN-IPI、IPI的C-index基本均低于0.70,准确度较低,但两组NCCN-IPI及aa-IPI预测OS及EFS的C-index均明显高于IPI,其结果与生存分析结果一致。
综上,NCCN-IPI对于接受利妥昔单抗联合化疗的DLBCL患者具有更好的预后分层能力,而对于单纯化疗的较年轻DLBCL患者,aa-IPI的预后分层能力更佳。但是我们必须注意到,不同IPI分层仅仅基于不同临床特征来评价患者的预后,并不能反应DLBCL的分子生物学特征[12]。综合宿主、肿瘤分子生物学特性及其治疗反应等多种综合指标才能更好的对DLBCL进行预后分层。年轻高危的患者目前尚无标准治疗方案,如何精准地识别这部分群体是指导治疗方案选择的关键。



























